Como indicado nas secções anteriores, a molécula de água polar permite que as moléculas de água formem ligações umas com as outras. Estas ligações são referidas como ligações de hidrogénio. Se considerarmos o cloreto de sódio (sal), um composto contendo ligações iónicas, podemos demonstrar que simplesmente colocando sal de mesa na água, por exemplo, podemos reduzir a atracção electrostática entre os iões sódio e cloreto em 80 vezes. À medida que mais e mais iões de sódio e cloro são libertados pelo enfraquecimento da atracção electrostática que os mantém juntos, tornam-se rodeados pelas moléculas polares da água – o que é designado por “hidratação”.”

A água dissolve mais substâncias do que qualquer outro líquido comum, quebrando “sais” em “iões” componentes (por exemplo NaCl em Na+ e Cl-) e hidratando esses iões para evitar a sua interacção. Assim, as moléculas de água polar têm uma atracção por iões (átomos ou grupos de átomos com carga), onde “catiões” são iões com carga positiva e “aniões” têm carga negativa. A maioria dos elementos tem altas solubilidades na água, o que significa que grandes concentrações desses elementos podem acumular-se antes que a capacidade das moléculas de água para isolar os iões seja excedida. O ponto em que Na e Cl, por exemplo, começariam a precipitar um sal na água do mar é denominado “saturação”. Para NaCl (o mineral “halita”) isto só ocorre a partir da água do mar actual quando ocorre a evaporação e o volume de água do mar é reduzido para cerca de 10% do seu volume original.
A água do mar é essencialmente uma solução de NaCl que apresenta uma concentração média de 35 g de NaCl/kg de água (ou 3,5% de sal). Na e Cl compõem mais de 85% do total de sólidos dissolvidos (sal), mas há outros iões importantes presentes. A relativa abundância de iões na água do mar está em ordem: Cl, Na, SO4, Mg, Ca, K. Juntos, estes iões constituem >99% dos sólidos dissolvidos em água do mar. Com apenas quatro outros elementos – HCO3 (bicarbonato), Br, Sr, B, F – temos 99,99% de todos os sólidos dissolvidos. As cargas devem equilibrar-se, pelo que a carga positiva associada a Na+, Mg+2, Ca+2, K+ é igual à carga negativa associada a Cl-, SO4-2 (e HCO3-). Não pensamos que não seria desejável de outra forma. Pense no que seria o fluxo da corrente do mar para si, sentado na praia, se as cargas não fossem equilibradas – chocante!
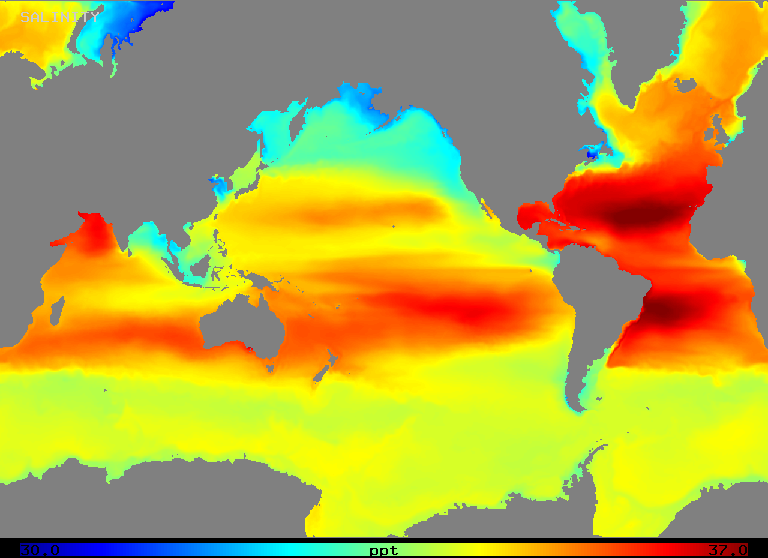
Salinidade varia num intervalo de cerca de 32 a 37 o/oo em mar aberto, como ilustra a Figura 2 (abaixo). Note-se que as áreas de maior salinidade ocorrem em regiões de maior evaporação líquida, como seria de esperar.
Todas as outras substâncias dissolvidas na água do mar estão em concentrações muito baixas (parte por milhão ou bilião) (ppm ou ppb; 10-6 a 10-9). Isto inclui nutrientes importantes tais como fosfato e nitrato que são ciclados por organismos (elementos chamados “bio-limitantes”) e essenciais para a vida. Muitos metais têm concentrações vestigiais (queres ficar rico? Há cerca de 9 milhões de toneladas de ouro dissolvido na água do mar, o que é aproximadamente igual a todo o ouro extraído na terra ao longo da história).
Como indicado anteriormente, a evaporação da água do mar produz uma sequência previsível de sais minerais (os minerais ficam saturados a um determinado ponto). Após evaporação de alguns % da massa de água CaCO3 (calcita) precipita; após evaporação de 81%, CaSO4 (gesso) é totalmente precipitado; após evaporação de cerca de 90,5%, NaCl (halita) é totalmente precipitado; com 96% de evaporação, os sais K e Mg (c/ SO4 e Cl) caem. Há sal suficiente no oceano para cobrir a terra com uma camada de 170 m de espessura. Depósitos naturais de oceanos antigos como este são chamados “evaporitos”