Das elektrophile Kohlenstoffatom von Aldehyden und Ketonen kann sowohl von Aminen als auch von Alkoholen nucleophil angegriffen werden. Das Endergebnis des Angriffs durch ein Amin-Nukleophil ist eine funktionelle Gruppe, in der die C=O-Doppelbindung durch eine C=N-Doppelbindung ersetzt ist, und wird als Imin bezeichnet. (Ein äquivalenter Begriff ist „Schiffsche Base“, aber wir werden in diesem Buch durchgehend „Imin“ verwenden). Erinnern Sie sich aus Abschnitt 7.5B, dass Imine einen pKa-Wert von etwa 7 haben, so dass sie bei physiologischem pH-Wert entweder als protoniert (Iminium-Ionen-Form) oder neutral (Imin) dargestellt werden können.
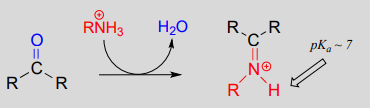
Iminiumionenbildung:
Mechanismus (enzymatisch):
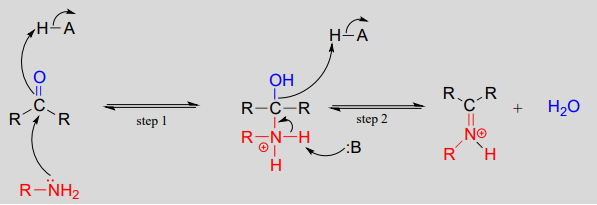
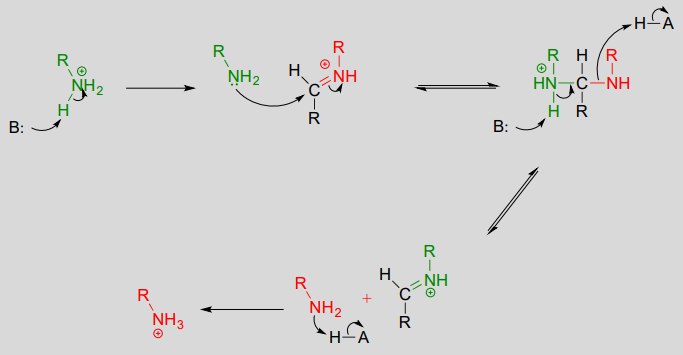
Mechanistisch umfasst die Bildung eines Imins zwei Schritte. Zunächst greift der Amin-Stickstoff den Carbonyl-Kohlenstoff in einem nucleophilen Additionsschritt an (Schritt 1), der der Hemiacetal- und Hemiketalbildung sehr ähnlich ist. Basierend auf Ihrem Wissen über den Mechanismus der Acetal- und Ketalbildung könnten Sie erwarten, dass der nächste Schritt der Angriff durch ein zweites Amin wäre, um eine Verbindung mit einem an zwei Amingruppen gebundenen Kohlenstoff zu bilden – die Stickstoffversion eines Ketals oder Acetals. Stattdessen passiert als Nächstes (Schritt 2 oben), dass die einsamen Elektronenpaare des Stickstoffs den Sauerstoff vom Kohlenstoff „wegschieben“ und eine \(C=N\)-Doppelbindung (ein Iminium) und ein verdrängtes Wassermolekül bilden.
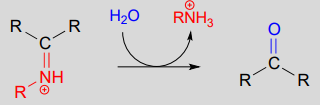
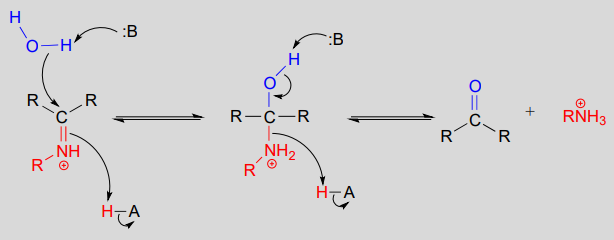
Die Umwandlung eines Iminiums zurück zu einem Aldehyd oder Keton ist ein hydrolytischer Prozess (Bindungen werden durch ein Wassermolekül gebrochen) und ist mechanistisch gesehen einfach die Umkehrung der Iminiumbildung:
Hydrolyse eines Iminium-Ions:
Mechanismus (enzymatisch):
Kohlenstoff-Kohlenstoff-Bindungsbildende Enzyme, die Aldolasen genannt werden (die wir in Kapitel 12 ausführlich behandeln), bilden oft Iminium-Bindungen zwischen einem Carbonyl-Kohlenstoff eines Substrats und einem Lysin-Rest im aktiven Zentrum des Enzyms, wie in dieser Aldolase-Reaktion aus dem Calvin-Zyklus:
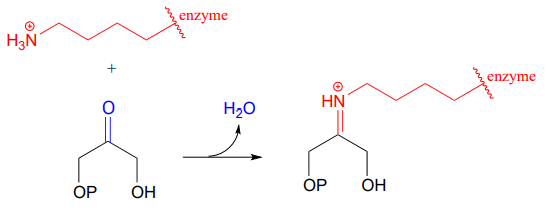
Nachdem die Kohlenstoff-Kohlenstoff-Bindung, die Teil einer Aldolase-Reaktion ist, abgeschlossen ist, wird die Iminium-Bindung hydrolysiert, wodurch das Produkt freigesetzt wird, so dass es aus dem aktiven Zentrum herausdiffundieren und ein weiterer katalytischer Zyklus beginnen kann.
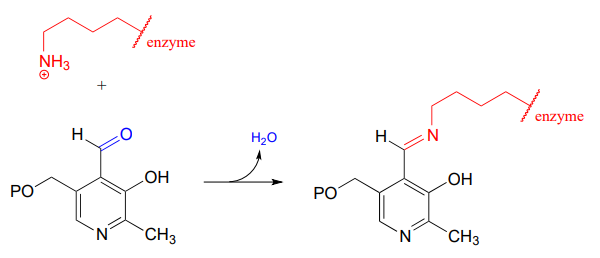
Dann wird die \(PLP\)-Lysin-Imin-Bindung gegen eine Imin-Bindung zwischen \(PLP\) und der Aminogruppe des Substrats ausgetauscht, was als Transiminierung bezeichnet werden kann.
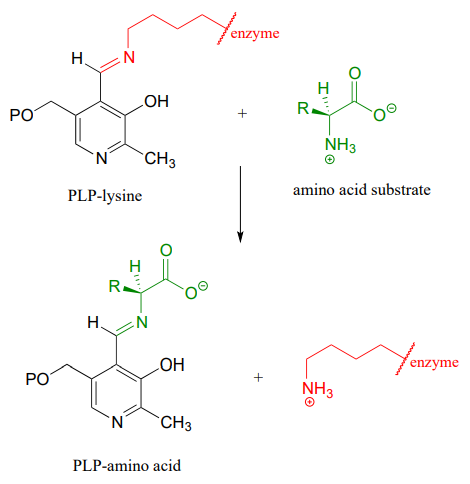
Der Mechanismus für eine Transiminierung ist dem der Iminbildung sehr ähnlich:
Transiminationsreaktion:
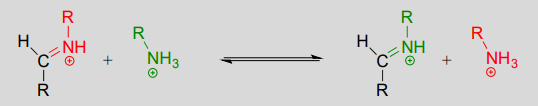
Mechanismus:
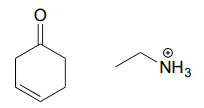
Aufgabe \(\PageIndex{1}\)
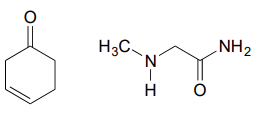
Zeichnen Sie ein Imin, das zwischen jedem Verbindungspaar gebildet werden könnte.
a.
b.
c.
Aufgabe \(\PageIndex{2}\)
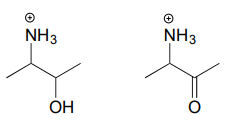
Zeichnen Sie das Imminiumhydrolyseprodukt für jede der folgenden Verbindungen.
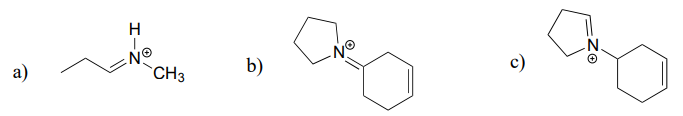
Antwort
Geben Sie hier einen Antworttext ein, der automatisch ausgeblendet wird, wenn Sie eine „AutoNum“-Vorlage auf der Seite aktiv haben.
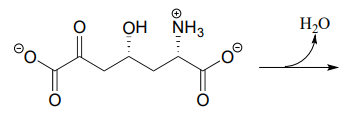
Übung \(\PageIndex{3}\)
- Das unten gezeigte metabolische Zwischenprodukt erfährt eine intramolekulare Iminbildung als Schritt in der Biosynthese von Lysin (EC 4.3.3.7). Zeichnen Sie das Produkt dieses intramolekularen Iminbildungsschrittes.
- Sagen Sie das Produkt dieses Iminbildungsschritts (EC 2.3.1.117) aus dem Prolinabbauweg voraus.
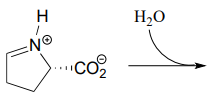
Beiträge
-
Organic Chemistry With a Biological Emphasis von Tim Soderberg (University of Minnesota, Morris)