INTRODUCTION
Humane Papillomviren (HPV) bilden eine heterogene Virusgruppe; ihr Genom besteht aus einem helikoidalen doppelsträngigen DNA-Molekül mit einem Proteinkapsid. Es handelt sich um epitheliotrope Entitäten, die das Epithel im basalen Zustand infizieren und dadurch ihre DNA-Transkription und -Replikation auf basalem Niveau erhalten und hyperplastische papillomatöse und verruköse Läsionen in der Haut und den Schleimhäuten hervorrufen.1
Es gibt über 230 HPV-Typen (118 davon gut charakterisiert) und über 40 anal-genitale Typen, von denen 15 onkogen sind. Beim Menschen gehören sie zu den Virusgruppen, die am häufigsten das Epithel der Haut und der Bindehautschleimhäute, die Mundhöhle (Genotypen 33 und 32), den Kehlkopf, den Bronchialbaum, die Speiseröhre, die Blase, den Anus und den Genitaltrakt infizieren.2,3
Bei den Zungen-HPV gibt es zwei Hauptgruppen der klinischen Präsentation:
a) gutartige Läsionen und b) prämaligne oder maligne Läsionen. Zu den benignen oralen Läsionen gehören orale Papillome, orale Verruca vulgaris (gewöhnliche Warze), orale Acumina condyloma und fokale epitheliale Hyperplasie (Hecks-Krankheit).4-6 Maligne und prämaligne Läsionen sind hauptsächlich durch Leukoplakie und Plattenepithelkarzinom vertreten.7
Das Plattenepithelkarzinom der Mundschleimhaut ist die am häufigsten gefundene papilläre Läsion, sie stellt 2,5 % oder alle im Mund gefundenen Läsionen dar.6 Klinische HPV-Läsionen werden am häufigsten an der Oberlippe, der Unterlippe, dem Zungenbändchen, dem Zungenrücken und den Lippenwinkeln beobachtet.8
Die am häufigsten beobachtete Morphologie dieser Läsionen nimmt eine blumenkohlartige Form an, es können jedoch auch andere Formen wie gewöhnliche Warzen, Hyperkeratosen oder sogar nicht verhornte Oberflächen beobachtet werden, die oberflächliche Farbveränderungen (in der Regel einen violetten Farbton) aufweisen.9 Laut Literaturangaben wird diese Erkrankung meist durch eine oral-genitale Sexualpraxis übertragen.10
Ziel der vorliegenden Studie war es, eine Literaturübersicht über die orale Papillomatose zu erstellen sowie einen klinischen Fall zu berichten.
HISTOLOGIE DER ZUNGE
Die in der Zunge befindlichen Zellen weisen eine polystratifizierte Strukturanordnung auf. Sie sind auf einem (oberflächlichen) Stratum corneum, einer granulären Schicht, einer stacheligen Schicht und einer Basalschicht (tiefste Schicht) angesiedelt. Der Kern dieser Zellen ändert seine Größe je nach Reife und Spezialisierung.11
PAPILLOMA VIRUS GENOME
Virale Partikel bestehen aus einem Proteinkapsid, das zu 95% aus Protein L1 und zu 5% aus Protein L2 zusammengesetzt ist. Diese Proteine verbinden sich zu ikosaedrischen Kapsomeren. Im Inneren des Kapsids befindet sich doppelsträngige, zirkuläre DNA von etwa 8000 Basenpaaren. Es wird von acht Genen und einer nicht kodierten regulatorischen Region gebildet; diese Region enthält Verknüpfungsstellen für hormonelle und Proteinfaktoren des Wirts, die das Virus benötigt, um seinen Replikationszyklus zu vervollständigen.12
Das HPV-Virus wird ebenfalls von zwei Arten von Genen gebildet: Gene, die während der frühen Infektionsstadien kodiert werden, besser bekannt als E-Gene (E für früh) und Gene, die während der späten Replikationsstadien kodiert werden, bekannt als: E1, E2, E4, E5, E6, E7 (wobei E4 als spätes Gen gilt) sowie zwei späte Gene, L1 und L2. Frühe Gene kodieren Proteine, die an der Virusreplikation und -regulation sowie an ihrer kanzerogenen Kapazität beteiligt sind. Auf der anderen Seite kodieren späte Gene Strukturproteine, die ein virales Kapsid bilden.12,13
HPV-Lebenszyklus
HPV dringt durch eine kleine Abschürfung im integralen Epithel der Zunge in den Wirt ein.13 Es beginnt dann seinen produktiven Zyklus, indem es wenig differenzierte Zellen der Basalschichten des Epithels infiziert, wo die Transkription von Genen beginnt.12
Wenn sich die infizierten Zellen differenzieren und von der Basalschicht in die Stachelschicht des Epithels wandern (immunologische Zulässigkeit), wird die virale Replikation stimuliert, wodurch es zu einer Anreicherung der Virionen im Zellkern und zur Montage des Kapsids im Zytoplasma kommt. Es gibt mindestens zwei Zyklen für die virale Replikation: a) lytische Infektion und b) lysogene Infektion.
Bei der lytischen Infektion gelangt das Virus replikationsfähig in die para-basalen Zellen, dringt in das Zytoplasma und später in den Zellkern ein. Einmal im Zellkern angekommen, repliziert es im episomalen Bereich, ohne sich in das zelluläre Genom zu integrieren, und produziert so etwa 20 Viruskopien. Diese vollständigen Viruspartikel verursachen den Zelltod und verbleiben somit frei und in der Nähe von Epitheloberflächen.
In Fällen einer lysogenen Infektion wird das Zellgenom direkt betroffen. Dies ist der Fall bei den Hochrisiko-HPV (16 und 18). Nach Erreichen des Zellkerns integriert sich das Virus in das Genom der Wirtszelle, hauptsächlich in die Segmente E6 und E7. In diesem Fall geht die Virusreplikation in ein Latenzstadium über, bis die Wirtszelle sowohl ihre eigene DNA als auch die DNA der integrierten Viren repliziert. Die viralen DNA-Segmente sind nach der Zellteilung transkriptionell aktiv, was ihre Vermehrung garantiert.
Im Gegensatz zu lytischen Infektionen wird diese Art der Infektion in Zellen mit malignem Wachstum beobachtet.
Die Genexpression der verschiedenen HPV-Typen wird streng und spezifisch durch Transkriptionsfaktoren wie AP-1, keratinozytenspezifischer Faktor, NF-1CTF, CEFI, CEFII und TEFI sowie einige hormonelle Ursprungsfaktoren reguliert.
Bei beiden Infektionstypen initiieren die E1- und E2-Proteine ihre Expression in aufsteigender Richtung (Supraregulation) und aktivieren damit die DNA-Transkription sowie die von den Basalzellen kontrollierte Expression.12
Die HPV-Gene E6 und E7 stehen über die Onkoproteine E6 und E7 in direktem Zusammenhang mit der malignen Transformation von Zellen. Diese Proteine sind in der Lage, Verbindungen mit zellulären Genprodukten zu bilden, die den Zellzyklus regulieren, darunter auch p53 und Rb. Das Onkoprotein E6 bildet eine Verbindung mit dem p53-Protein, während E7 eine Verbindung mit dem Rb-Protein bildet.
Das Rb-Protein reguliert den Übergang von G1 zu S. Das Onkoprotein E7 sequestriert Rb und verhindert, dass es die Zellproliferationsproteine reguliert, was den Zellzyklus dazu zwingt, in der Synthesephase zu verbleiben.13 Diese beiden Ereignisse: die Integration des viralen Gens in das Zellgenom und die Blockierung der normalen Funktion der Tumorsuppressorgene p53 und Rb sind mit der Zelltransformation von Zellen verbunden, die mit Viren mit hohem onkogenem Potenzial infiziert sind (16 und 18). Die fortschreitenden Veränderungen, die Keratozyten erfahren, modifizieren die Mikroumgebung und verändern das Gleichgewicht des Epithels durch zelluläre Proliferationsstimuli, die durch die Sekretion von Alpha- und Beta-Epidermis-Wachstumsfaktoren gesteuert werden.
Die Proteine E2, E3, E4, E5, E6 und E7 induzieren den Verlust der Gen-Protein-Kontrolle (episomale DNA im Kernzentrum), während E6 und E7 die virale DNA replizieren. L1 und L2 bauen das Virus zusammen und lagern sich in reifen Plattenepithelzellen ein, um sie später abzustoßen (über 1.000 Kopien pro Zelle).
Bei gutartigen Läsionen, wie z. B. Zungenpapillomen, fördert die Proliferation der episomalen DNA-Partikel ein abnormales Epithelwachstum und damit die Vermehrung von Genfehlern der Zellen (Gastogenese).
E6 und E7 fördern die Virusvermehrung und Immortalisierung. Wenn das Virus onkogenes Potenzial besitzt, führt es zur Malignisierung, wenn nicht, entsteht eine gutartige Läsion, die sich innerhalb von zwei Jahren selbst zurückbilden kann. Dieser Mechanismus wird hauptsächlich durch den Verlust der DNA-Telomere induziert, was die Apoptose hemmt, die Anzahl der infizierten Zellen erhöht und die Acetylierung und Phosphorylierung von p53 und Rb verringert. Außerdem wird die Expression von angiogenen Faktoren gefördert. Das ist der Fall des vaskulären Wachstumsfaktors, der das Zellzytoskelett und die extrazelluläre Matrix desorganisiert und die Regulationsfaktoren beeinflusst, die an der Gesundheit dieser Strukturen beteiligt sind.12
HPV-Infektion verursacht wichtige Veränderungen in der Zellmorphologie. So werden z.B. peri-nukleäre Vakuolenbildung, vergrößerte, unregelmäßige und hyperchromatische Zellkerne sowie Zweikernbildung beobachtet. Zellen, die diese Veränderungen aufweisen, werden als Koylozyten bezeichnet und gelten als „Fingerabdruck“ des Virus.
Das Kondylom ist die häufigste morphologische Manifestation einer HPV-Infektion (Condyloma acuminatum).14
FALLPRÄSENTATION
Die Patientin war eine 21 Jahre alte alleinstehende Frau. Sie arbeitete nicht außer Haus, war geboren und wohnte im Estado de Mexico (Bundesstaat Mexiko). Ihre Blutgruppe war O, Rh positiv. Als Teil ihrer Familienanamnese gab sie an, dass ihr Vater an Multipler Sklerose und eine Schwester an rheumatoider Arthritis erkrankt war. Die Patientin leugnete jegliche Drogenabhängigkeit. Sie war an multiplen juvenilen Brustfibroadenomen in der linken Brust erkrankt, die operativ behandelt wurden. Die Menarche setzte mit 15 Jahren ein, der Menstruationsrhythmus war 28 × 3. Die sexuelle Aktivität begann mit 17 Jahren. Sie berichtete von einem sexuell aktiven Partner, verweigerte die Ausübung von oral-genitalem Sex. Sie erlebte eine Schwangerschaft und wurde mit einem 3,1 kg schweren lebenden Kind entbunden.
Ein Jahr zuvor war sie zusätzlich zur Brustuntersuchung einer Zytologie und Kolposkopie im unteren Genitaltrakt unterzogen worden. Die Ergebnisse waren negativ für Krebs und HPV. Die von der Patientin verwendete Familienplanungsmethode war ein Intrauterinpessar.
Die Patientin suchte im April 2014 zum ersten Mal die Sprechstunde auf und klagte über ventrale Glossodynie mit einer dreimonatigen Entwicklung. Danach verspürte sie ein Fremdkörpergefühl und eine Vorwölbung im Weichgewebe, mit fortschreitendem Schleuderwachstum bis zur Bildung eines linsenförmigen Tumors, der bei Kontakt mit dem harten Gaumen und beim Kauen blutete. Sie suchte eine Arztpraxis auf, wo sie eine nicht näher spezifizierte systemische Behandlung erhielt, die keine zufriedenstellenden Ergebnisse brachte.
Der Mund wurde durch eine Kolposkopie mit 0,66-facher Vergrößerung (Hinselmann Kolposkop, 2014 Mexiko) inspiziert. Dabei zeigte sich eine Läsion von ca. 1 cm Durchmesser, rosafarben, kreisförmig, mit gezackten Rändern, ohne Stiel und von avaskulärer Natur (Abbildung 1). Nach Abschluss der Untersuchung wurde die Patientin über die Diagnose und die wünschenswerte Behandlung informiert.
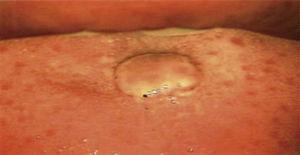
Direkte Inspektion des Mundes unter kolposkopischer Perspektive. I (Hinselmann, 2014), mit 0,66-facher Vergrößerung. Läsion mit einem Durchmesser von 1 cm, von rosafarbener Tönung, kreisförmig, mit gezackten Rändern, avaskulär und ohne Stiel.
TREATMENT
Unter Lokalanästhesie und 2% Xylocain mit Epinephrin (1mL) wurde die Basis der Läsion mit einer Nadel des Kalibers 30G infiltriert. Die Läsionsoberfläche wurde abgeschnitten und mit einer keilförmigen scharfen Dissektion seziert. Nach Erreichen der Hämostase wurden die Ränder in einer Ebene mit umgekehrten Nähten verblendet (Dermalon 000). Das gewonnene Präparat wurde in 5 ml 10%igem Formalin fixiert, um dann in die Pathologie geschickt zu werden.
Fünfzehn Tage später wurden die Nähte entfernt und so ein gesundes Operationsgebiet erhalten (Abbildung 2). Der histopathologische Bericht zeigte das Vorhandensein von Gewebe mit den Maßen 0,6 × 0,5 cm. Das Präparat hatte eine unregelmäßige Form, eine dunkelbraune Färbung und eine weiche Konsistenz. Die mikroskopische Analyse zeigte poly-stratifiziertes, korneales Epithel, Akanthose und Hyperkeratose. Das Innere der Probe zeigte intra-epitheliale Verhornungsherde unterschiedlicher Größe. Im Allgemeinen waren die Epithelzellen kleiner als die des normalen Stratum spinosum (Abbildungen 3 und 4). Die endgültige Diagnose ergab ein Plattenepithelpapillom der Zunge. Die mit der Polymerase-Kettenreaktion (PCR) in Echtzeit durchgeführte virale Gentypisierung ergab das Vorhandensein eines 58er Genotyps (Hochrisiko-Virus).
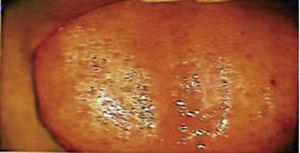
Fotografie der Zunge unter kolposkopischer Perspektive 15 Tage nach der Operation.
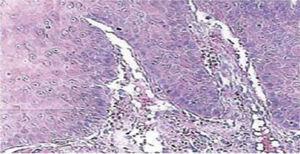
10fache mikroskopische Vergrößerung. Poly-stratifiziertes Hornhautepithel, Akanthose und Hyperkeratose.
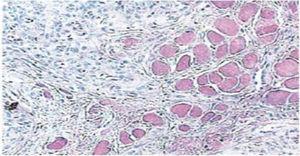
40 x Mikroskopische Vergrößerung. Intraepitheliale Verhornungsherde unterschiedlicher Größe.
DISKUSSION
HPV ist ein DNA-Virus; es gehört zur Familie der Papovaviridae, dem Geschlecht der Papillomaviren. Es sind über 230 Genotypen beschrieben worden. Die Inkubationszeit variiert von drei Wochen bis zu acht Monaten, mit einem Durchschnitt von drei Monaten. Von den 230 Papillomavirus-Genotypen sind 16 am häufigsten mit oralen Läsionen assoziiert (1, 2, 3, 4, 6, 7, 10, 11, 13, 16, 31, 32, 33, 35 und 57).
Es gibt zwei Hauptgruppen der klinischen Präsentation von HPV: a) benigne Läsionen und b) prämaligne oder maligne Läsionen. Zu den benignen oralen Läsionen gehören das orale Papillom, die Verruca vulgaris (gewöhnliche Warze), das Condiloma acuminatum oralis und die fokale epitheliale Hyperplasie (Morbus Heck). Prämaligne und maligne Läsionen werden hauptsächlich durch Leukoplakie und Plattenepithelkarzinom in Verbindung mit den Genotypen 16 und 18 repräsentiert. Die HPV-Übertragung erfolgt durch oral-genitale Sexualpraktiken.
Es gibt mehrere Techniken zur HPV-Diagnose, darunter die konventionelle Zytologie, die Flüssigbasenzytologie, die Histologie, die Kolposkopie und molekularbiologische Techniken wie die In-situ-Hybridisierung und die Polymerase-Kettenreaktion (PCR).15,16 In dem hier vorgestellten klinischen Fall wurde entschieden, eine Virusgen-Typisierung mit PCR vorzunehmen, dieses Verfahren ergab das Vorhandensein eines 58er Genotyps. Dieses Datum wurde in der in der Literatur berichteten Klassifizierung nicht dokumentiert.
Die Behandlung ist auf den jeweiligen Einzelfall zugeschnitten. Es können destruktive Techniken eingesetzt werden, wie z. B. Kryotherapie oder Elektrochirurgie, die Verwendung von Immunmodulatoren (Imiquimod zu 5 %) oder die Verwendung eines Antimetaboliten zur Beeinflussung von RNA (Ribo-Nukleinsäure) und DNA oder durch Thymidylat-Synthetase-Hemmung (5-Fluoracil).17,18 Im vorliegenden Fall wurde entschieden, eine Operation mit einem kalten Skalpell basierend auf der Stelle des Auftretens der Läsion zu verwenden, um die Möglichkeit zu nutzen, keine Folgeerkrankungen zu hinterlassen.
CONCLUSION
In der Mundschleimhaut, die einem Mikrotrauma ausgesetzt ist, können Mikroorganismen sowie chemische und physikalische Faktoren synergetisch mit HPV wirken, um die Entwicklung von gutartigen Läsionen oder Karzinomen zu begünstigen.
HPV spielt eine wichtige Rolle bei der Entwicklung von Plattenepithelkarzinomen im Anal- und Genitaltrakt sowie bei der verruziformen Epidermodysplasie und im Kehlkopf.
Bei gutartigen Läsionen sind die Genotypen 33 und 32 am häufigsten. In unserer Studie zeigte der Bericht des molekularbiologischen Verfahrens jedoch das Vorhandensein des Genotyps 58 an.
In der weltweiten Literatur wurde über den Genotyp 58 bei dieser Art von Läsionen, die klinisch gutartig zu sein scheinen, nicht berichtet.
Um diese Erkrankung erfolgreich anzugehen, ist eine interdisziplinäre Diagnose und Behandlung unter Zahnärzten, Onkologen und Gynäkologen, die in der Untersuchung dieser Läsionen unter kolposkopischer Perspektive entsprechend geschult sind, von größter Bedeutung.
Die Behandlung durch einen chirurgischen Eingriff mit einem kalten Skalpell, der darauf abzielt, läsionsfreie Ränder zu hinterlassen, ist eine adäquate Lösung, um diese Art von Läsionen zu beseitigen und keine Folgeerscheinungen zu verursachen, insbesondere bei Tumoren, die klinisch gutartig zu sein scheinen, die aber aufgrund ihres Gentyps mittel- und langfristig ein bösartiges Verhalten zeigen werden.
Wir halten den vorliegenden Fallbericht für interessant, da es in der mexikanischen wissenschaftlichen Bibliographie nur wenige Berichte zu dieser Erkrankung gibt.