Wasserstoffbrücken können sich zwischen dem einsamen Paar am sehr elektronegativen Stickstoffatom und dem leicht positiven Wasserstoffatom in einem anderen Molekül bilden.
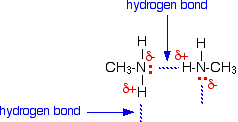
Die Wasserstoffbrückenbindungen sind nicht so effizient wie z.B. in Wasser, weil es einen Mangel an einsamen Paaren gibt. Einige leicht positive Wasserstoffatome können kein freies Paar finden, mit dem sie eine Wasserstoffbrücke eingehen können. Es gibt doppelt so viele geeignete Wasserstoffatome wie einsame Paare.
Die Siedepunkte der primären Amine steigen mit zunehmender Kettenlänge, weil die van-der-Waals-Dispersionskräfte zwischen den größeren Molekülen größer werden.
Sekundäre Amine
Für einen fairen Vergleich müsste man den Siedepunkt von Dimethylamin mit dem von Ethylamin vergleichen. Sie sind Isomere voneinander – jedes enthält genau die gleiche Anzahl der gleichen Atome.
Der Siedepunkt des sekundären Amins ist etwas niedriger als der des entsprechenden primären Amins mit der gleichen Anzahl von Kohlenstoffatomen.
Sekundäre Amine bilden immer noch Wasserstoffbrückenbindungen, aber dadurch, dass sich das Stickstoffatom in der Mitte der Kette befindet und nicht am Ende, ist der permanente Dipol am Molekül etwas geringer.
Der niedrigere Siedepunkt ist auf die geringeren Dipol-Dipol-Attraktionen im Dimethylamin im Vergleich zum Ethylamin zurückzuführen.
Tertiäre Amine
Um einen fairen Vergleich anzustellen, müsste man diesmal Trimethylamin mit seinem Isomer 1-Aminopropan vergleichen.
Wenn Sie sich die Tabelle weiter oben auf der Seite ansehen, werden Sie sehen, dass das Trimethylamin einen viel niedrigeren Siedepunkt (3,5 °C) hat als 1-Aminopropan (48,6 °C).
In einem tertiären Amin gibt es keine Wasserstoffatome, die direkt an den Stickstoff gebunden sind. Das bedeutet, dass eine Wasserstoffbrückenbindung zwischen tertiären Aminmolekülen nicht möglich ist. Deshalb ist der Siedepunkt viel niedriger.
Löslichkeit in Wasser
Die kleinen Amine aller Typen sind sehr gut in Wasser löslich. Tatsächlich werden diejenigen, die bei Raumtemperatur normalerweise als Gase vorliegen, normalerweise als Lösungen in Wasser verkauft – ähnlich wie Ammoniak normalerweise als Ammoniaklösung angeboten wird.
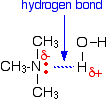
Alle Amine können mit Wasser Wasserstoffbrückenbindungen bilden – auch die tertiären.
Obwohl die tertiären Amine kein Wasserstoffatom an den Stickstoff gebunden haben und daher keine Wasserstoffbrückenbindungen mit sich selbst bilden können, können sie Wasserstoffbrückenbindungen mit Wassermolekülen bilden, indem sie einfach das einsame Paar am Stickstoff benutzen.
Die Löslichkeit nimmt ab, wenn die Kohlenwasserstoffketten länger werden – merklich nach etwa 6 Kohlenstoffen. Die Kohlenwasserstoffketten müssen sich ihren Weg zwischen die Wassermoleküle bahnen und brechen dabei die Wasserstoffbrückenbindungen zwischen den Wassermolekülen auf.
Sie ersetzen diese jedoch nicht durch etwas ebenso Starkes, und so wird der Prozess der Lösungsbildung mit zunehmender Kettenlänge energetisch immer weniger machbar.
Geruch
Die sehr kleinen Amine wie Methylamin und Ethylamin riechen sehr ähnlich wie Ammoniak – obwohl, wenn man sie nebeneinander vergleicht, die Amin-Gerüche etwas komplexer sind.
Wenn die Amine größer werden, neigen sie dazu, „fischiger“ zu riechen, oder sie riechen nach Verwesung.
Wenn Sie mit dem Geruch von Weißdornblüten (und ähnlich riechenden Dingen wie Cotoneaster-Blüten) vertraut sind, ist dies der Geruch von Trimethylamin – ein süßer und eher kränklicher Geruch wie die frühen Stadien von verwesendem Fleisch.
Fragen, um Ihr Verständnis zu testen
Wenn dies der erste Satz von Fragen ist, den Sie bearbeiten, lesen Sie bitte die Einführungsseite, bevor Sie beginnen. Sie müssen die BACK BUTTON Ihres Browsers benutzen, um danach hierher zurückzukommen.
Fragen zur Einführung in die Amine
Antworten
Wo möchten Sie jetzt hin?
Zum Menü der Amine . .
Zum Menü der anderen organischen Verbindungen…
Zum Hauptmenü . .