Lernziele
- Lernen Sie die grundlegenden Begriffe, die zur Beschreibung von Materie verwendet werden.
Die Definition der Chemie – die Untersuchung der Wechselwirkungen von Materie mit anderer Materie und mit Energie – verwendet einige Begriffe, die ebenfalls definiert werden sollten. Wir beginnen das Studium der Chemie, indem wir einige grundlegende Begriffe definieren.
Materie. Ein Buch ist Materie, ein Computer ist Materie, Nahrung ist Materie, und Schmutz im Boden ist Materie. Manchmal kann Materie schwer zu identifizieren sein. Zum Beispiel ist Luft Materie, aber weil sie im Vergleich zu anderer Materie (z.B. einem Buch, einem Computer, Nahrung und Schmutz) so dünn ist, vergessen wir manchmal, dass Luft Masse hat und Raum einnimmt. Zu den Dingen, die keine Materie sind, gehören Gedanken, Ideen, Gefühle und Hoffnungen.
Beispiel 1
Welche der folgenden Dinge sind Materie und welche nicht?
- ein Hotdog
- Liebe
- ein Baum
Lösung
- Ein Hotdog hat Masse und nimmt Raum ein, also ist er Materie.
- Liebe ist ein Gefühl, und Gefühle sind keine Materie.
- Ein Baum hat Masse und nimmt Raum ein, also ist er Materie.
Test Yourself
Welches der folgenden Dinge ist Materie und nicht Materie?
- der Mond
- eine Idee für eine neue Erfindung
Antwort
- Der Mond ist Materie.
- Die Erfindung selbst mag Materie sein, aber die Idee dafür ist es nicht.
Abbildung 1.1 Die Phasen der Materie

„Ice cubes“ von Darren Hester ist lizenziert unter der Creative Commons Attribution-Share Alike 2.5 Generic; „Glass of Water“ von Greg Riegler ist lizenziert unter der Creative Commons Attribution 2.0 Generic; „Tea Time“ von Vélocia ist lizenziert unter der Creative Commons Attribution-NonCommercial- NoDerivs 2.0 Generic.
Um Materie zu verstehen und wie sie sich verändert, müssen wir in der Lage sein, Materie zu beschreiben. Es gibt zwei grundlegende Möglichkeiten, Materie zu beschreiben: physikalische Eigenschaften und chemische Eigenschaften. Physikalische Eigenschaften sind Merkmale, die die Materie beschreiben, wie sie existiert. Einige der vielen physikalischen Eigenschaften von Materie sind Form, Farbe, Größe und Temperatur. Eine wichtige physikalische Eigenschaft ist die Phase (oder der Zustand) der Materie. Die drei grundlegenden Phasen der Materie sind fest, flüssig und gasförmig (siehe Abbildung 1.1 „Die Phasen der Materie“).
Abbildung 1.2 Chemische Eigenschaften
Dass dieses Streichholz brennt, ist eine chemische Eigenschaft des Streichholzes.

„lit a match“ (http://commons.wikimedia.org/wiki/File:Match_stick,_lit_a_match,_match_box,_fire.JPG) von Jith JR ist lizenziert unter der Creative Commons Attribution-Share Alike 3.0 Unported.
Chemische Eigenschaften sind Merkmale von Materie, die beschreiben, wie sich Materie in Gegenwart anderer Materie verändert. Brennt eine Probe der Materie? Das Brennen ist eine chemische Eigenschaft. Verhält sie sich heftig, wenn sie in Wasser gelegt wird? Diese Reaktion ist ebenfalls eine chemische Eigenschaft (Abbildung 1.2 „Chemische Eigenschaften“). In den folgenden Kapiteln werden wir sehen, wie Beschreibungen von physikalischen und chemischen Eigenschaften wichtige Aspekte der Chemie sind.
Abbildung 1.3 Physikalische Veränderungen
Das feste Eis schmilzt zu flüssigem Wasser – eine physikalische Veränderung.

„Schmelzende Eiswürfel“ (https://www.flickr.com/photos/jariceiii/5012344135/) von Jar ist lizenziert unter Creative Commons Attribution 2.0 Generic.
Wenn Materie immer gleich bliebe, wäre Chemie ziemlich langweilig. Glücklicherweise besteht ein großer Teil der Chemie aus Veränderung. Eine physikalische Veränderung tritt auf, wenn eine Probe der Materie eine oder mehrere ihrer physikalischen Eigenschaften ändert. Zum Beispiel kann ein Feststoff schmelzen (Abbildung 1.3 „Physikalische Veränderungen“), oder Alkohol in einem Thermometer kann sein Volumen ändern, wenn sich die Temperatur ändert. Eine physikalische Veränderung wirkt sich nicht auf die chemische Zusammensetzung der Materie aus.
Eine chemische Veränderung ist der Vorgang, der eine chemische Eigenschaft zeigt, wie z. B. das brennende Streichholz in Abbildung 1.2 „Chemische Eigenschaften“. Wenn die Materie im Streichholz verbrennt, ändert sich ihre chemische Zusammensetzung, und es entstehen neue Formen von Materie mit neuen physikalischen Eigenschaften. Beachten Sie, dass chemische Veränderungen häufig von physikalischen Veränderungen begleitet werden, da die neue Materie wahrscheinlich andere physikalische Eigenschaften hat als die ursprüngliche Materie.
Beispiel 2
Beschreiben Sie jeden Prozess als physikalische Veränderung oder als chemische Veränderung.
- Wasser in der Luft wird zu Schnee.
- Die Haare eines Menschen werden geschnitten.
- Brotteig wird im Ofen zu frischem Brot.
Lösung
- Da das Wasser von der Gasphase in die feste Phase übergeht, ist dies eine physikalische Veränderung.
- Die langen Haare werden gekürzt. Das ist eine physikalische Veränderung.
- Durch die Temperatur des Backofens kommt es zu chemischen Veränderungen im Brotteig, um frisches Brot herzustellen. Dies sind chemische Veränderungen. (Tatsächlich ist ein Großteil des Kochens mit chemischen Veränderungen verbunden.)
Test yourself
Identifiziere jeden Prozess als physikalische Veränderung oder als chemische Veränderung.
- In einem Kamin wütet ein Feuer.
- Wasser wird erwärmt, um eine Tasse Kaffee zu kochen.
Antworten
- chemische Veränderung
- physikalische Veränderung
Eine Probe von Materie, die überall die gleichen physikalischen und chemischen Eigenschaften hat, nennt man einen Stoff. Manchmal wird der Ausdruck Reinsubstanz verwendet, aber das Wort rein wird nicht benötigt. Die Definition des Begriffs Substanz ist ein Beispiel dafür, dass die Chemie eine spezifische Definition für ein Wort hat, das in der Alltagssprache mit einer anderen, vageren Definition verwendet wird. Hier werden wir den Begriff Substanz mit seiner strengen chemischen Definition verwenden.
Die Chemie kennt zwei verschiedene Arten von Substanzen: Elemente und Verbindungen. Ein Element ist die einfachste Art von chemischer Substanz; es kann mit gewöhnlichen chemischen Mitteln nicht in einfachere chemische Substanzen zerlegt werden. Es gibt etwa 115 Elemente, die der Wissenschaft bekannt sind, von denen 80 stabil sind. (Die anderen Elemente sind radioaktiv, ein Zustand, den wir in Kapitel 15 „Kernchemie“ betrachten werden.) Jedes Element hat seine eigene einzigartige Reihe von physikalischen und chemischen Eigenschaften. Beispiele für Elemente sind Eisen, Kohlenstoff und Gold.
Eine Verbindung ist eine Kombination aus mehr als einem Element. Die physikalischen und chemischen Eigenschaften einer Verbindung unterscheiden sich von den physikalischen und chemischen Eigenschaften der einzelnen Elemente, d.h. sie verhält sich wie ein völlig anderer Stoff. Es sind über 50 Millionen Verbindungen bekannt, und täglich werden weitere entdeckt. Beispiele für Verbindungen sind Wasser, Penicillin und Natriumchlorid (der chemische Name für Kochsalz).
Elemente und Verbindungen sind nicht die einzigen Arten, in denen Materie vorhanden sein kann. Wir begegnen häufig Objekten, die physikalische Kombinationen aus mehr als einem Element oder einer Verbindung sind. Physikalische Kombinationen von mehr als einem Stoff werden als Gemische bezeichnet. Es gibt zwei Arten von Gemischen. Ein heterogenes Gemisch ist ein Gemisch, das aus zwei oder mehr Stoffen besteht. Es ist leicht zu erkennen, manchmal schon mit bloßem Auge, dass mehr als ein Stoff vorhanden ist. Ein homogenes Gemisch ist eine Kombination von zwei oder mehr Stoffen, die so innig vermischt ist, dass sich das Gemisch wie ein einziger Stoff verhält. Ein anderes Wort für ein homogenes Gemisch ist Lösung. So ist eine Kombination aus Salz und Stahlwolle ein heterogenes Gemisch, weil man leicht erkennen kann, welche Teilchen des Stoffes Salzkristalle und welche Stahlwolle sind. Nimmt man dagegen Salzkristalle und löst sie in Wasser auf, ist es sehr schwierig, durch bloßes Hinsehen zu erkennen, dass mehr als ein Stoff vorhanden ist – selbst wenn man ein starkes Mikroskop benutzt. Das in Wasser gelöste Salz ist ein homogenes Gemisch oder eine Lösung (Abbildung 1.4 „Arten von Gemischen“).
Abbildung 1.4 Arten von Gemischen

Beispiel 3
Bestimmen Sie die folgenden Kombinationen als heterogene Gemische oder homogene Gemische.
- Soda-Wasser (Kohlendioxid ist in Wasser gelöst.)
- Eine Mischung aus Eisenmetallspänen und Schwefelpulver (Sowohl Eisen als auch Schwefel sind Elemente.)
Lösung
- Da Kohlendioxid in Wasser gelöst ist, kann man aus dem Verhalten von in Wasser gelösten Salzkristallen ableiten, dass Kohlendioxid in Wasser gelöst (auch) ein homogenes Gemisch ist.
- Angenommen, das Eisen und der Schwefel werden einfach miteinander vermischt, dann sollte leicht zu erkennen sein, was Eisen und was Schwefel ist, also handelt es sich um ein heterogenes Gemisch.
Testen Sie sich selbst
Sind die folgenden Kombinationen homogene Gemische oder heterogene Gemische?
- der menschliche Körper
- ein Amalgam, eine Kombination aus einigen anderen Metallen, die in einer kleinen Menge Quecksilber gelöst sind
Antworten
- heterogenes Gemisch
- homogenes Gemisch
Es gibt noch andere Deskriptoren, mit denen wir Materie beschreiben können, insbesondere Elemente. Wir können Elemente normalerweise in Metalle und Nichtmetalle einteilen, und jede Gruppe teilt bestimmte (aber nicht immer alle) Eigenschaften. Ein Metall ist ein Element, das bei Raumtemperatur fest ist (obwohl Quecksilber eine bekannte Ausnahme ist), glänzend und silbrig ist, Elektrizität und Wärme gut leitet, in dünne Platten geschlagen werden kann (eine Eigenschaft, die man Verformbarkeit nennt) und in dünne Drähte gezogen werden kann (eine Eigenschaft, die man Duktilität nennt). Ein Nichtmetall ist ein Element, das spröde ist, wenn es fest ist, Elektrizität oder Wärme nicht sehr gut leitet und nicht zu dünnen Blechen oder Drähten verarbeitet werden kann (Abbildung 1.5 „Halbmetalle“). Auch Nichtmetalle kommen bei Raumtemperatur in einer Vielzahl von Phasen und Farben vor. Einige Elemente haben sowohl Eigenschaften von Metallen als auch von Nichtmetallen und werden als Halbmetalle (oder Metalloide) bezeichnet. Wir werden später sehen, wie diese Bezeichnungen recht einfach verschiedenen Elementen zugeordnet werden können.
Abbildung 1.5 Halbmetalle

„Pouring liquid mercury bionerd“ ist lizenziert unter der Creative CommonsAttribution 3.0 Unported; „Sulphur-vulcano“ von Heidi Soosalu ist lizenziert unter der Creative Commons Attribution-Share Alike 3.0 Unported.
Abbildung 1.6 „Beschreiben von Materie“ ist ein Flussdiagramm der Beziehungen zwischen den verschiedenen Arten der Beschreibung von Materie.
Abbildung 1.6 Beschreiben von Materie
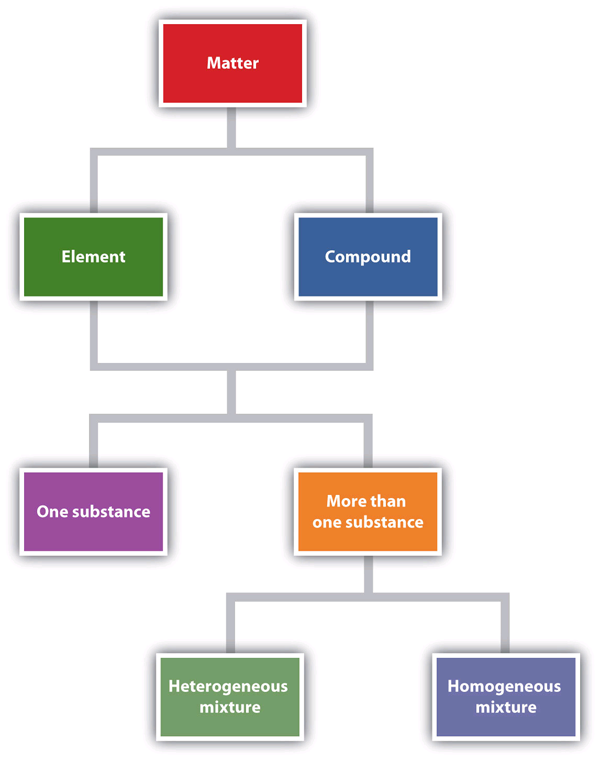
Dieses Flussdiagramm zeigt, wie Materie beschrieben werden kann.
Chemie ist überall: Am Morgen
Die meisten Menschen haben ein Morgenritual, einen Prozess, den sie jeden Morgen durchlaufen, um sich auf den Tag vorzubereiten. Chemie kommt bei vielen dieser Aktivitäten vor.
- Wenn Sie morgens duschen oder baden, verwenden Sie wahrscheinlich Seife, Shampoo oder beides. Diese Produkte enthalten Chemikalien, die mit dem Öl und Schmutz auf Ihrem Körper und Ihren Haaren interagieren, um sie zu entfernen und wegzuwaschen. Viele dieser Produkte enthalten auch Chemikalien, die dafür sorgen, dass Sie gut riechen; sie werden Duftstoffe genannt.
- Wenn Sie morgens Ihre Zähne putzen, verwenden Sie normalerweise Zahnpasta, eine Form von Seife, um Ihre Zähne zu reinigen. Zahnpasten enthalten typischerweise winzige, harte Partikel, die Schleifmittel genannt werden und Ihre Zähne physisch schrubben. Viele Zahnpasten enthalten auch Fluorid, eine Substanz, die chemisch mit der Oberfläche der Zähne interagiert, um Karies zu verhindern.
- Vielleicht nehmen Sie jeden Morgen Vitamine, Nahrungsergänzungsmittel oder Medikamente ein. Vitamine und andere Ergänzungsmittel enthalten Chemikalien, die Ihr Körper in kleinen Mengen braucht, um richtig zu funktionieren. Medikamente sind Chemikalien, die helfen, Krankheiten zu bekämpfen und die Gesundheit zu fördern.
- Vielleicht machen Sie sich zum Frühstück ein paar Spiegeleier. Beim Braten von Eiern werden diese so stark erhitzt, dass eine chemische Reaktion stattfindet, um die Eier zu kochen.
- Nach dem Essen wird die Nahrung in Ihrem Magen chemisch umgesetzt, damit der Körper (vor allem der Darm) Nahrung, Wasser und andere Nährstoffe aufnehmen kann.
- Wenn Sie mit dem Auto oder dem Bus zur Schule oder zur Arbeit fahren, benutzen Sie ein Fahrzeug, das wahrscheinlich Benzin verbrennt, ein Material, das ziemlich leicht brennt und Energie für den Antrieb des Fahrzeugs liefert. Erinnern Sie sich daran, dass die Verbrennung eine chemische Veränderung ist.
Das sind nur ein paar Beispiele dafür, wie die Chemie Ihr tägliches Leben beeinflusst. Und wir haben es noch nicht einmal bis zum Mittagessen geschafft!
Abbildung 1.7 Chemie im wirklichen Leben

„Soaps and Shampoos“ von Takashi Ota ist lizenziert unter Creative Commons Attribution 2.0 Generic; „English Breakfast“ ist lizenziert unter der Creative Commons Attribution-Share Alike 3.0 Unported; „Langley, Trans-Canada Highway“ von James ist lizenziert unter der Creative Commons Attribution- Share Alike 3.0 Unported.

Videoquelle: The chemical world by keyj (https://viuvideos.viu.ca/media/The+Chemical+World/0_ixlxmwe8)
Key Takeaways
- Chemie ist die Lehre von der Materie und ihren Wechselwirkungen mit anderer Materie und Energie.
- Materie ist alles, was Masse hat und Raum einnimmt.
- Materie kann in Form von physikalischen und chemischen Eigenschaften beschrieben werden.
- Physikalische Eigenschaften und chemische Eigenschaften von Materie können sich ändern.
- Materie setzt sich aus Elementen und Verbindungen zusammen.
- Kombinationen aus verschiedenen Stoffen nennt man Gemische.
- Elemente können als Metalle, Nichtmetalle und Halbmetalle bezeichnet werden.
Übungen
- Identifizieren Sie jeweils als Stoff oder Nichtstoff.
a) ein Buch
b) Hass
c) Licht
d) ein Auto
e) ein Spiegelei
2. Gib ein Beispiel für Materie in jeder Phase: fest, flüssig oder gasförmig.
3. Stellt jede Aussage eine physikalische Eigenschaft oder eine chemische Eigenschaft dar?
a) Schwefel ist gelb.
b) Stahlwolle brennt, wenn sie von einer Flamme entzündet wird.
c) Ein Liter Milch wiegt über acht Pfund.
4. Stellt jede Aussage eine physikalische Eigenschaft oder eine chemische Eigenschaft dar?
a) Ein Laubhaufen verrottet langsam im Garten.
b) In Gegenwart von Sauerstoff kann Wasserstoff zu Wasser reagieren.
c) Gold kann in sehr dünne Drähte gestreckt werden.
5. Stellt jede Aussage eine physikalische oder eine chemische Veränderung dar?
a) Wasser kocht und wird zu Wasserdampf.
b) Nahrung wird durch das Verdauungssystem in eine verwertbare Form umgewandelt.
c) Der Alkohol in vielen Thermometern gefriert bei etwa -40 Grad Fahrenheit.
6. Stellt jede Aussage eine physikalische oder eine chemische Veränderung dar?
a) Graphit, eine Form von elementarem Kohlenstoff, kann bei sehr hohen Temperaturen und Drücken in Diamant, eine andere Form von Kohlenstoff, umgewandelt werden.
b) Das Haus auf der anderen Straßenseite hat einen neuen Anstrich bekommen.
c) Die Elemente Natrium und Chlor bilden zusammen eine neue Substanz namens Natriumchlorid.
7. Unterscheide zwischen einem Element und einer Verbindung. Wie viele von beiden sind bekannt?
8. Was ist der Unterschied zwischen einem homogenen Gemisch und einem heterogenen Gemisch?
9. Identifiziere jeweils ein heterogenes Gemisch oder ein homogenes Gemisch.
a) Salz wird mit Pfeffer gemischt.
b) Zucker wird in Wasser aufgelöst.
c) Nudeln werden in kochendem Wasser gekocht.
10. Kennzeichnen Sie jeweils ein heterogenes Gemisch oder ein homogenes Gemisch.
a) Luft
b) Schmutz
c) ein Fernsehgerät
11. Welche der Möglichkeiten in Aufgabe 9 sind auch Lösungen?
12. Welche Möglichkeiten in Übung 10 sind auch Lösungen?
13. Warum zählt Eisen zu den Metallen?
14. Warum zählt Sauerstoff zu den Nichtmetallen?
15. Unterscheide zwischen einem Metall und einem Nichtmetall.
16. Welche Eigenschaften haben die Halbmetalle?
17. Elementarer Kohlenstoff ist ein schwarzer, stumpf aussehender Feststoff, der Wärme und Elektrizität gut leitet. Er ist sehr spröde und kann nicht zu dünnen Platten oder langen Drähten verarbeitet werden. Wie verhält sich Kohlenstoff bei diesen Eigenschaften als Metall? Wie verhält sich Kohlenstoff als Nichtmetall?
18. Reines Silizium ist glänzend und silbrig, leitet aber Elektrizität und Wärme nicht gut. Wie verhält sich Silizium bei diesen Eigenschaften als Metall? Wie verhält sich Silizium als Nichtmetall?
Antworten
a) Materie
b) Nicht-Metall
c) Nicht-Metall
a) physikalische Eigenschaft
b) chemische Eigenschaft
c) physikalische Eigenschaft
a) physikalische Veränderung
b) chemische Veränderung
c) physikalische Veränderung
7. Ein Element ist ein grundlegender chemischer Teil eines Stoffes; es gibt etwa 115 bekannte Elemente. Eine Verbindung ist eine Kombination von Elementen, die als eine andere Substanz wirkt; es gibt über 50 Millionen bekannte Substanzen.
a) heterogen
b) homogen
c) heterogen
11. Auswahl b ist eine Lösung.
13. Eisen ist ein Metall, weil es fest ist, glänzt und Elektrizität und Wärme gut leitet.
15. Metalle sind typischerweise glänzend, leiten Elektrizität und Wärme gut und sind formbar und dehnbar; Nichtmetalle haben eine Vielzahl von Farben und Phasen, sind in der festen Phase spröde und leiten Wärme oder Elektrizität nicht gut.
17. Kohlenstoff verhält sich wie ein Metall, weil er Wärme und Elektrizität gut leitet. Er ist ein Nichtmetall, weil er schwarz und spröde ist und nicht zu Blechen oder Drähten verarbeitet werden kann.