Fallbericht
Management von proliferativem Endometrium bei Biopsie bei postmenopausalen Frauen
Sidharth Srinivas1, Sachchidananda Maiti2, Perunkulam Jothilakshmi2
1Manchester Medical School, University of Manchester, Manchester, United Kingdom
2Obstetrics &Gynaecology, The Pennine Acute NHS Hospitals, Crumpsall, United Kingdom
Email-Adresse:
 (S. Srinivas)
(S. Srinivas) Diesen Artikel zitieren:
Sidharth Srinivas, Sachchidananda Maiti, Perunkulam Jothilakshmi. Management von proliferativem Endometrium bei Biopsie bei postmenopausalen Frauen. Zeitschrift für Gynäkologie und Geburtshilfe. Vol. 4, No. 6, 2016, pp. 38-43. doi: 10.11648/j.jgo.20160406.12
Received: September 4, 2016; Accepted: September 21, 2016; Published: October 15, 2016
Abstract: Postmenopausale Blutungen (PMB) werden in der Regel durch verschiedene endometriale Erkrankungen (Hyperplasie und Karzinom) verursacht, für die es evidenzbasierte Behandlungen gibt. Es gibt jedoch nur wenig Literatur und keine evidenzbasierten Behandlungen für den Befund eines proliferativen Endometriums ohne Atypie bei der Pipelle-Endometriumbiopsie bei Frauen, die sich mit PMB vorstellen. Unser Ziel ist es, Management- und Behandlungsoptionen für diese Untergruppe von Frauen zu untersuchen. Dies ist eine retrospektive, beobachtende Fallserienuntersuchung von Frauen, die sich mit PMB in einer gynäkologischen Schnellklinik in einem District General Hospital in Manchester, Großbritannien, über einen Zeitraum von drei Wochen vorgestellt haben. Es wurden vier Frauen ausgewählt, bei denen bei einer endometrialen Pipelle-Biopsie ein proliferatives oder sekretorisches Endometrium festgestellt wurde. Ihre Anamnese, Untersuchungsbefunde, Untersuchungen, Behandlung und Folgebefunde wurden dann analysiert. Diese Fallserie hat das Management-Dilemma von Patientinnen mit proliferativem Endometrium ohne Atypie bei der Endometriumentnahme aufgezeigt. Die vier Patientinnen wurden sechs Wochen nach ihrer Vorstellung in der gynäkologischen Fachabteilung mit einer erneuten Pipelle-Endometriumbiopsie nachuntersucht. Anschließend wurden sie beraten oder mit einer oralen Progesterontherapie für sechs bis acht Wochen behandelt. Die Managementoptionen umfassten das Mirena Intrauterin-System (IUS), die orale Progesterontherapie und die Entlassung der Patientin zurück in die Primärversorgung. Es gibt keinen Konsens über die Bedeutung von oralem Progesteron oder die Dauer der Nachsorge, die notwendig ist, um die Entwicklung von Endometriumhyperplasie oder -krebs bei dieser Untergruppe von Patientinnen zu überwachen. Weitere Forschung ist notwendig, um evidenzbasierte Behandlungsrichtlinien für proliferatives Endometrium bei Frauen mit PMB zu entwickeln.
Schlüsselwörter: Postmenopausale Blutung, Proliferatives Endometrium ohne Atypien, Progesterontherapie
1. Einleitung
Post-menopausale Blutungen sind eine wichtige und häufige Vorstellung in der gynäkologischen Klinik. Dringende Untersuchungen sind notwendig, um ein Endometriumkarzinom auszuschließen – die häufigste gynäkologische Malignität in Großbritannien . Auch gutartige Ursachen wie eine atrophische Vaginitis, Polypen und Myome können die Patientin erheblich belasten. Die histologische Diagnose einer Endometriumhyperplasie erhöht das Risiko einer Malignität und eine Behandlung ist erforderlich, um eine Rückbildung herbeizuführen. Im Gegensatz dazu lässt die histologische Diagnose eines proliferativen Endometriums ohne atypische Zellen den Kliniker ohne evidenzbasierte Behandlung und mit der Ungewissheit über das Potenzial für eine maligne Transformation zurück.
In diesem Bericht haben wir vier Fälle von PMB analysiert, deren Untersuchungen ein proliferatives Endometrium auf der Histologie fanden. Diese Fallserie ist von Interesse, weil es in der Literatur nur wenige Hinweise auf proliferatives Endometrium bei postmenopausalen Frauen gibt, die sich mit dem Symptom der PMB vorstellen, und folglich auch keine evidenzbasierte Behandlung. Dieser Bericht wird Bereiche der Unsicherheit in unserem Verständnis und Management dieser Patientinnen aufzeigen.
Methoden
Dies ist eine retrospektive, beobachtende Fallserie, die sich mit Frauen befasst, die sich mit PMB in einer gynäkologischen Rapid Access Clinic (RAC) an einem District General Hospital in Manchester über einen Zeitraum von 3 Wochen im November 2014 vorstellen. Vier Patientinnen mit proliferativem oder sekretorischem Endometrium wurden nach dem Zufallsprinzip für die Endometriumentnahme mit einem Pipelle-Gerät ausgewählt. Die postmenopausalen Frauen in dieser Fallserie wurden alle dringend in die Sekundärversorgung überwiesen, nachdem mindestens eine Blutungsepisode aufgetreten war. In diese Fallserie wurden Frauen jeden Alters aufgenommen, die eine natürliche Menopause durchlaufen haben. Anhand von Fallnotizen wurden Anamnese, Untersuchungsbefunde, Untersuchungen, Behandlung und Nachsorge der einzelnen Patientinnen analysiert.
2. Fallserie
Tabelle 1. Relevante Aspekte der Patientenanamnese.
| Patientin | Alter & Menopausenstatus | Grund der Überweisung | Begleitende Symptome | Vorgeschichte | Verhütung, HRT & Tamoxifen-Status | Gebärmutterhalsabstrich-Anamnese |
| 1 | 54, post-Menopause seit 2 Jahren | Zwei starke Blutungen über jeweils fünf Tage | Unterleibliche Beschwerden | Null | Null | Normal & bis-bis dato |
| 2 | 59, post-menopausal seit 5 Jahren | Zehn Tage starke vaginale Blutungen mit Gerinnseln | Unterleibsbeschwerden und Gewichtsverlust | Typ 2 Diabetes mellitus, Bluthochdruck und Gallensteine | GP initiierte Norethisteron für Blutungen | Normal & bis-bis dato |
| 3 | 52, post-menopausal 1 Jahr | Unregelmäßig dickes Endometrium auf Ultraschall in der Primärversorgung | Intermittierende Blutung mit Gerinnseln und Überschwemmung | Brustkrebs, beidseitige Mastektomie und Axillarknotenentfernung | Mirena IUS und Tamoxifen vor einem Jahr | Normal & bis-bis-heute |
| 4 | 59, post-menopausal | Acht Tage lang ununterbrochene leichte vaginale Blutungen | Milde Unterleibsschmerzen | Hypertension, Hyperthyreose, erhöhter Body-Mass-Index | Null | Unbekannt |
Tabelle 2. Untersuchungsergebnisse und Behandlung.
| Patient | Untersuchung des Beckens& TVUS | Hysteroskopie | Pipellenbiopsie | Wiederholung pipelle biopsy | Behandlung | Dauer der NachsorgeNachbereitung |
| 1 | Normal & 1.3mm | Nicht durchgeführt | Proliferatives Endometrium ohne Atypie oder Malignität | Sekretorisches Endometrium ohne Atypie oder Malignität | MDPA 100mg BD für 6 bis 8 Wochen | 6 Wochen |
| 2 | Normal & 10mm | Normal bis auf 2.5mm polypoidaler Polyp | Sekretorisches Endometrium ohne Atypien oder Malignität | Proliferatives Endometrium ohne Atypie oder Malignität | Mirena IUS Beratung | 6 Wochen |
| 3 | Normal & 2mm | Nicht durchgeführt | Proliferatives Endometrium ohne Atypie oder Malignität | Proliferatives Endometrium ohne Atypie oder Malignität | Nil | 8 Wochen |
| 4 | Normal & 10mm | Normal bis auf einen kleinen Polypen | Proliferatives Endometrium ohne Atypien oder Malignität | Proliferatives Endometrium ohne Atypien oder Malignität | MDPA 100mg BD für 6 bis 8 Wochen | 8 Wochen |
3. Diskussion
3.1. Endometriumveränderungen in der Menopause
Ein Endometrium, das atrophiert und seine funktionelle Schicht verliert, mit endometrialem Stroma, das faserig wird und Drüsen, die weder proliferative noch sekretorische Aktivität zeigen – das ist das akzeptierte Bild des postmenopausalen Endometriums. Diese Rückbildung des Endometriums fällt mit dem Ausbleiben der Menstruation zusammen, so dass beim Auftreten von Blutungen eine Pathologie ausgeschlossen werden muss. Die Physiologie des postmenopausalen Endometriums und seine Rolle in der pelvinen Pathologie hat in den letzten Jahrzehnten das Interesse auf sich gezogen, mit besonderem Fokus auf Vorstufen des Endometriumkarzinoms. Es gibt jedoch viel weniger Literatur über das postmenopausale Endometrium im Vergleich zum Endometrium während des reproduktiven Lebens.
Insgesamt haben Studien gezeigt, dass drei Viertel der postmenopausalen Frauen ein atrophiertes Endometrium mit unterschiedlichem Grad an dilatierten zystischen Drüsen zu haben scheinen. Weitere 15 % haben Endometriumpolypen, die aus zystischen Drüsen bestehen. Endometrium mit Proliferation und Hyperplasie machen die restlichen 10 % aus. Die Atrophie des Endometriums tritt im ersten Jahr der Menopause auf und ihre Häufigkeit bleibt während der Menopause konstant. Im Gegensatz zu Fällen von Proliferation und Hyperplasie, die vor allem in den ersten 5 Jahren nach der Menopause auftreten.
Im Jahr 1954 analysierte McBride in einer großen Studie das postmenopausale Endometrium; er entnahm Proben mittels Kürettage von 1.521 Patientinnen zu verschiedenen Zeitpunkten nach der Menopause. Bei 1.315 Proben wurde außer Schleim wenig Material gewonnen, während die restlichen 206 Fälle folgende Endometriummuster zeigten: Atrophie, einzelne oder diffuse zystische Drüse, Hyperplasie, Proliferation, sekretorische und fibro-adenomatöse Polypen. Die Ergebnisse deuten darauf hin, dass die Inzidenz des proliferativen oder sekretorischen Endometriums 6,3 % beträgt. Der Autor nimmt jedoch an, dass dort, wo keine Probe gewonnen wurde, das Endometrium entweder inaktiv oder atrophiert war. Unter dieser Annahme beträgt die Inzidenz des proliferativen oder sekretorischen Endometriums 0,8 %. Dies lässt vermuten, dass die wahre Inzidenz eines proliferativen oder sekretorischen Endometriums zwischen 6,3 % und 0,9 % liegt.
Eine Studie, die Endometriumbiopsien von peri- und postmenopausalen Frauen unter kontinuierlicher HRT untersuchte, fand heraus, dass die Mehrheit des Endometriums entweder atrophisch (68,7 %) oder proliferativ (23,5 %) ist. Während 0,6% eine einfache Hyperplasie ohne Atypie aufwiesen, hatten 0,5% ein sekretorisches Endometrium und in 0,07% der Fälle wurde ein gut differenziertes Adenokarzinom gefunden. Dies deutet darauf hin, dass post-menopausale Frauen, die eine hormonelle Stimulation erhalten, eine höhere Inzidenz von proliferativem Endometrium haben.
3.2. Ursachen für postmenopausale Blutungen
Postmenopausale Blutungen bezeichnen jede vaginale Blutung bei einer postmenopausalen Frau, die nicht die erwartete zyklische Blutung ist, die bei einer sequentiellen Hormonersatztherapie auftritt . PMB rechtfertigt eine dringende Überweisung in die Gynäkologie, da bei 10 % dieser Patientinnen ein Endometriumkarzinom vorliegt. Eine frühzeitige Diagnose des Endometriumkarzinoms ist wichtig, um die lokale und bösartige Ausbreitung zu reduzieren und ist mit einer Überlebensrate von bis zu 90 % verbunden. Endometriumkarzinom zeigt sich oft früh mit PMB, aber auch atrophische Vaginitis und gutartige Läsionen wie Polypen und Myome sind häufig. Eine Studie ergab, dass bis zu 30 % der Fälle von PMB eine zugrunde liegende anatomische Anomalie aufweisen (siehe Tabelle 3).
Tabelle 3. Die anatomischen Ursachen der postmenopausalen Blutung.
| Endometrium | Zervix | Vagina | Ovar |
| Fibroide | Polypen | Atrophe Vaginitis | Krebs |
| Hyperplasie | Krebs | Krebs | |
| Polyps | |||
| Krebs | |||
| Endometritis |
3.3. Untersuchung der postmenopausalen Blutung
In Übereinstimmung mit den Richtlinien des National Institute of Clinical Excellence (NICE) wurden drei der Patientinnen in unserer Fallserie, die sich mit PMB vorstellten und keine HRT einnahmen, alle an die Sekundärversorgung überwiesen, um Krebs auszuschließen. Diese Patientinnen wurden alle innerhalb von 2 Wochen in einer gynäkologischen Klinik vorgestellt – und erfüllten damit das nationale Ziel für dringende Überweisungen.
Patientinnen, die mit einer HRT behandelt werden, sind komplexer, da es schwierig sein kann, zwischen normalen zyklischen und unregelmäßigen Blutungen zu unterscheiden. Uterusblutungen oder Schmierblutungen bei Beginn einer HRT sind häufig, sollten aber nach 6 Monaten aufhören. NICE empfiehlt jedoch eine dringende Überweisung für anhaltende oder ungeklärte postmenopausale Blutungen nach Beendigung der HRT für 6 Wochen.
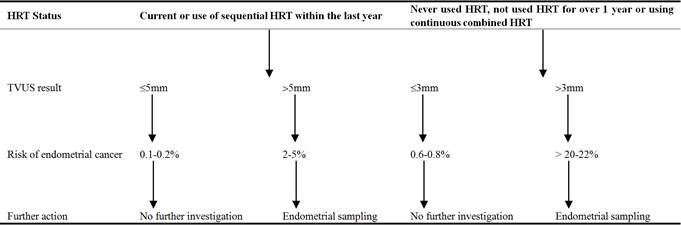
Das Scottish Intercollegiate Guidelines Network (SIGN) bietet einen Algorithmus für die Untersuchung von PMB (siehe Tabelle 4). In Übereinstimmung mit diesen Leitlinien erhielten alle vier Patientinnen eine Beckenuntersuchung, um nach gutartigen Ursachen für die Blutung zu suchen, wie z. B. Zervixektropium, Polypen oder um den Verdacht auf Malignität zu erheben. Eine gründliche Anamnese mit Identifizierung von Endometriumkarzinom-Risikofaktoren wie eine Vorgeschichte mit chronischer Anovulation, Adipositas, Diabetes, Östrogen- oder Tamoxifen-Anwendung und genetischen Syndromen ist wertvoll. Darüber hinaus ermöglicht eine Spekulumuntersuchung erfahrenen Klinikern die Diagnose von vulvalen, vaginalen und zervikalen Läsionen. Eine gründliche Anamnese und Untersuchung kann auch den Verdacht auf seltene Ursachen für vaginale Blutungen wie Gerinnungsstörungen und Leukämie wecken.
Wie von der SIGN empfohlen, war die TVUS die Untersuchung der ersten Wahl bei Frauen, die sich mit PMB in unserer Fallserie vorstellten. Die Evidenzbasis, die Bequemlichkeit und das Fehlen von Komplikationen machen sie zu einer idealen Untersuchung, um Patientinnen mit einem höheren Krebsrisiko zu beurteilen. Bei dickerem Endometrium erhöht sich das Risiko einer Pathologie, wie z. B. Malignität, was eine weitere Untersuchung rechtfertigt. Während Frauen mit dünnem Endometrium beruhigt werden können und nur bei anhaltenden Blutungen zu weiteren Untersuchungen gerufen werden sollten. Die Festlegung des Cut-off-Wertes für die Endometriumdicke schafft ein Gleichgewicht zwischen der Notwendigkeit, alle schwerwiegenden Pathologien zu erkennen, und der Minimierung der Überbeanspruchung von Ressourcen. Die Festlegung des Cut-off-Werts auf 3 mm gewährleistet eine hohe Sensitivität (100 %), beeinträchtigt aber die Spezifität (25,8 %) der Untersuchung, was zu einer übermäßigen Anzahl von Patientinnen führt, die untersucht werden. Derzeit wird in der klinischen Praxis ein Wert von 4 mm verwendet, da er die optimale Sensitivität (91,6 %) und Spezifität (44,5 %) bietet.
Andere Formen der Ultraschalluntersuchung sind verfügbar, wie z. B. transvaginaler Doppler, dreidimensionaler, salzverstärkter Ultraschall und die Messung der endometrialen Textur und Randanalyse. Studien konnten jedoch keine Vorteile gegenüber dem TVUS nachweisen und werden derzeit weder empfohlen noch in der klinischen Routinepraxis eingesetzt
Die direkte Inspektion und Entnahme von Endometriumgewebe gilt als Goldstandard und zweite Untersuchungslinie in dieser Patientenkohorte. Die aktuelle Praxis und die SIGN-Leitlinien empfehlen die Verwendung von Endometriumbiopsien zur weiteren Untersuchung von Patientinnen, bei denen ein erhöhtes Risiko für Endometriumkrebs angenommen wird. Konventionell wurde die Dilatation & Kürettage verwendet, um abnormale Blutungen zu untersuchen, aber die Evidenz unterstützt jetzt die Verwendung von Endometriumprobenentnahmegeräten wie dem Pipelle-Gerät – das bei allen vier Patientinnen in meiner Fallserie verwendet wurde. Es hat eine Erkennungsrate von 99,6 % für Endometriumkarzinom bei postmenopausalen Frauen sowie eine hohe Sensitivität (81 %) und Spezifität (98 %) für die Erkennung atypischer Hyperplasien. Zusammenfassend bietet eine Kombination aus TVUS und Pipelle-Endometriumbiopsie ausreichende diagnostische Informationen, um benigne und maligne Endometriumerkrankungen zu diagnostizieren oder auszuschließen.
Patientinnen, die mit Tamoxifen behandelt werden, haben eine drei- bis sechsfach höhere Inzidenz von Endometriumkrebs, und eine dringende Überweisung für solche Frauen, die über PMB klagen, wird vom NICE empfohlen. Es hat sich gezeigt, dass das Krebs- und Proliferationsrisiko aufgrund der schwachen östrogenen Wirkung von Tamoxifen mit zunehmender Dosis und Dauer der Behandlung ansteigt. Patientin 3 in unserer Fallserie, eine 59-jährige Frau unter Tamoxifen, wurde neben einer TVUS und Pipelle-Biopsie auch mittels Hysteroskopie umfangreicher untersucht. Dies entspricht den Leitlinien, die empfehlen, dass die Hysteroskopie mit Biopsie dem TVUS vorzuziehen ist, da die Interpretation des Ultraschalls durch die Verdickung des Endometriums bei Patientinnen, die Tamoxifen einnehmen, erschwert wird.
Tabelle 4. Frauen, die sich mit postmenopausalen Blutungen vorstellen (und kein Tamoxifen einnehmen).
3.4. Endometriumhyperplasie
Die Diagnose einer Endometriumhyperplasie (EH) wird bei etwa 10 % der Frauen gestellt, die sich mit PMB vorstellen. Die Weltgesundheitsorganisation (WHO) klassifiziert die Endometriumhyperplasie in einfache und komplexe Typen; jeder Typ wird dann weiter nach dem Vorhandensein oder Fehlen einer Kernatypie klassifiziert. Bei Frauen, bei denen in der Endometriumbiopsie eine Atypie (siehe Abbildung 2) festgestellt wird, sind weitere Untersuchungen erforderlich, da bei etwa 50 % gleichzeitig ein Endometriumkarzinom vorliegt. Darüber hinaus ist das Risiko, an Krebs zu erkranken, bei Vorhandensein einer Atypie erhöht (27,5 % 9 Jahre nach der Diagnose), bei einer Hyperplasie ohne Atypie jedoch wesentlich geringer (4,6 % 9 Jahre nach der Diagnose). Angesichts der Wahrscheinlichkeit einer zukünftigen Malignität wird bei postmenopausalen Frauen mit EH bei Vorliegen einer Atypie eine Hysterektomie mit bilateraler Salpingo-Oophorektomie empfohlen. Wenn keine atypischen Zellen vorhanden sind, können die Frauen mit Gestagenen und seriellen Biopsien alle 6 Monate behandelt werden, um das Ansprechen auf die Behandlung sicherzustellen. Zu den häufig verwendeten Gestagenen gehören Megestrolacetat und Medroxyprogesteronacetat. Obwohl die vier Patientinnen in unserer Fallserie keine Endometriumhyperplasie hatten, kann postuliert werden, dass, wenn atypische Zellen gefunden worden wären, das Risiko einer Malignität und die Notwendigkeit weiterer Untersuchungen bei Patientinnen mit proliferativem oder sekretorischem Endometrium gestiegen wäre.
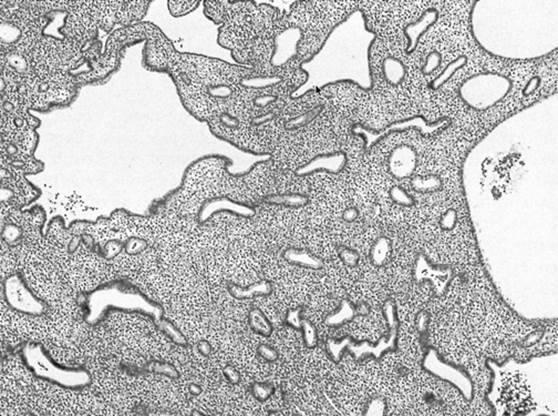
Abbildung 1. Eine Endometriumbiopsie zeigt eine einfache Endometriumhyperplasie, mit unregelmäßig verteilten Endometriumdrüsen, die durch hyperplastisches Stroma weit voneinander getrennt sind.
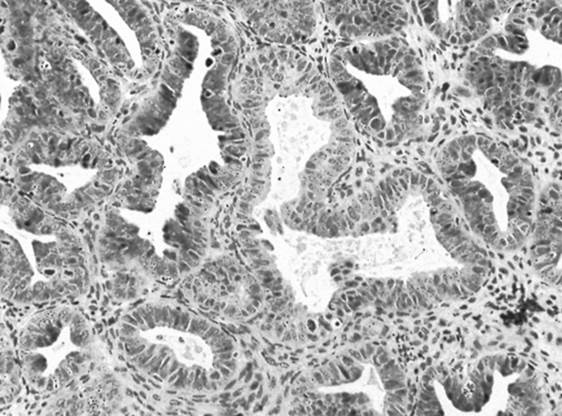
Abbildung 2. Eine Endometriumbiopsie zeigt eine endometriale Hyperplasie mit atypischen Drüsenzellen.
3.5. Pathogenese des proliferativen Endometriums
Mein Bericht hat postmenopausale Frauen identifiziert, deren Biopsien das Endometrium nachahmten, das im monatlichen Menstruationszyklus einer reproduktiven Frau gefunden wird. Erhöhte mitotische Aktivität des Stromaepithels, begleitet von zellulärer Hyperplasie und erhöhter extrazellulärer Matrix, führen zu einer Verdickung des Endometriums während der proliferativen Phase des Endometriums (siehe Abbildung 3). Diese Proliferation wird durch Östrogen stimuliert, das von den sich entwickelnden Follikeln während des Menstruationszyklus sezerniert wird. Progesteron wirkt den Wirkungen des Östrogens entgegen und stoppt mit seinen Effekten die proliferative Phase des Endometriumzyklus. Progesteron induziert die sekretorische Phase, indem es die endometrialen Drüsen stimuliert und die Vaskularität erhöht (siehe Abbildung 4). Die Dicke des Endometriums nimmt weiter zu, da Drüsen, Stromazellen und Blutgefäße verstopft werden. Man nimmt an, dass bei postmenopausalen Frauen niedrige Östrogen- und Progesteronspiegel aus extrafollikulären Quellen das Endometrium zur Proliferation anregen. Darüber hinaus sind Phytoöstrogene wie Ölsamen, Sojaprodukte und Tofu Pflanzenstoffe, die strukturell und funktionell dem Östradiol ähnlich sind. Obwohl Studien darauf hindeuten, dass Phytoöstrogene weder die Proliferation induzieren noch das Risiko für Endometriumkarzinom erhöhen, sind ihre langfristigen Auswirkungen relativ unbekannt . In ähnlicher Weise besteht Unsicherheit bei der rezeptfreien Anwendung von Traubensilberkerze – einem pflanzlichen Mittel mit potenziell proliferativer Wirkung auf das Endometrium.
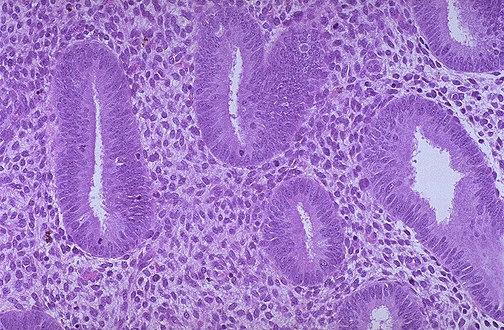
Abbildung 3. Das mikroskopische Erscheinungsbild des proliferativen Endometriums, mit Proliferation von tubulären Drüsen und dichtem Stroma.
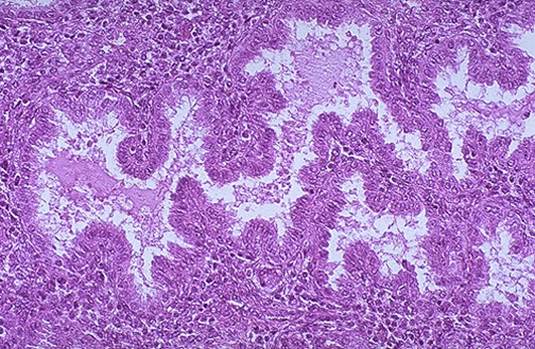
Abbildung 4. Das mikroskopische Erscheinungsbild des sekretorischen Endometriums und große gewundene Drüsen, die mit Sekreten gefüllt sind.
Studien haben gezeigt, dass proliferatives Endometrium nicht ungewöhnlich ist und legen auch nahe, dass Krebserkrankungen des Endometriums vor dem Hintergrund einer proliferativen Aktivität und nicht aus Trägheit entstehen. Die Wahrscheinlichkeit, dass sich ein einfaches proliferatives Endometrium in ein Malignom verwandelt, ist jedoch sehr gering und liegt deutlich unter dem Risiko von 0,3 bis 1 %, dass sich eine Endometriumhyperplasie zu Krebs entwickelt . Zu den Risikofaktoren gehören jedoch ein erhöhter Body-Mass-Index und das Alter. Beide sind mit einer peripheren Aromatisierung und häufigen Komorbiditäten bei Patientinnen mit Endometriumkarzinom verbunden.
3.6. Management des proliferativen Endometriums
Es gibt unseres Wissens keine publizierten Studien, die sich mit dem Management von Endometriumproliferation ohne Atypien bei postmenopausalen Blutungen beschäftigen. Infolgedessen gibt es derzeit keine evidenzbasierte Behandlung für solche Frauen. Es gibt auch keinen Konsens über die empfohlene Dosis und Dauer der Behandlung mit MDPA bei dieser Untergruppe von Patientinnen. Darüber hinaus gibt es keine Einigung über die Häufigkeit der Nachsorge, die erforderlich ist, um schwerwiegendere endometriale proliferative Pathologien auszuschließen.
Es gibt einige Denkschulen unter Gynäkologen darüber, wie man diese Patientinnen am besten behandelt. Da das Risiko, dass sich ein proliferatives Endometrium in ein Karzinom verwandelt, als sehr gering eingeschätzt wird, besteht eine Option darin, die Patientin zu beruhigen, bevor sie wieder in die Primärversorgung entlassen wird. Ein konservativerer Ansatz besteht hingegen in der Anwendung einer systemischen Progesterontherapie, um eine Rückbildung des Endometriums zu induzieren. Orales Medroxyprogesteronacetat kann für einen relativ kurzen Zeitraum (sechs bis acht Wochen in unserer Fallserie) verschrieben werden, um eine Rückbildung des Endometriums zu induzieren. Die Vorteile der Progesterontherapie müssen sorgfältig gegen ihre Nebenwirkungen wie das Risiko einer tiefen Venenthrombose abgewogen werden. Eine längerfristige Option, die von einigen Gynäkologen in Betracht gezogen wird, ist das Mirena Intrauterin-System, eine lang wirkende reversible Form der Kontrazeption, die das Endometrium durch Abgabe von Progesteron in die Gebärmutter verdünnt. Beide Formen von Progesteron werden auch bei Endometriumhyperplasie eingesetzt und schützen nachweislich das Endometrium vor Proliferation und maligner Transformation . Mirena IUS ist lizenziert, um das Endometrium für 4 Jahre zu schützen. Die zweite Patientin in unserer Fallserie wurde mit einer Progesterontherapie begonnen, nachdem bei einer Pipelle-Biopsie ein proliferatives Endometrium festgestellt wurde, während die vierte Patientin nach Bestätigung der Histologie mit einer erneuten Pipelle-Biopsie mit der gleichen Behandlung begonnen wurde. Aufgrund der fehlenden Evidenz ist es unsicher, ob eine Wiederholungsbiopsie zur Bestätigung des Befundes erforderlich ist oder eine einzige Biopsie zur Behandlung ausreicht. Wir haben auch festgestellt, dass die Patientinnen in unserer Fallserie 6 bis 8 Wochen lang mit oralem Medroxyprogesteron behandelt wurden, aber unseres Wissens hat keine Studie die ideale Behandlungsdauer untersucht. Ein radikalerer Ansatz zur Behandlung des proliferativen Endometriums wäre eine Hysterektomie bei wiederholten Episoden von PMB, um jedes Risiko einer Transformation in ein Endometriumkarzinom auszuschließen. Aufgrund der Anästhesie, der operativen Risiken und der psychologischen Auswirkungen ist dies jedoch der letzte Ausweg. Bei drei der vier Patientinnen wurde eine Nachuntersuchung und eine erneute Pipelle-Endometriumbiopsie in 6 Wochen angeordnet. Es gibt jedoch keine Erkenntnisse über die Häufigkeit der Nachuntersuchungen oder die Beurteilung des Ansprechens auf die Behandlung. Darüber hinaus ist unklar, ob Risikofaktoren wie ein hoher BMI und Brustkrebs die Schwelle für das Angebot einer wiederholten Pipelle-Biopsie senken sollten.
4. Schlussfolgerung
Dieser Bericht hat die aktuellen Trends im Management des proliferativen Endometriums mit oralem Medroxyprogesteron aufgezeigt. Mehrere Bereiche mit Unsicherheiten, wie z. B. die Dauer der Behandlung und die Nachsorge, wurden hervorgehoben. Weitere Forschung zum proliferativen Endometrium bei PMB ist notwendig, um evidenzbasierte Behandlungsrichtlinien zu entwickeln.
- UK CR. Cancer Statistics: Registrations Series. 2011.
- McBride. The normal post-menopausal endometrium. J Obstet Gynaecol Br Emp 1954;61 (5):691-7.
- Noer T. The histology of the senile endometrium. Acta Pathologica Microbiologica Scandinavica 1961;51 (3):193.
- Korhonen MO, Symons JP, Hyde BM, Rowan JP, Wilborn WH. Histologische Klassifikation und pathologische Befunde für Endometriumbiopsieproben von 2964 perimenopausalen und postmenopausalen Frauen, die sich einem Screening für eine kontinuierliche Hormonersatztherapie unterzogen (CHART 2 Studie). American Journal of Obstetrics and Gynecology 1997;176 (2):377.
- Goldstein RB, Bree RL, Benson CB, Benacerraf BR, Bloss JD, Carlos R, et al. Evaluation of the woman with postmenopausal bleeding: Society of Radiologists in Ultrasound-Sponsored Consensus Conference statement. J Ultrasound Med 2001;20 (10):1025-36.
- SIGN. Investigation of Post-Menopausal Bleeding. 2002.
- Paley PJ. Screening auf die wichtigsten bösartigen Erkrankungen bei Frauen: Current guidelines. American journal of obstetrics and gynecology 2001;184 (5):1021.
- NICECG27. Referral Guidlines for Suspected Cancer. 2005.
- Nand SL, Webster MA, Baber R, O’Connor V. Bleeding pattern and endometrial changes during continuous combined hormone replacement therapy. The Ogen/Provera Study Group. Obstet Gynecol 1998;91 (5 Pt 1):678-84.
- Davidson KG, Dubinsky TJ. Ultrasonographische Beurteilung des Endometriums bei postmenopausalen vaginalen Blutungen. Radiol Clin North Am 2003;41 (4):769-80.
- Gupta JK, Chien PFW, Voit D, Clark TJ, Khan KS. Ultrasonographische Endometriumdicke zur Diagnose von Endometriumpathologie bei Frauen mit postmenopausalen Blutungen: eine Meta-Analyse. Acta Obstetricia et Gynecologica Scandinavica 2002;81 (9):799.
- Dijkhuizen FPHLJ, BrÃ-Lmann HAM, Potters AE, Bongers MY, Heintz APM. Die Genauigkeit der transvaginalen Ultraschalluntersuchung bei der Diagnose von Endometriumanomalien. Obstetrics & Gynecology 1996;87 (3):345-349.
- Ciatto S, Cecchini S, Gervasi G, Landini A, Zappa M, Crocetti E. Surveillance for endometrial cancer with transvaginal ultrasonography of breast cancer patients under tamoxifen treatment. Br J Cancer 2003;88 (8):1175-9.
- Weber G, Mere E, Bahlmanw E, Riisch B. Evaluation verschiedener transvaginaler sonographischer Diagnoseparameter bei Frauen mit postmenopausalen Blutungen. Ultraschall in der Geburtshilfe und Gynäkologie 1998;12 (4):265.
- Gruboeck K, Jurkovic D, Lawton F, Savvas M, Tailor A, Campbell S. The diagnostic value of endometrial thickness and volume measurements by three-dimensional ultrasound in patients with postmenopausal bleeding. Ultrasound in Obstetrics and Gynecology 1996;8 (4):272.
- Dijkhuizen FPHLJ, Mol BWJ, Brölmann HAM, Heintz APM. Die Genauigkeit der Endometriumentnahme bei der Diagnose von Patientinnen mit Endometriumkarzinom und Hyperplasie. Cancer 2000;89 (8):1765.
- Van den Bosch T, Vandendael A, Van Schoubroeck D, Wranz PA, Lombard CJ. Die Kombination von vaginalem Ultraschall und Endometriumprobenentnahme im Büro bei der Diagnose von Endometriumerkrankungen bei postmenopausalen Frauen. Obstet Gynecol 1995;85 (3):349-52.
- Curtis RE, Boice JD, Shriner DA, Hankey BF, Fraumeni JF. Second Cancers After Adjuvant Tamoxifen Therapy for Breast Cancer. Journal of the National Cancer Institute 1996;88 (12):832-835.
- Karlsson B, Granberg S, Wikland M, Torvid K, Marsal K, et al. Transvaginal ultrasonography of the endometrium in women with postmenopausal bleeding âa Nordic multicenter study. American Journal of Obstetrics and Gynecology 1995;172 (5):1488.
- Lacey JV, Chia VM. Endometriumhyperplasie und das Risiko der Progression zum Karzinom. Maturitas 2009;63 (1):39.
- Lacey JV, Sherman ME, Rush BB, Ronnett BM, Ioffe OB, Duggan MiA, et al. Absolute Risk of Endometrial Carcinoma During 20-Year Follow-Up Among Women With Endometrial Hyperplasia. Journal of Clinical Oncology 2010;28 (5):788-792.
- Silverberg. Tumoren des Gebärmutterkörpers und trophoblastische Gestationskrankheit. AFIP Atlas of Tumor Pathology 1995.
- Balk JL, Whiteside DA, Naus G, DeFerrari E, Roberts JM. Eine Pilotstudie über die Auswirkungen einer Phytoöstrogen-Supplementierung auf das postmenopausale Endometrium. J Soc Gynecol Investig 2002;9 (4):238-42.
- Pathologie FG. http://library.med.utah.edu/WebPath/FEMHTML/FEMIDX.html#2.
- Sivridis E, Giatromanolaki A. Proliferative activity in postmenopausal endometrium: the lurking potential for giving rise to an endometrial adenocarcinoma. J Clin Pathol 2004;57 (8):840-4.
- Baak JP, Wisse-Brekelmans EC, Fleege JC, van der Putten HW, Bezemer PD. Einschätzung des Risikos auf Endometriumkrebs bei Hyperplasie, anhand morphologischer und morphometrischer Merkmale. Pathol Res Pract 1992;188 (7):856-9.
- Wan YL, Holland C. The efficacy of levonorgestrel intrauterine systems for endometrial protection: a systematic review. Climacteric;14 (6):622-632.