Frühe Komplikationen
Schleimhautablösung
Stomanekrose
Stomale Retraktion
 Spätkomplikationen
Spätkomplikationen
Stomalstenose
Stomalprolaps
Stomaltrauma
Parastomalhernie
 Schlussfolgerungen
Schlussfolgerungen
Komplikationen nach der chirurgischen Anlage eines Stomas sind für viele Menschen ein großes Problem. Diese Komplikationen sind oft vielschichtig und umfassen sowohl physiologische als auch psychosoziale Aspekte. Der physiologische Aspekt von Stomakomplikationen beinhaltet Veränderungen des Stomas und der peristomalen Haut (Cottam et al., 2007). In diesem Kapitel wird der physiologische Aspekt von Stomakomplikationen unter Einbeziehung des Stomas diskutiert.
Stomakomplikationen sind ein signifikantes Problem für Personen mit einem Stoma, jedoch sind die Definitionen und die Terminologie in der Literatur oft nicht konsistent (Colwell et al., 2001; Salvadalena, 2008). Unterschiede im Studiendesign, inkonsistente Definitionen und Terminologie sowie der Zeitpunkt der Messungen machen es schwierig, die Häufigkeit von Stomakomplikationen genau zu messen (Salvadalena, 2008). Aufgrund der inkonsistenten Verwendung der Terminologie kann die Unterscheidung zwischen stomalen und peristomalen Komplikationen schwierig sein.
Gesamtinzidenzraten von Komplikationen wurden berichtet, wobei die Spannweiten sehr groß sind. Zwei umfassende systematische Übersichten der Literatur über Stomakomplikationen gaben an, dass bei 18% bis 55% der Patienten mit einem Stoma peristomale Hautirritationen auftraten, bei 1% bis 37% eine parastomale Herniation, bei 2% bis 25% ein Stomaprolaps, bei 2% bis 10% eine Stenose und bei 1% bis 11% eine Retraktion des Stomas (Colwell et al., 2001; Salvadalena, 2008). Ratliff et al. (2005) berichteten, dass 10% bis 70% aller Patienten mit einem Stoma Komplikationen entwickeln (Ratliff et al., 2005). Um dies in eine praktische Perspektive zu bringen, unter Verwendung der oben genannten Schätzungen, stellen Stomakomplikationen ein signifikantes Problem dar, da bis zu 560.000 Personen, die ein Stoma erhalten, stomabezogene Komplikationen erfahren. Wenn wir die jährliche Inzidenz verwenden, kann erwartet werden, dass bis zu 84.000 Personen mit einem neuen Stoma jährlich stomabezogene Komplikationen entwickeln (Pittman, 2011).
Verschiedene Patientencharakteristika sind als assoziiert mit Stomakomplikationen identifiziert worden, aber Studien mit prädiktiven Analysemodellen sind begrenzt. In mehreren Studien wurde festgestellt, dass ein höherer Body-Mass-Index (BMI), ein höheres Alter, eine dringende Operation, eine entzündliche Darmerkrankung, eine Ileostomie (im Vergleich zu einer Kolostomie), ein Divertikelverfahren, eine schlechte Darmqualität, eine ischämische Kolitis, eine Stomaretraktion, ein Mangel an präoperativer Aufklärung und die Einbindung einer Wund-, Stoma- und Kontinenzpflegekraft (WOC) die Entwicklung von Stomakomplikationen beeinflussen (Bass et al., 1997; Colwell et al., 2001; Duchesne et al., 2002; Park et al., 1999; Pittman et al., 2008). In der bahnbrechenden retrospektiven Studie, die von Bass am Cook County Hospital in Chicago durchgeführt wurde, wurden die Komplikationsraten zwischen den Patienten, die eine präoperative Aufklärung und Stomamarkierung durch einen enterostomalen Therapeuten (WOC-Krankenschwester) erhielten, und denen, die dies nicht taten, verglichen (Bass et al., 1997). Sie fanden heraus, dass unter den Patienten, die eine präoperative Aufklärung und Stomamarkierung durch einen Enterostomatherapeuten erhielten, 32,5% Komplikationen entwickelten, verglichen mit 43,5% der Patienten, die diese klinischen Interventionen nicht erhielten (p = 0,05). Das Ostomy Complication Conceptual Model (Abb. 16-1) bietet einen Rahmen für die Erforschung von Stomakomplikationen und der Risikofaktoren, die zu deren Auftreten beitragen (Pittman et al., 2014).
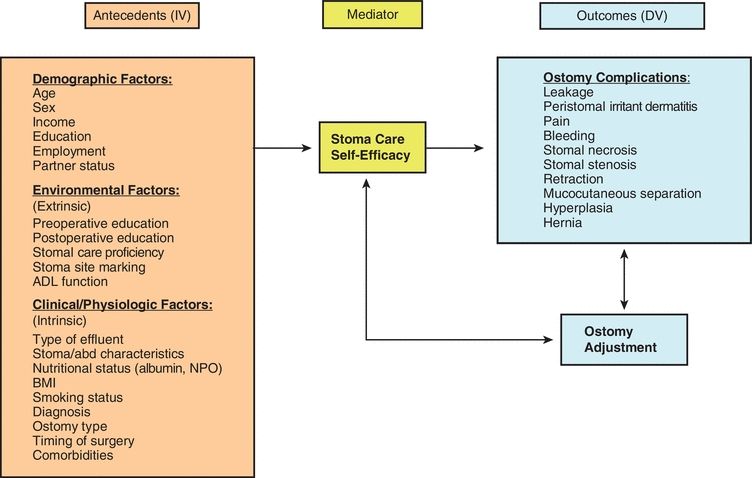
Abbildung 16-1. Pittman Ostomy Complication Conceptual Model.
Eine Methode zur Klassifizierung von Stomakomplikationen ist die Unterteilung in frühe, innerhalb von 30 Tagen nach der Operation, und späte Komplikationen, >30 Tage nach der Operation (Duchesne et al, 2002; Kim & Kumar, 2006; Park et al., 1999; Shabbir & Britton, 2010). In diesem Kapitel gliedern wir unsere Diskussion über Stomakomplikationen anhand dieser Klassifizierung, wobei wir anerkennen, dass einige Komplikationen sowohl in frühen als auch in späten Zeiträumen auftreten können.
Frühe Komplikationen
Frühe Stomakomplikationen sind solche, die üblicherweise innerhalb von 30 Tagen nach der Operation auftreten und umfassen mukokutane Separation, Stomanekrosen und Stomaretraktion.
Mukokutane Separation
Etiologie/Häufigkeit
Mukokutane Separation ist die Ablösung des Stomagewebes von der umgebenden peristomalen Haut (Colwell & Beitz, 2007) des Stomas, und die mukokutane Verbindung kann eine Folge von schlechter Heilung, Spannung oder Infektion sein. Die Inzidenz der mukokutanen Separation wurde mit 4 % bis zu 24 % angegeben. Park et al. (1999) berichteten in ihrer Untersuchung von 1.616 Stomapatienten, dass 4 % der Patienten eine mukokutane Separation hatten (Park et al., 1999). In einer prospektiven Studie mit 3.970 Stomas berichteten Cottam et al. (2007), dass 24 % eine mukokutane Separation aufwiesen. In einer anderen Studie mit 71 Probanden hatten 13 % eine mukokutane Separation (Pittman et al., 2014).
Vorstellung
Gesunde Stomata haben eine eng anliegende und intakte mukokutane Junktionsstelle (wo das Stoma an der Bauchwand befestigt ist). Bereits 24 Stunden nach der Operation können sich das Stoma und die mukokutane Verbindung zu trennen beginnen.
Beurteilung
Die Beurteilung des Stomas erfolgt durch genaue visuelle Beobachtung des Stomas und der Integrität der mukokutanen Verbindung. Eine Separation ist offensichtlich, wenn sich das Stoma von der peristomalen Haut ablöst (Abb. 16-2). Die mukokutane Separation kann in unterschiedlichen Schweregraden auftreten: partiell – wenn nur ein Teil des Stomaumfangs betroffen ist – oder vollständig – wenn der gesamte Umfang betroffen ist. Die Trennung kann auch oberflächlich sein, nur auf der Ebene der Haut, oder in voller Dicke, bis auf die Ebene der Faszien (Franchini et al., 1983). Eine genaue Beobachtung des Trennungsbereichs ist notwendig, wobei die Tiefe, die Eigenschaften des Wundgrundgewebes (nekrotisch, körnig) und die Art der Drainage (serös-blutig, eitrig, fäkal) zu beachten sind.
CLINICAL PEARL
Verwenden Sie einen Wattestäbchen-Applikator, um die Tiefe der mukokutanen Separation zu beurteilen.
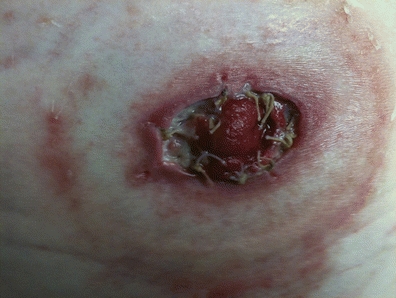
Abbildung 16-2. Mukokutane Separation.
Management
Das Management der mukokutanen Separation hängt vom Grad der Separation ab. Wenn die Trennung partiell und oberflächlich ist, kann der subkutane Defekt klein sein und konservativ behandelt werden. Der subkutane Defekt kann wie eine Wunde behandelt und mit einem modernen Wundprodukt wie Hautbarrierepulver, Hydrofaser oder Kalziumalginat gefüllt werden. Die Hautbarriere des Pouching-Systems wird über die peristomale Haut und den Defekt gelegt, um einen Schutz vor dem Stomaausfluss zu bieten. Das Pouching-System wird nach Bedarf gewechselt, um die Drainage zu steuern, die Heilung zu beurteilen und das absorbierende Füllmaterial erneut aufzutragen (Colwell, 2004).
Wenn der Defekt groß ist, ist eine fäkale Kontamination des peristomalen subkutanen Defekts wahrscheinlich und es kann zu einer Infektion kommen. Je schwerer die Trennung ist, desto wahrscheinlicher ist eine Retraktion des Stomas. Bei Heilung ist die Wahrscheinlichkeit einer Stenose hoch. Wenn die mukokutane Separation die Faszienschicht mit einbezieht (was selten vorkommt), kann das Stoma in die Bauchhöhle fallen, und es kann zu einer Kontamination des Abdomens mit fäkalem Ausfluss und einer generalisierten Peritonitis kommen. Eine Rückführung in die Chirurgie ist zur Reparatur indiziert.
Stomale Nekrose
Etiologie/Häufigkeit
Stomale Nekrose ist definiert als das Absterben des Stomagewebes als Folge von beeinträchtigtem Blutfluss (Colwell & Beitz, 2007) und wurde als eine der häufigsten Frühkomplikationen identifiziert (Duchesne et al, 2002; Kim & Kumar, 2006; Park et al., 1999; Shabbir & Britton, 2010). Eine Ischämie des Stomagewebes wird in der Regel durch eine Überlastung oder Unzulänglichkeit der mesenterialen Vaskulatur zum Darmende verursacht. Sie kann auch durch ein Trauma des Stomagewebes während seiner Entstehung verursacht werden. Die Stomanekrose wird mit Adipositas in Verbindung gebracht und ist oft eine Folge des Zugs, der auf das Mesenterium und die Darmwand ausgeübt wird (Colwell & Fichera, 2005).
Darstellung
Die fortschreitende Stomanekrose zeigt sich durch eine fortschreitende Verfärbung des Stomagewebes von rosa bis schwarz. Das Stoma erscheint in der Regel innerhalb von Stunden bis Tagen nach der Operation dunkel und trocken, um dann schwarz und schlaff zu werden. Der Grad der Nekrose kann in Abhängigkeit vom Grad der Ischämie variieren. Sie kann das gesamte Stoma umfassen und sich bis unter die Faszie erstrecken, oder nur einen Teil des Stomas und oberhalb des Hautniveaus.
Beurteilung
Die Beurteilung der Stomanekrose erfolgt durch genaue visuelle Beobachtung. Innerhalb von 24 Stunden nach der Operation sind normalerweise Farbveränderungen des Stomas sichtbar. Die Farbe des Stomas entwickelt sich von dunkelrot bis schwarz (Abb. 16-3). Um den Grad oder das Ausmaß der Stomanekrose zu bestimmen, kann ein durchsichtiges, glasbeschichtetes Rohr in das Stoma eingeführt werden. Mit einer in das Glasrohr gerichteten Lampe kann eine Farbänderung des Stomas festgestellt werden, die den Grad der Ischämie anzeigt.
CLINICAL PEARL
Es ist ratsam, in der unmittelbaren postoperativen Zeit einen durchsichtigen Beutel zu verwenden, um eine Beurteilung der Stoma-Farbe zu ermöglichen.
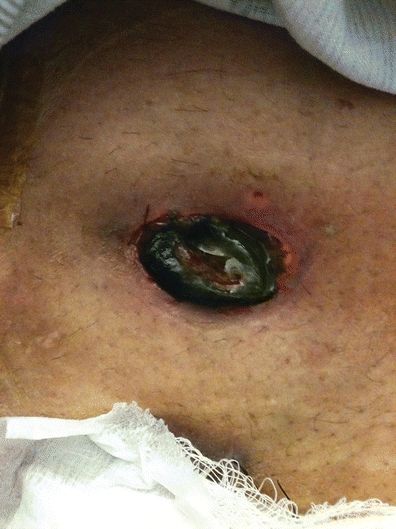
Abbildung 16-3. Stomale Nekrose.
Eine neue innovative Methode zur Beurteilung der Gewebeperfusion ist die intraoperative Laserangiographie mit Indocyaningrün. Diese vaskuläre Bildgebungstechnologie bietet eine Echtzeitbewertung der Gewebeperfusion, die mit den klinischen Ergebnissen korreliert und zur Unterstützung der chirurgischen Entscheidungsfindung verwendet werden kann (Gurtner et al., 2013). Diese Methode wird primär intraoperativ eingesetzt, um die Perfusion des Stomas und des Darms zum Zeitpunkt der Resektion zu beurteilen.
Management
Stomanekrosen sind oft eine „watch-and-wait“-Situation. Wenn die Ischämie und Nekrose oberhalb der Faszienebene liegt, kann eine Beobachtung ausreichend sein. Wenn die Ischämie und Nekrose oberflächlich ist, kann die oberste Schicht des Stomas abblättern und ein rotes, lebensfähiges Stoma hinterlassen. Wenn die Stoma-Ischämie und -Nekrose unterhalb der Haut, aber noch oberhalb der Faszienebene liegt, wird das nekrotische Stomagewebe übelriechend und schlaff. Ein Debridement ist oft indiziert. Nachdem das nekrotische Gewebe entfernt wurde oder abgefallen ist, kommt es in der Regel zu einer mukokutanen Separation. Während die mukokutane Trennung abheilt, kann eine Stenose auftreten. Außerdem wird die Höhe des Stomas über der Haut verringert, was oft zu Problemen beim Pouching führt. Wenn die Ischämie und Nekrose tiefer als das Faszienniveau reichen, kann eine dringende chirurgische Intervention indiziert sein.
Stoma-Retraktion
Etiologie/Häufigkeit
Retraktion ist das Verschwinden des Stomagewebevorsprungs in einer Linie mit oder unter dem Hautniveau (Colwell & Beitz, 2007). Die Retraktion wird in der Regel durch Spannung auf das Stoma aus einer Vielzahl von Gründen verursacht: kurzes Mesenterium, verdickte Bauchwand, übermäßige Adhäsionen oder Narbenbildung, erhöhter BMI, unzureichende anfängliche Stomalänge oder unsachgemäße Hautexzision, Stomanekrose und mukokutane Separation (Colwell, 2004). Anekdotische Hinweise deuten darauf hin, dass Retraktionen häufig bei übergewichtigen Patienten mit größeren Fettschichten auftreten. Ein verkürztes und fetthaltiges Mesenterium erschwert eine adäquate Mobilisierung des Darms und erzeugt so eine Spannung auf das Stoma (Cottam, 2005).
Ratliff und Donovan (2001) fanden heraus, dass 9 (4 %) von 220 Stomapatienten ein flushes oder retrahiertes Stoma hatten. In einer prospektiven Studie mit 3.970 Stomata berichteten Cottam et al. (2007), dass 40,1 % eine Retraktion hatten. In der prospektiven Studie von Pittman mit 71 Teilnehmern mit einem Stoma hatten 24 (39 %) eine Retraktion (Pittman et al., 2014). In einer 3-Jahres-Retrospektivstudie mit 164 Patienten, bei denen eine Operation zu einem Stoma führte, traten Retraktionen bei 5 % dieser Patienten auf (Duchesne et al., 2002). In einer anderen Studie mit 97 Patienten mit einem Stoma wurde festgestellt, dass der BMI mit einer Retraktion assoziiert ist (p = 0,003) (Arumugam et al., 2003). Die Inzidenz der Retraktion scheint zuzunehmen. Cottam et al. (2007) berichteten, dass sich die Inzidenz der Stomaretraktion (Stoma unterhalb des Hautniveaus) zwischen 1996 und 2004 mehr als verdoppelt hat (22% vs. 51%) (Colwell und Beitz, 2007). In einer systematischen Literaturübersicht traten Stomaretraktionen bei 9 % bis 15 % der Ilealkanäle und bei 1 % bis 11 % aller Stomata auf (Szymanski et al., 2010). In der Studie von Pittman traten bei Patienten, die ihre Stomastelle präoperativ nicht von einer WOC-Schwester markieren ließen, schwerwiegendere Stomakomplikationen auf, insbesondere Stomaretraktionen (r = 0,32, p = 0,01) (Pittman et al., 2014).
Präsentation
Ein gesundes Stoma sollte über dem Niveau der umgebenden Haut liegen. In der Vergangenheit gab es das Missverständnis, dass Kolostomien bündig mit der Haut sein sollten. Dies hat sich weder in der Literatur noch in der Praxis bestätigt. In Cottams Studie mit 1.329 problematischen Stomata lag bei einer Stomahöhe von <10 mm die Wahrscheinlichkeit, ein problematisches Stoma zu haben, bei mindestens 35 % (p < 0,0001) (Cottam et al, 2007).
Beurteilung
Das Stoma muss ohne das angelegte Pouchingsystem und in verschiedenen Positionen – sitzend, liegend und stehend – beobachtet werden. Die Höhe des Stomas und der umgebenden Haut muss genau beobachtet werden. Das Stoma kann im Sitzen in einer Hautfalte verschwinden oder bei Positionsveränderungen und bei Peristaltik bündig werden oder sich sogar zurückziehen.
Management
Das Ziel einer erfolgreichen Pouching-Versorgung des Stomas ist es, eine flache Pouching-Oberfläche zu haben oder zu schaffen. Wenn eine Retraktion vorhanden ist, besteht das Ziel darin, das Niveau des Stomas über der Haut zu vergrößern. Dies kann manchmal durch ein konvexes Pouching-System und/oder einen Gürtel erreicht werden. Wenn eine vorhersehbare Tragezeit nicht erreicht wird und Komplikationen anhalten, kann ein chirurgischer Eingriff zur Revision des Stomas erforderlich sein. Eine lokale Revision kann möglich sein, wenn ausreichend Darm vorhanden ist, der oberhalb des Hautniveaus mobilisiert werden kann; ist dies nicht der Fall, kann eine invasivere Operation notwendig sein, um ein neues Stoma anzulegen.
Spätkomplikationen
Spätkomplikationen des Stomas sind solche, die mindestens 30 Tage nach der Operation auftreten und häufig eine Stomstenose, einen Prolaps und eine parastomale Herniation umfassen (Duchesne et al., 2002; Kim & Kumar, 2006; Park et al., 1999; Shabbir & Britton, 2010; Steel & Wu, 2002). Mit dem Fortschritt der chirurgischen Techniken und der laparoskopischen Chirurgie werden verschiedene Operationstechniken erforscht, um das Risiko der Entwicklung von Langzeitkomplikationen zu minimieren (Gurtner et al., 2013; Heiying et al, 2014).
Stomalstenose
Etiologie/Häufigkeit
Stomalstenose ist die Beeinträchtigung des Abflusses aufgrund einer Verengung oder Kontraktion des Stomagewebes auf Haut- oder Faszienniveau (Colwell & Beitz, 2007). In der Vergangenheit traten Stenosen typischerweise früh in der postoperativen Phase auf, wenn die chirurgische Technik unzureichend war (auf Faszienniveau oder an der Haut) oder wenn sie nicht richtig ausgereift waren (Hampton, 1992). Aufgrund der Verbesserung der chirurgischen Technik wird die Stomstenose selten früh, sondern eher spät im Genesungsprozess, >30 Tage nach der Operation, in der Regel als Folge der mukokutanen Separation, der Stomanekrose oder der Retraktion des Stomas gesehen. Während der Heilung verengt die Bildung von Granulationsgewebe um das Stoma das Lumen. Andere Ursachen für eine Stomavenge sind chronische Erkrankungen (Morbus Crohn oder Tumor), übermäßige Narbenbildung aufgrund von Instrumenten (Dilatation) oder chronische Entzündungen (peristomale irritative Dermatitis oder Hyperplasie) (Colwell, 2004; Hampton, 1992).
Die Inzidenz der Stomavenge liegt zwischen 2 % und 23 %. Von 316 untersuchten Patienten wiesen 10,2 % eine Stenose auf (Cheung, 1995). In einer retrospektiven Studie von 150 permanenten End-Ileostomien fanden Leong und Mitarbeiter (1994) 23 % mit Stenose. Pittman et al. (2014) identifizierten 5% in ihrer Studie mit 71 Stomapatienten, und Porter et al. (1989) berichteten über eine Stenoserate von 11%. In einer retrospektiven Studie von 1.616 Krankenakten aus den Jahren 1976 bis 1995 von Patienten, die eine Stomachirurgie erhalten hatten, berichteten Park et al. (1999), dass 34% Stomakomplikationen entwickelten, von denen 72% spät (mehr als 30 Tage postoperativ) auftraten. Die häufigsten Spätkomplikationen waren peristomale irritative Dermatitis (6%), Prolaps (2%) und Stenose (2%) (Park et al., 1999). Schließlich wurde in einer 3-Jahres-Retrospektivstudie von 164 Patienten, bei denen eine Operation zu einem Stoma führte, bei 17 % eine Stenose festgestellt (Duchesne et al., 2002).
Vorstellung
Das Erscheinungsbild einer stenotischen Stomaöffnung erscheint klein (Abb. 16-4). Oft berichtet der Patient mit einem fäkalen Stoma über Schmerzen bei der Stomaentleerung, kleinen, bandförmigen Stuhl oder umgekehrt über Verstopfung, gefolgt von großen, explosiven Entleerungen, laut mit übermäßigen Blähungen. Patienten mit Urostomie können über häufige Harnwegsinfektionen, projektilartigen Urinstrahl und/oder Flankenschmerzen berichten (Colwell, 2004).
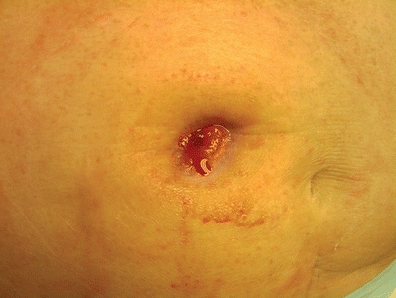
Abbildung 16-4. Stoma-Stenose.
Beurteilung
Die Beurteilung eines stenotischen Stomas wird am besten mit einem behandschuhten, geschmierten Finger durchgeführt, um die Größe und Beweglichkeit der Haut- und Faszienringe zu beurteilen. Wenn ein Finger aufgrund einer schweren Striktur nicht in die Stomaöffnung eingeführt werden kann, kann eine retrograde Kontrastmitteluntersuchung durch einen kleinen Gummikatheter durchgeführt werden (Colwell, 2004).
CLINICAL PEARL
Bei der Beurteilung des Stomas mit einer digitalen Untersuchung erklären Sie dem Patienten, dass das Stoma keine Nerven enthält, die Schmerzen verursachen könnten, aber wenn er Druck verspüren sollte, soll er es Ihnen mitteilen, damit Sie die Untersuchung abbrechen können.
Behandlung
Die Behandlung einer leichten Stenose eines fäkalen Stomas kann eine rückstandsarme Ernährung, Stuhlweichmacher oder eine hohe Flüssigkeitszufuhr beinhalten. Die Stomadilatation durch allmähliches und schrittweises Einführen eines Dilatators in das Stoma war in der Vergangenheit eine gängige Praxis, aber es gibt nur wenige Belege in der Literatur, die diese Praxis unterstützen. Es wurde jedoch berichtet, dass eine chronische Dilatation potenziell eine Stomasternose verursachen kann (Hampton, 1992). Die Stomadilatation kann zur vorübergehenden Unterstützung der Evakuierung eingesetzt werden, wird aber nicht als langfristige Praxis empfohlen. In den schwersten Fällen ist eine Operation gerechtfertigt. Dies kann bedeuten, dass das Stoma lokal von der peristomalen Haut befreit wird oder dass eine Laparotomie/Laparoskopie durchgeführt und das Stoma neu angelegt wird.
Stomaprolaps
Etiologie/Häufigkeit
Stomaprolaps ist die Ausdehnung des Darms durch das Stoma (Colwell & Beitz, 2007). Ein Prolaps des Stomas kann aus verschiedenen Gründen auftreten: erhöhter Druck im Bauchraum, Adipositas, die Stomaöffnung in der Bauchwand ist zu groß oder das Stoma wurde außerhalb des Rektusmuskels angelegt (Weideman et al., 2012).
Alle Stomata können einen Prolaps erleiden, und die Berichte über die Häufigkeit variieren. Ein Stomaprolaps wird häufig bei Schlaufenkolostomien gesehen, und das distale Glied ist überwiegend betroffen (Shellito, 1998; Gordon et al., 1998). Cheung (1995) berichtete, dass 6,8 % bei 156 Endsigmoid-Kolostomien einen Prolaps entwickelten. In einer Studie an 130 Probanden mit einer End-Kolostomie über einen Zeitraum von 6 Jahren traten bei 4% ein Stomavorfall auf (Porter et al., 1989). Ein Stomaprolaps wird häufig bei Kindern beobachtet (Franchini et al., 1983; Steinau et al., 2001). In einer Studie mit 144 Säuglingen mit anorektalen Fehlbildungen war die Inzidenz des Stomaprolapses bei denjenigen mit Schlingenkolostomien höher als bei denjenigen mit geteilten Kolostomien, nämlich 17,8 % bzw. 2,8 % (p = 0,005) (Oda et al., 2014). Chen et al. (2013) führten eine Meta-Analyse durch, die fünf randomisierte kontrollierte Studien und sieben nicht-randomisierte Studien mit insgesamt 1.687 Patienten umfasste und die Ergebnisse von temporären Ileostomien mit denen von temporären Kolostomien verglich. Sie fanden eine geringere Inzidenz von Stomaprolaps bei temporären Ileostomie-Patienten im Vergleich zu temporären Kolostomie-Patienten sowohl in randomisierten Kontrollstudien als auch in nicht-randomisierten Studien (RR 0,15, 95% CI: 0,04 bis 0,48, p = 0,001 bzw. RR 0,26, 95% CI: 0,10 bis 0,67, p = 0,005) (Chen et al., 2013). In einer systematischen Überprüfung der Literatur in Bezug auf Stomakomplikationen nach radikaler Zystektomie und ilealen Conduit-Diversionen wurde ein Stomaprolaps bei 1,5 % bis 8 % im Mittel 2 Jahre nach der Operation festgestellt (Szymanski et al., 2010). Es wurde berichtet, dass bis zu 50 % der Patienten mit prolabiertem Kolostoma auch eine parastomale Hernie hatten (Kim & Kumar, 2006).
Präsentation
Ein prolabiertes Stoma kann sich in verschiedenen Schweregraden und Längen des Stomavorfalls präsentieren (Abb. 16-5). Die Länge des prolabierten Stomas ist ausschlaggebend für die Behandlung. Je größer die Länge des Prolapses ist, desto höher ist die Wahrscheinlichkeit eines Stomaödems, eines Traumas und einer Ischämie. Wenn das Stoma ödematös und abhängig wird, nimmt es eine tiefrote Farbe an (Gefäßerweiterung). Bei einem sehr ausgeprägten (5 bis 13 Zoll) Prolaps ist das Stoma anfällig für Traumata. Bei der Pflege ist darauf zu achten, dass Reibung, Rissbildung oder Druck auf das Stoma vermieden werden. In extremen Situationen kann die Blutversorgung des Stomas beeinträchtigt werden und eine Stomaischämie auftreten.
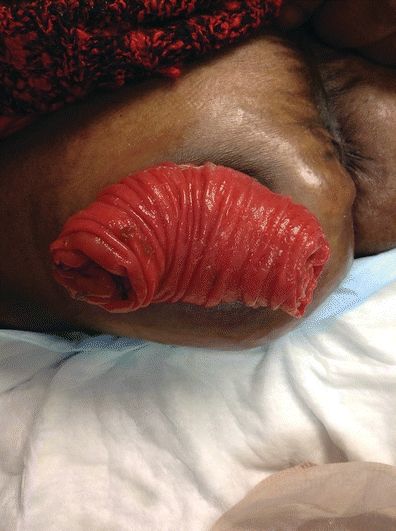
Abbildung 16-5. Stomaprolaps.