Seröse PED bei AMD
Die retinale Pigmentepithelabhebung (PED) gehört zum klinischen Spektrum der altersbedingten Makuladegeneration (AMD).
In der Literatur wurden jedoch verschiedene Arten von PED beschrieben, die entweder mit der AMD in Verbindung gebracht wurden oder nicht.
Die seröse PED ist definiert als ein Bereich mit scharf abgegrenzter, kuppelförmiger seröser Erhebung des retinalen Pigmentepithels (RPE). Die Histopathologie der serösen PED ist konsistent mit der Ablösung der RPE-Basalmembran, zusammen mit dem darüber liegenden RPE von der verbleibenden Bruchschen Membran aufgrund von Flüssigkeitsansammlungen(1).
Das Vorhandensein dieser Läsion ist ein negativer prognostischer Faktor für die AMD in Bezug auf die Sehschärfe Ergebnisse.
Auch wenn es bisher keine eindeutige therapeutische Indikation gibt, ist die frühzeitige Erkennung der serösen PED wichtig für die Prognose und das Management von Patienten mit AMD.
Bei der AMD kann die seröse PED entweder mit choroidalen Gefäßneubildungen (choroidale Neovaskularisation – CNV) assoziiert sein oder nicht. Der vaskularisierte Typ ist jedoch bei weitem der am häufigsten beobachtete.
Es wurden verschiedene Theorien zur Beziehung zwischen seröser PED und CNV vorgeschlagen.
Um die Pathogenese zu erklären, stellte Gass die Theorie auf, dass neue Gefäße aus der Aderhaut (Typ 1 Neovaskularisation (NV)) innerhalb der Bruch’schen Membrandicke wachsen, die aktiv lecken, den hydrostatischen Druck erhöhen und eine Ablösung des RPE unter den weniger haftenden Schichten verursachen(2).
Dieses Konzept wurde später durch den Nachweis unterstützt, dass die Entwicklung der CNV mit entzündlichen Mechanismen einhergeht, die die Bruch’sche Membran weiter schädigen und die Ablösung des RPE von der inneren kollagenen Schicht unterstützen(3-5).
Wenn das Wachstum neuer Gefäße von der inneren Netzhaut ausgeht, in jüngerer Zeit als Typ-3-NV beschrieben und auch als retinale angiomatöse Proliferation (RAP) bezeichnet, wurde die Hypothese aufgestellt, dass die sehr häufig auftretende seröse PED-Bildung mit der RPE-Invasion durch den neovaskulären Komplex zusammenhängen kann6-8).
Im Gegensatz dazu beobachteten andere Autoren, dass das Vorhandensein von PED einen vorbestehenden Zustand darstellen kann, der das CNV-Wachstum durch eine weitere Schädigung der Bruch’schen Membran begünstigen kann, was Ausdruck der gleichen laufenden Erkrankung ist(9,10).
Obwohl die Pathogenese der PED nicht vollständig geklärt ist, scheint nach diesen Studien die Entstehung der NV ein zentrales Moment zu sein.
Bei der Fundusuntersuchung erscheint die seröse PED als runder oder ovaler, deutlich kuppelförmiger Bereich mit regelmäßiger Ablösung des RPE und der darüber liegenden neurosensorischen Netzhaut, mit gelber bis oranger Farbe und glatter Oberfläche. Die Ränder sind typischerweise scharf abgegrenzt; fokale RPE-Atrophie und Pigmentfiguren werden häufig beobachtet(9,11).
Das gleichzeitige Vorhandensein von NV kann jedoch eine Vielzahl von assoziierten ophthalmoskopischen Aspekten hervorrufen, wie z. B. hämorrhagische und exsudative Komponenten, Bereiche mit unregelmäßigen Erhebungen des RPE und seröse Ablösungen der umgebenden Neuroretina.
Die Darstellung der NV vom Typ 1 am Rand der PED kann variieren, meist ergibt sich ein reniformer oder gekerbter Aspekt oder eine flächige RPE-Abhebung(12).
Seröse PED können mittels Fluoreszeinangiographie (FA), Indocyaningrün-Angiographie (ICGA) und optischer Kohärenztomographie (OCT) dargestellt werden.
FA stellt jedoch den Goldstandard für die Diagnose der serösen PED dar.
Bei der FA zeigt die seröse PED klassischerweise eine frühe gleichmäßige Hyperfluoreszenz der gesamten Läsion, die im Vergleich zur Hintergrundfluoreszenz leicht verzögert ist und im Verlauf der Untersuchung zunehmend heller wird (Pooling).
Die Hyperfluoreszenz der serösen PED ändert sich typischerweise nicht in Größe oder Form während der angiographischen Phasen.
FA kann auch das Vorhandensein von NV zeigen, die normalerweise als Typ 1 NV mit seröser PED assoziiert sind, wie Bereiche mit undeutlicher später subretinaler Färbung, die deutlicher sind, wenn sie sich am Rand der RPE-Abhebung befinden oder der „Kerbe“ entsprechen(11).
Auf das Vorhandensein von NV kann auch durch das Vorhandensein einer hämorrhagischen Komponente der PED, dem von Gass beschriebenen dunklen Meniskus, geschlossen werden(12).
Eine genauere Lokalisierung der neovaskulären Komponente kann jedoch mit digitaler ICGA erreicht werden. Das Indocyaningrün-Molekül hat biophysikalische Eigenschaften, die es im Gegensatz zu Fluorescein nützlich machen, um die Anatomie der Gefäße durch RPE, Blut und trübe Exsudation zu verdeutlichen.
Im Detail ermöglicht ICGA, das Vorhandensein und die Art der neuen Gefäße, die mit einer serösen PED assoziiert sind, besser abzugrenzen, und gilt aus diesem Grund als grundlegendes Werkzeug bei der Behandlung dieser Krankheit(13-15).
Bei der ICGA erscheint die seröse PED als eine hypofluoreszierende Läsion mit scharf abgegrenzten Rändern, die während aller Phasen der Untersuchung konstant hypofluoreszierend bleibt(16).
Wenn die neuen Gefäße nicht vorhanden sind, sind keine Anzeichen von lokalisierten hyperfluoreszierenden Bereichen nachweisbar; der Umriss der PED ist scharf rund und sie wird daher als reine seröse PED betrachtet.
Bei AMD-Patienten fand Yannuzzi eine Inzidenz von 4% nicht vaskularisierter PED unter serösen PED(15).
Wenn die neovaskuläre Komponente vorhanden ist, wurde der Begriff vaskularisierte PED vorgeschlagen(15),.die etwa 24 % der neu diagnostizierten exsudativen AMD ausmacht(17).
Neue Gefäße bei seröser PED sind in verschiedenen Subtypen vertreten.
Die Hochgeschwindigkeits-Videoangiographie mit dem Scanning-Laser-Ophthalmoskop erweist sich als wertvolles Hilfsmittel, das dem Augenarzt erlaubt, die neuen Gefäßmuster und ihr angiographisches Verhalten zu identifizieren(18).
Die Erkennung der verschiedenen Arten von NV durch die Unterscheidung der angiographischen Befunde ist zwingend erforderlich für den unterschiedlichen natürlichen Verlauf, die visuelle Prognose und das unterschiedliche Ansprechen auf die Behandlung der drei Hauptarten von neuen Gefäßen, die mit seröser PED bei AMD assoziiert sind.
Die häufigste Art von neuen Gefäßen, die mit seröser PED assoziiert sind, sind diejenigen, die von der Aderhaut unterhalb der RPE-Monolage auftreten(15-,17).
Diese neuen Gefäße wurden kürzlich als Typ 1 NV klassifiziert und sind bei weitem der häufigste Typ von NV bei AMD(19)(Abbildung 1).

Abbildung 1 – Vaskularisierte PED mit Typ 1 NV. (A) FA, (B)ICGA und (C) OCT.
In der ICGA ist in den frühen Phasen die aus der Aderhaut entspringende NV-Zufuhrarterie und anschließend die drainierende Vene zu erkennen.
Zugleich ist das Kapillarnetz der Neovaskularisationsmembran zu erkennen.
Im Gegensatz zu Fluorescein leckt Indocyaningrün nur geringfügig und die NV-Hyperfluoreszenz ist in der Regel minimal, mit Ausnahme einiger Fälle, die eine intensive Leckage zeigen und als sehr aktive neue Gefäße gelten.
Häufig kann in den späten Phasen ein gut definierter Bereich mit milder Hyperfluoreszenz, der dem NV-Netzwerk entspricht, erkennbar sein.
Der zweite Typ neuer Gefäße, die eine seröse PED komplizieren, sind die RAP(7,20-22), auch als Typ 3 NV(19) bezeichnet.
Diese vaskulären Läsionen können, wie von verschiedenen Autoren berichtet, die äußere Netzhaut und das RPE betreffen, und zwar über eine Progression, von der angenommen wird, dass sie aus dem Netzhautkreislauf und/oder der Aderhaut stammt.
Die ICGA zeigt typischerweise das Vorhandensein eines „Hot-Spots“, der auf die frühe Hyperfluoreszenz des intraretinalen neovaskulären Komplexes zurückzuführen ist, die sich im Verlauf der Angiographie erhöht, mit einer intensiven Leckage in den späten Phasen.
Seine Helligkeit wird durch die umgebende Hypofluoreszenz der darunter liegenden PED verstärkt (Abbildung 2).
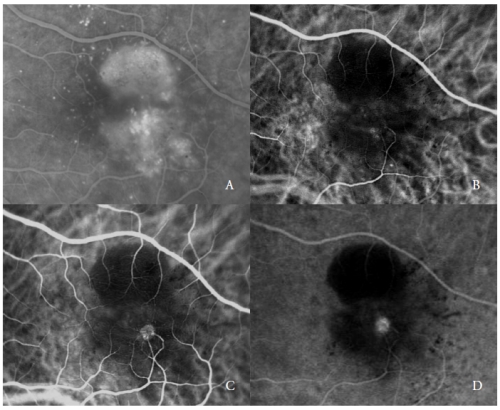
Abbildung 2 – Vaskularisierte PED mit Typ 3 NV (RAP). FA (A) und ICGA frühe (B) und späte Phasen (C und D).
In den späten Stadien der Erkrankung ist der choroidale neovaskuläre Komplex typischerweise mit einem oder mehreren retinalen Gefäßen verbunden, die gewunden und dilatiert erscheinen(7,22,23).
Die NV vom Typ 3 kann einzeln oder multipel sein, ihr Ursprung ist typischerweise extrafoveal, und eine intraretinale Blutung in Korrespondenz zur neovaskulären Läsion wird häufig beobachtet(20).
Der dritte Typ neuer Gefäße, der mit seröser PED bei AMD assoziiert ist, entspricht der polypoidalen choroidalen Vaskulopathie (PCV)(24).
PCV ist eine besondere Form der CNV, die durch das Vorhandensein von orangefarbenen, aneurisierenden, polypenartigen, runden Dilatationen am Rande eines verzweigten Gefäßnetzes choroidalen Ursprungs gekennzeichnet ist.
Obwohl die PCV häufiger Schwarze und Asiaten mittleren Alters betrifft, ist ihr klinisches Spektrum auf Weiße ausgedehnt, wo sie bei 8-13 % der Patienten mit gleichzeitigen AMD-Läsionen gefunden wurde.
In diesen Fällen, wenn die Manifestationen, die sowohl der PCV als auch der AMD zuzuschreiben sind, vorhanden sind, betrachten einige Autoren die PCV als einen Subtyp der CNV bei AMD(24,25).
Hämorrhagische Manifestationen sind bei Patienten mit PCV häufig.
Seröse PED, die mit PCV assoziiert ist, zeigt häufig einen Blutspiegel im unteren Teil der Ablatio.
ICGA ist die modernste Untersuchung, um die typischen Merkmale der beiden Gefäßkomponenten zu unterscheiden.
Das vaskuläre Netzwerk ist durch das Vorhandensein einer oder mehrerer aneurismatischer Läsionen gekennzeichnet, die in den frühen Phasen eine helle Fluoreszenz zeigen, gefolgt in den späten Phasen von einer für diese Erkrankung typischen Auslöschung des Farbstoffs, dem sogenannten „Wash-out“ (Abbildung 3).
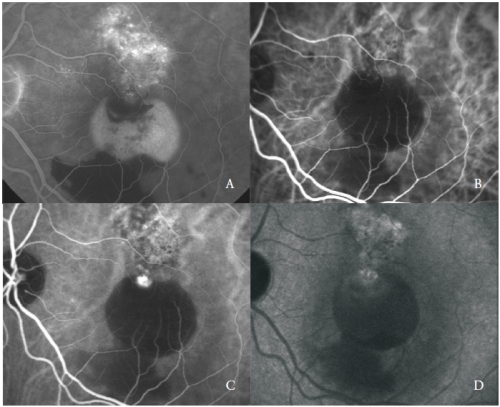
Abbildung 3 – Vaskularisierte PED mit PCV: FA (A) und frühe (B), mittlere (C) und späte (D) Phasen der ICGA.
Allerdings können einige polypöse Strukturen aktiv auslaufen und zeigen eine späte Färbung ihrer Wände und der umgebenden Exsudation.
Die polypoiden Läsionen befinden sich in der Regel am Rand der serösen PED(26).
Die Erkennung dieser Läsionen ist kritisch, da sich ihr klinischer Verlauf, ihre Prognose und ihr Ansprechen auf die Behandlung von den anderen neovaskulären AMD-Subtypen unterscheiden.
OCT liefert Bilder, die eine exakte Korrelation mit den angiographischen Befunden erlauben.
In Querschnitts-OCT-Scans erscheint die seröse PED als optisch leere kuppelförmige Erhebung des äußeren hochreflektierenden Bandes – des RPE, das sich steil von der Bruchschen Membran abhebt(26).
Die darüber liegende Netzhaut, die in der Regel an der bullösen PED haftet, kann an den Rändern der Läsion leicht vom darunter liegenden RPE abgelöst sein.
Bei vaskularisierter PED kann das OCT weitere Zusatzinformationen liefern(28).
Die tomographischen Schnitte, die mit FA und ICGA im Bereich der CNV geführt werden, zeigen eine glattere Anhebung des RPE, kontinuierlich mit der serösen Ablösung, mit einer tieferen Rückstreuung, bedingt durch das Vorhandensein des fibrovaskulären Gewebes.
Hyporeflektive Bereiche mit homogenen optischen Leerräumen, die auf Flüssigkeitsansammlungen hinweisen, sind häufig in den intraretinalen und subretinalen Räumen vorhanden(29).
Intraretinale optische Leerräume sind stärker ausgeprägt, wenn die seröse PED mit einer NV vom Typ 3, insbesondere mit zystischer Form, assoziiert ist (Abbildung 4).
Durch die Positionierung der Scanlinie entsprechend dem „Hot-Spot“ wird die neovaskuläre Anomalie als dichte oder hyperreflektive präepitheliale Zone in den inneren Netzhautschichten dargestellt, in der die äußeren hyperreflektierenden Schichten nicht mehr nachweisbar sind(30).
Das RPE in der Nähe dieser Läsion zeigt häufig Effraktionen oder Unterbrechungen in seiner hyperreflektierenden Schicht(31).
Die topographische Messung der Netzhaut ergibt eine erhöhte Netzhautdicke.
In Augen mit seröser PED und PCV zeigen die polypoiden Läsionen eine scharfe Vorwölbung des RPE, ähnlich wie bei der PED, aber steil abfallend.
Die Polypenhöhle, meist optisch leer, grenzt an eine unregelmäßige RPE-Erhebung, Ausdruck der okkulten neovaskulären Komponente der Läsion(32,33).
Subretinale und intraretinale Flüssigkeit, beobachtet als hypofluoreszierende optisch leere Bereiche, stehen in Zusammenhang mit der PCV-Aktivität (Abbildung 4-B).
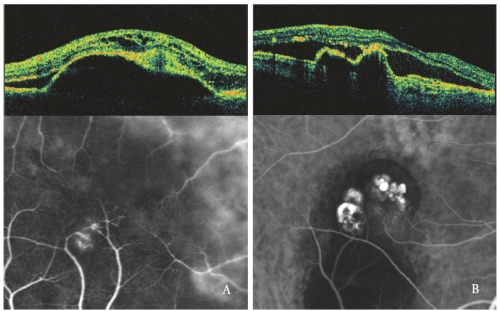
Abbildung 4 – Typ 3 NV (RAP) (links) und PCV (rechts): OCT- und ICGA-Muster.
Die jüngste Einführung der OCT-Angiographie (OCT-A) hat es möglich gemacht, die Perfusion der verschiedenen Netzhautschichten abzubilden, ohne Injektion des Farbstoffs und unter Nutzung des endoluminalen Flusses als intrinsischen Kontrast.
Abbildung 5 zeigt ein Beispiel, wie OCT-A das choroidale Netzwerk in einem Fall von PCV abbildet.
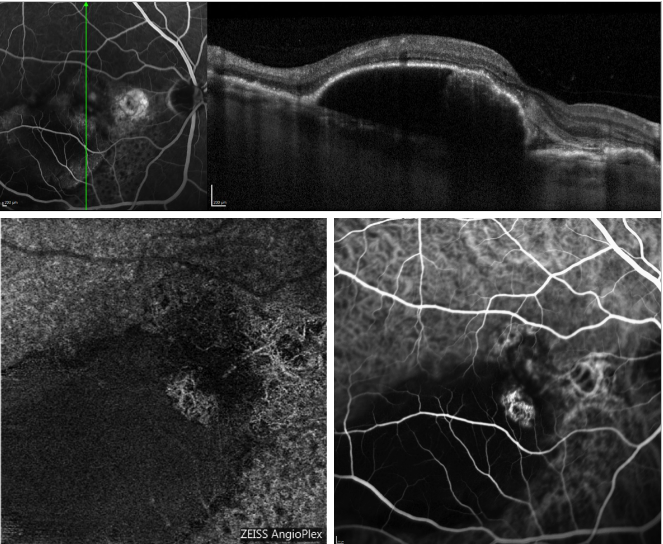
Abbildung 5 – Seröse PED und rezidivierende PCV (FA, OCT, ICGA und OCT-A). Oben: OCT-Scan, der gleichzeitig mit FA aufgenommen wurde; unten: Aussehen des Polypenprofils auf OCT-A (links) und ICGA (rechts).
Die statische Natur dieser Untersuchung und das Vorhandensein möglicher Artefakte sind jedoch wichtige Einschränkungen, die berücksichtigt werden sollten.
Bei seröser PED kann die Verschattung durch den Verlust der Signalübertragung in der Nähe der PED die Erkennung des CNV-Komplexes auf OCT-A erschweren (Abbildung 6).
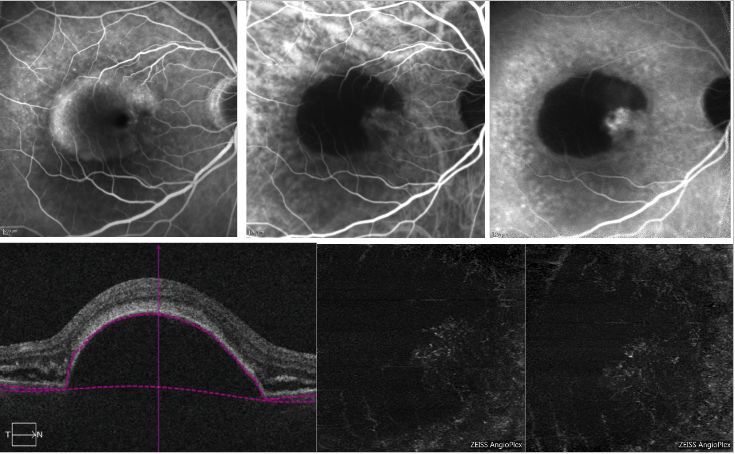
Abbildung 6 – Vaskularisierte PED und seröse PED mit Typ 1 NV (FA, ICGA und OCT-A) . Oben: FA (links) zeigt Farbstoff-Pooling aufgrund des Vorhandenseins einer serösen PED; ICGA (oben Mitte und rechts) zeigt ein neovaskuläres Netz am Rand der PED (Kerbe); unten: OCT-A liefert keine eindeutige Darstellung des neovaskulären Netzes.
Der natürliche Verlauf einer serösen PED hängt davon ab, ob eine neovaskuläre Komponente vorhanden ist oder nicht(34).
Bei der reinen serösen PED kommt es in der Regel zu einer langsamen Vergrößerung der Läsion mit einer minimalen Progression des Sehverlustes über einen langen Zeitraum (Monate oder Jahre).
Viele können jedoch im weiteren Verlauf Neovaskularisationen entwickeln, die den Zustand verschlimmern(35).
Der Verlauf einer vaskularisierten PED kann variieren und hängt mit der Art der neuen Gefäße zusammen.
Die häufigste akute Komplikation der PED ist das Einreißen des RPE(36-39).
Sie tritt meist am Rand der PED auf, an der Schnittstelle zwischen dem abgelösten und dem anhaftenden RPE.
Klinisch erscheint der RPE-Einriss oder -Riss als gut definierter Bereich der kahlen Aderhaut, der an einen dunkleren, hyperpigmentierten, runzeligen Bereich angrenzt, der dem abgerissenen RPE-Hügel entspricht(40,41).
Das abgerissene RPE rollt in der Regel auf die CNV zu, und seine Neigung zum Einreißen kann durch die Beobachtung von Prä-Riss-Merkmalen vorhergesagt werden, wie z. B. eine Zunahme der Größe und eine Veränderung der Form, das Vorhandensein von kleinen Löchern an den Rändern der PED, das Vorhandensein von Blutungen oder subretinaler Flüssigkeit, aber die bemerkenswertesten Aspekte sind die unregelmäßige Füllung der PED, die in der FA sichtbar ist, Höhe der PED > 580 nm, Dauer > 4.5 Monate, hyperreflektive radiale Linien in der Nahreflexionsbildgebung, kleinerer Anteil vaskularisierter PED und Anti-VEGF-Therapie (Anti-Vascular Endothelial Growth Factor)(42-46).
RPE-Risse treten entweder spontan oder nach einer Behandlung auf, formal nach Laser-Photokoagulation, photodynamischer Therapie und intravitrealer Injektion von Steroiden oder Anti-VEGF-Wirkstoffen(47- 58).
Die genaue Pathogenese von RPE-Rissen ist nur unzureichend verstanden.
Bezüglich des natürlichen Verlaufs der PED wurde die Hypothese aufgestellt, dass tangentiale Scherkräfte in der PED den Riss der RPE-Basalmembran am Rand der Ablösung verursachen können; wahrscheinlicher ist jedoch, dass er das Ergebnis mehrerer Variablen ist, wobei das Vorhandensein einer CNV eine große Rolle spielt.
Für RPE-Risse, die nach der Behandlung auftreten, wurden mehrere kausale Zusammenhänge berichtet, darunter die durch die Photokoagulation erzeugte Hitze, der abrupte Anstieg der intra-PED-Flüssigkeit, eine Kontraktion der assoziierten CNV und die gleichzeitige plötzliche Auflösung der Sub-RPE-Flüssigkeit.
Das kombinierte Vorhandensein einer vitreomakulären Traktion und die Deformation des Globus aufgrund des mechanischen Traumas durch die Nadel wurden ebenfalls als ursächliche Faktoren berichtet(59).
Nach Rissen des RPE klagt die Mehrzahl der Patienten über eine plötzliche starke Sehverschlechterung.
In einem kleinen Prozentsatz der Augen, bei denen der Riss die Fovea verschont, können die Patienten eine vorübergehende Erhaltung einer guten Sehfunktion erleben(60).
Langfristig führt jedoch das Fortschreiten einer subretinalen Narbe zu einer starken Sehverschlechterung. Bei der Prognose der serösen PED muss auch das hohe Risiko einer beidseitigen Beteiligung berücksichtigt werden(61).
Die Behandlung der serösen PED, assoziiert oder nicht mit CNV, stellt seit jeher eine Herausforderung dar und bisher gibt es keine empfohlenen Leitlinien für deren Management.
Reine seröse PEDs wurden in der Vergangenheit mit Laser-Gitter- oder Streu-Photokoagulation behandelt, allerdings mit enttäuschenden Ergebnissen(61).
Die Behandlung seröser PEDs, assoziiert oder nicht mit CNV, war schon immer eine Herausforderung und es gibt bisher keine empfohlenen Leitlinien für ihr Management. Reine seröse PEDs wurden in der Vergangenheit mit Laser-Gitter- oder Streu-Photokoagulation behandelt, mit enttäuschenden Ergebnissen(62).
Es wurden keine anderen Ansätze zur Behandlung dieser Läsionen versucht.
Wenn ein neovaskuläres Netz vorhanden ist, konzentrierte sich die Behandlung der serösen PED auf das CNV-Management. Da vaskularisierte PED jedoch nie in die großen randomisierten kontrollierten Studien aufgenommen wurden, müssen wir die Behandlungsentscheidung auf der Grundlage kleiner veröffentlichter Serien treffen, die oft retrospektiv sind und verschiedene therapeutische Ansätze beinhalten.
Jetzt, in der Ära der Anti-VEGF-Therapie, scheinen alle bisher eingesetzten Behandlungen unbefriedigend.
Die Laserphotokoagulation ist weit verbreitet und hat möglicherweise immer noch eine begrenzte Indikation, wenn eine ICGA-gut definierte CNV entfernt vom abgelösten RPE liegt(63).
Die photodynamische Therapie (PDT) mit Verteporfin allein hat sich als schädlich erwiesen, da sie das Risiko von RPE-Rissen, Blutungen und plötzlichem Visusabfall erhöht(39,48,49,64) (Abbildung 7).
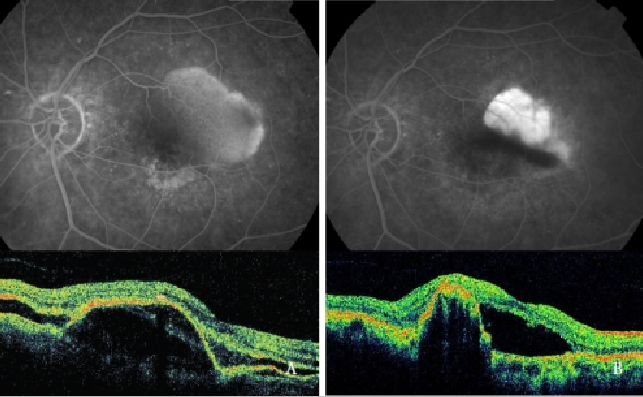
Abbildung 7 – Vaskularisierte PED mit CNV (Typ 1 NV) vor (links) und nach (rechts) PDT: RPE-Riss (FA und OCT).
Die PDT in Kombination mit der intravitrealen Injektion von Triamcinolonacetonid (IVTA) hat sich jedoch als potenziell geeignet erwiesen, die Sehschärfe zu stabilisieren und Rezidive zu reduzieren(65).
Dennoch hat die hohe Komplikationsrate (Katarakt und Glaukom) den Einsatz von intravitrealem Triamcinolon reduziert.
Nach den ermutigenden Ergebnissen, die mit der intravitrealen Anti-VEGF-Therapie bei der Behandlung der okkulten CNV erzielt wurden, wurde die Anwendung der Anti-VEGF-Behandlung auf vaskularisierte PED ausgedehnt – mit enttäuschenden Ergebnissen(66-69).
Beide, akute Komplikationen und schlechtes anatomisches Ansprechen auf die Behandlung, entkräften häufig unsere Versuche, die Läsion zu heilen. RPE-Risse und subretinale Blutungen wurden als Komplikationen bei intravitrealen Ranibizumab- und Bevacizumab-Behandlungen berichtet(51-57).
Darüber hinaus spricht die sub-RPE-Flüssigkeit kaum auf die Anti-VEGF-Therapie an, möglicherweise aufgrund der veränderten Hydroleitfähigkeit der Bruchschen Membran(69).
In einer retrospektiven Fallserie von 328 Patienten, die mit Bevacizumab, Ranibizumab, Pegaptanib bzw. PDT+IVTA behandelt wurden, berichteten die Autoren nach einer mittleren Nachbeobachtungszeit von 42,4 Wochen von einer signifikanten Stabilisierung der Sehschärfe in jeder Gruppe, besser in der mit Bevacizumab und Ranibizumab im Vergleich zu den anderen beiden, und einer Gesamt-RPE-Risshäufigkeit von 12.5%.
Allerdings schlussfolgern sie, dass mit diesen Behandlungen nur eine teilweise Rückbildung der Läsionen erreicht werden kann und das Risiko von RPE-Rissen nicht vermieden wird(69).
Eine weitere retrospektive Studie(58). überprüfte die Ergebnisse von Patienten mit vaskularisierter PED, die mit PDT allein, PDT kombiniert mit IVTA oder intravitrealen Anti-VEGF-Injektionen allein (Bevacizumab oder Ranibizumab) behandelt wurden und zeigte bessere funktionelle Ergebnisse für die Anti-VEGF-Behandlungsgruppe.
Außerdem zeigte sich in dieser Serie bei Typ 1 NV mit vaskularisierter PED im Vergleich zu Typ 3 NV neben einer besseren Sehschärfe bei Studienbeginn ein höheres Risiko für einen akuten RPE-Riss nach der Behandlung(58).
In einer aktuellen prospektiven Studie(19) führte die Behandlung von PED in Verbindung mit subfovealer Typ 1 NV mit intravitrealer Ranibizumab-Injektion und mit einer 3-monatigen Belastungsphase und einer pro re nata-Strategie über eine 24-monatige Nachbeobachtung nur zu Teilergebnissen.
In jüngster Zeit haben mehrere Studien die Wirksamkeit der intravitrealen Aflibercept-Therapie von PED bei AMD untersucht und zeigten ein gutes anatomisches Ansprechen mit Verbesserung oder keiner signifikanten Veränderung der Sehschärfe(70-73).
Außerdem hat sich intravitreales Aflibercept als vielversprechende Behandlung bei PED erwiesen, die gegen eine intravitreale Ranibizumab-Behandlung resistent sind(72-74).
In mehreren Studien wurden Faktoren identifiziert, die das Ansprechen von PED auf eine Anti-VEGF-Behandlung beeinflussen könnten(75-78).
Dirani et al.(75) zeigten, dass eine bessere Visusverbesserung mit einem niedrigeren Ausgangsvisus, dem Vorhandensein von subretinaler Flüssigkeit und RAP verbunden war. Darüber hinaus war in ihrer Serie eine Reduktion der PED mit einer höheren PED bei Studienbeginn, überwiegend seröser PED und der Verwendung von Aflibercept assoziiert.
Cho et al.(76) fanden in einer aktuellen Fallserie heraus, dass eine niedrigere PED-Höhe bei Studienbeginn, PCV oder RAP im Vergleich zur typischen neovaskulären AMD, seröse PED im Vergleich zur fibrovaskulären PED und Aflibercept im Vergleich zu Ranibizumab eine höhere Chance auf eine PED-Resolution während der Anti-VEGF-Behandlung der PED haben.
In einer kürzlich durchgeführten Post-hoc-Analyse einer randomisierten kontrollierten Phase-III-Studie(77) wurde jedoch gezeigt, dass 24 Monate nach Beginn der Anti-VEGF-Behandlung bei etwa der Hälfte der Patienten, die zu Beginn der Behandlung eine PED aufwiesen, eine vollständige Auflösung der PED zu beobachten war, unabhängig vom PED-Status und der Körpergröße zu Beginn der Behandlung.
Kürzlich wiesen Chen et al.(78) auf die Bedeutung der Differenzierung von Augen mit RAP hin, da diese im Vergleich zu PED mit Typ 1 NV bessere anatomische und funktionelle Ergebnisse mit weniger Injektionen aufweisen.
In Zukunft werden neue Kombinationstherapien und neue therapeutische Strategien zusammen mit der Identifizierung neuer klinischer Biomarker für das Ansprechen auf die Behandlung dazu beitragen, die Prognose der von vaskularisierter PED betroffenen Patienten zu verbessern.