Pravin U. Dugel, MD
Phoenix
Das pseudophake zystoide Makulaödem wurde erstmals 1953 von A. Ray Irvine Jr, MD,1 im Jahr 1953 beschrieben und von J. Donald M. Gass, MD, im Jahr 1969 weiter erläutert.2 Dr. Gass beschrieb, dass die höchste Inzidenz sechs Wochen postoperativ auftrat, und wies darauf hin, dass es einen Unterschied zwischen angiographischem und klinisch signifikantem PCME gibt, da nur wenige Patienten über vermindertes Sehvermögen klagten. Klinische PCME ist nun definiert als eine Snellen-Sehschärfe von 20/40 oder schlechter. Häufige Symptome sind verminderte Sehschärfe und Kontrastempfindlichkeit sowie Metamorphopsie.
Obwohl die Einführung der Phakoemulsifikation anstelle der extrakapsulären Kataraktentfernung die PCME-Rate von 16 bis 24 Prozent gesenkt hat,3 hat die zunehmende Verwendung von multifokalen Intraokularlinsenimplantaten zu höheren Erwartungen der Patienten geführt. Aufgrund des Designs dieser neuen Implantate, die von Natur aus die Kontrastsensitivität vermindern, kann selbst eine leichte PCME zu einer erheblichen Beeinträchtigung der Sehqualität und der Patientenzufriedenheit führen. Wenn die Food and Drug Administration die Verwendung einer neuen IOL genehmigt, gibt sie an, dass die „akzeptable Rate“ von klinisch signifikanter PCME weniger als 5 Prozent betragen sollte. Angesichts der sich schnell entwickelnden Chirurgie- und IOL-Technologie muss „klinisch signifikante“ PCME möglicherweise neu definiert werden, um sowohl den visuellen Anforderungen als auch den Erwartungen des Patienten gerecht zu werden.
Inzidenz
Die Inzidenz von PCME nach Phakoemulsifikation bei unkomplizierten, risikoarmen Patienten kann zwischen 2 und 12 Prozent variieren.4,5 Es wird angenommen, dass die höchste Inzidenz sechs Wochen nach der Operation auftritt.2 Zu den Faktoren, die die Entwicklung eines PCME in dieser Population vorhersagen, gehören eine Vorgeschichte von retinalen Venenverschlüssen, das Vorhandensein einer epiretinalen Membran und die präoperative Einnahme von Prostaglandinen.4 Bei Patienten mit Hochrisikomerkmalen wie Diabetes mellitus oder bei komplizierten Fällen kann die Inzidenz viel höher sein. (Heier JS, et al. Characteristics of patients with CME following phacoemulsification. Präsentiert auf der Jahrestagung der American Academy of Ophthalmology; November 2007; New Orleans, LA.)
Mechanismus
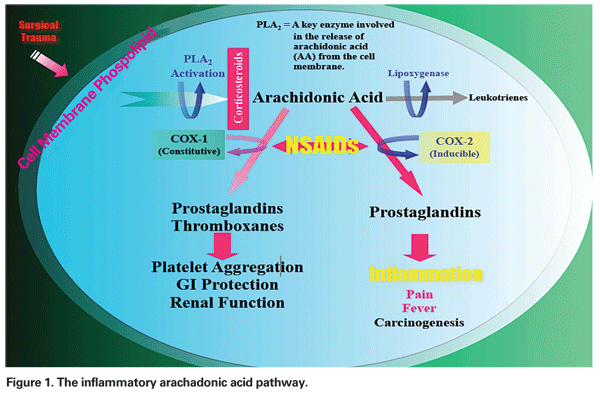
Der Mechanismus, durch den sich PCME entwickelt, kann multifaktoriell sein, mit unterschiedlichen Graden von entzündlichen und mechanischen Komponenten. Die chirurgische Manipulation des vorderen Augenabschnitts löst die Freisetzung von Arachadonsäure aus den Zellmembranen aus, was zur Produktion von Prostaglandinen und Leukotrienen über den Cyclooxygenase (COX)- bzw. Lipoxygenase (LOX)-Weg führt (siehe Abbildung 1). Diese Entzündungsmediatoren erhöhen die Vasopermeabilität und führen so zur Entwicklung von PCME.
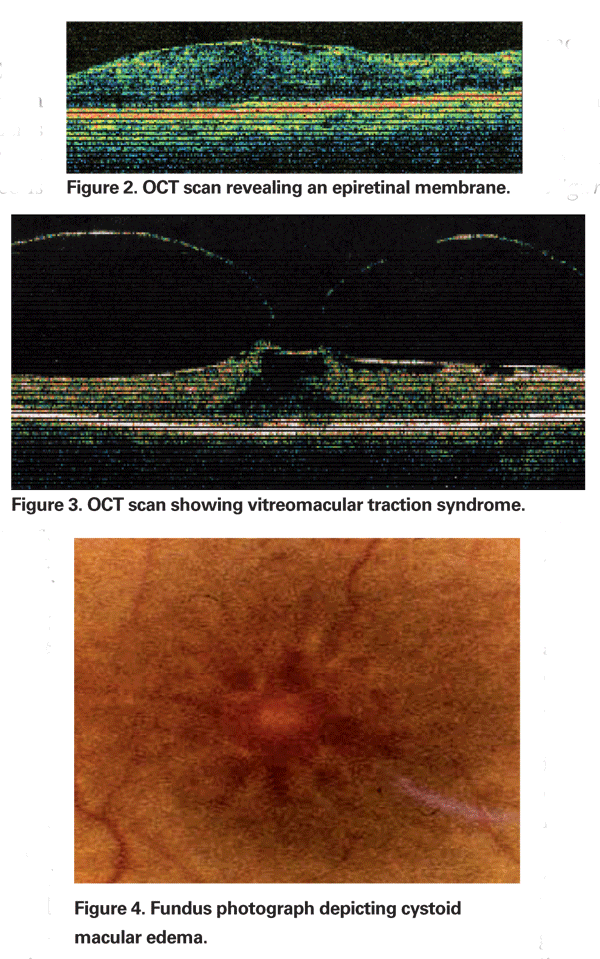
Gelegentlich kann die durch die Kataraktextraktion hervorgerufene Entzündung eine Kontraktion der hinteren Hyaloidfläche verursachen, was zu einer Verformung der parafovealen Kapillaren und einem resultierenden Makulaödem führt. Der zunehmende Einsatz der optischen Kohärenztomographie ist ein wichtiger Bestandteil bei der Beurteilung des PCME geworden. OCT-Bilder sind hilfreich bei der Identifizierung einer mechanischen Komponente des CME, einschließlich vitreomakulärer Traktion oder epiretinaler Membranen (siehe Abbildungen 2 & 3).
In seltenen Fällen von chronischem, refraktärem PCME bei Patienten mit niedrigem Risiko ohne andere erkennbare Ätiologie muss das Auge genau auf zurückgebliebene Linsenfragmente, IOL-Fehlstellung oder das Vorhandensein einer Propionibacterium acnes-Infektion untersucht werden.
Diagnose
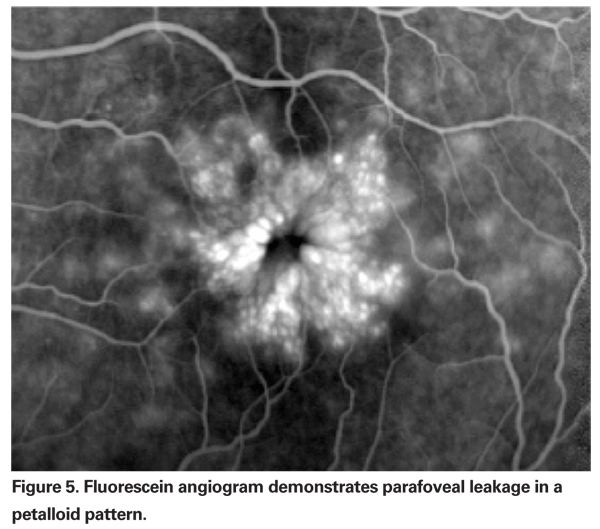
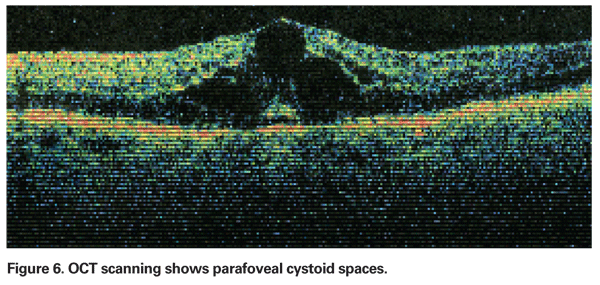
PCME sollte vermutet werden, wenn ein Patient ohne zugrundeliegende Risikofaktoren nach einer Kataraktextraktion über eine Sehverschlechterung oder Metamorphopsie klagt. Klinisch ist ein intraretinales Ödem zu sehen, das in zystenartigen Räumen in einem wabenförmigen Muster um die Fovea herum enthalten ist (siehe Abbildung 4). Im Fluoreszeinangiogramm ist ein petalloides Muster von Leckagen in die parafovealen intraretinalen Räume zu sehen, zusammen mit einer Hyperfluoreszenz des Sehnervenkopfes (siehe Abbildung 5). Das OCT kann diese zystoiden Räume deutlich darstellen sowie die zentrale Makuladicke und das Gesamtvolumen der Makula berechnen (siehe Abbildung 6). Die Vorteile der OCT sind die hohe Sensitivität, die Nicht-Invasivität, die Bereitstellung anatomischer Informationen und die Fähigkeit, Makulaödeme zu quantifizieren, obwohl die Korrelation dieser Werte mit der Sehfunktion fraglich ist.
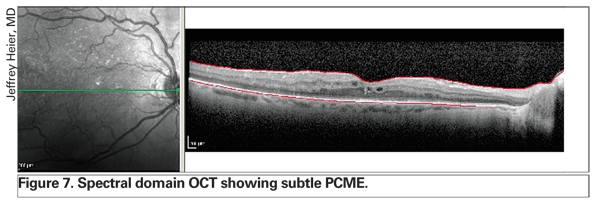
Der Einsatz von OCT revolutioniert das Management von Netzhautödemen. Neuere Technologien, einschließlich des Spektralbereichs-OCT, liefern eine bessere Auflösung und können subtile PCME früher erkennen als die Spaltlampen-Biomikroskopie und die Fluoreszein-Angiographie (siehe Abbildung 7). Darüber hinaus ermöglicht diese verbesserte Instrumentierung dem Kliniker die Unterscheidung zwischen ausschließlich intraretinalen Ödemen und subretinaler oder subpigmentärer Epithelflüssigkeit, was prognostische Informationen liefern kann (siehe Abbildung 8). Mehrere Netzhautspezialisten haben die Erfahrung gemacht, dass das Vorhandensein einer subfovealen Pigmentepithelabhebung eine schlechtere Prognose bedeuten kann.
Prävention
Es gibt mehrere retrospektive Übersichtsarbeiten und prospektive Studien, die den Effekt von prophylaktischen nichtsteroidalen Antirheumatika auf die PCME-Rate bei präoperativer und postoperativer Anwendung. In einem Bericht war eine dreitägige Vorbehandlung mit Ketorolac-Tromethamin (Acular) besser als Tropfen, die eine Stunde vor der Operation verabreicht wurden.6 Im Vergleich zur Behandlung mit postoperativen Kortikosteroiden allein berichtete eine andere Gruppe über eine Verringerung der PCME von 12 Prozent auf 0 Prozent bei einer zweitägigen präoperativen Behandlung mit Diclofenac-Natrium (Voltaren) und einer Kombination aus Diclofenac und Kortikosteroid postoperativ.5
Unter Verwendung von OCT zur Quantifizierung des Makulavolumens fanden Forscher heraus, dass eine zweitägige Vorbehandlung mit Ketorolac und eine postoperative Kombinationstherapie mit Ketorolac/Steroid zu einer 46-prozentigen Reduktion der Makulaschwellung einen Monat nach der Operation führte, verglichen mit einer reinen Steroid-Kontrollgruppe.7 Kürzlich wurde in einer randomisierten, prospektiven Studie, in der eine dreitägige präoperative Ketorolac- und Kombinationstherapie mit einer alleinigen Kortikosteroidtherapie verglichen wurde, berichtet, dass die Patienten in der Kontrollgruppe eine 2,4-prozentige Inzidenz von PCME aufwiesen, verglichen mit 0 Prozent in der Kombinationskohorte.8 Obwohl Patienten in der Kortikosteroid-Gruppe eine signifikant höhere Inzidenz von Netzhautverdickungen ≥15 µm aufwiesen, gab es keinen statistischen Unterschied in der bestkorrigierten Sehschärfe zwischen den beiden Gruppen vier Wochen nach dem Eingriff.
In einer prospektiven Auswertung von drei Gruppen, die präoperativ drei Tage lang topisches Indomethacin gefolgt von einer Kombinationstherapie, nur eine postoperative Kombinationstherapie oder nur Kortikosteroid erhielten, wurde die Inzidenz von angiographischen PCME von 32.8 Prozent (nur Kortikosteroid) auf 15 Prozent (postoperative Kombination) bis 0 Prozent (prä- und postoperative NSAID).9
In einem anderen Bericht wurde festgestellt, dass die Zugabe von Nepafenac-Natrium (Nevanac) zu einer postoperativen Kortikosteroid-Therapie die PCME-Rate im Vergleich zu einer reinen Kortikosteroid-Therapie von 2,1 Prozent auf 0 Prozent reduziert.10 Ein kürzlich durchgeführter prospektiver, randomisierter Vergleich von Diclofenac allein mit Betamethason postoperativ ergab, dass fünf Wochen nach der Operation die Inzidenz von angiographischem CME in der NSAID-Gruppe (18,8 Prozent) niedriger war als in der Kortikosteroid-Gruppe (58,0 Prozent).11
Diese Studien zeigen, dass die prophylaktische Anwendung von NSAIDs die Inzidenz von PCME reduziert und dass ihre Wirksamkeit am größten ist, wenn sie mindestens drei Tage präoperativ begonnen und postoperativ über mehrere Wochen fortgesetzt wird. Der genaue Zeitpunkt und die Dauer der prä- und postoperativen Behandlung sowie die Identifizierung der Patienten, die am meisten profitieren würden, sind jedoch noch nicht geklärt.
Hochrisiko-Merkmale
Wie bereits erwähnt, wurde in einer Serie von 1,659 konsekutiven Fällen erhöhten eine epiretinale Membran, ein Venenverschluss in der Vorgeschichte oder die präoperative Anwendung von Prostaglandinanaloga das Risiko für die Entwicklung einer PCME erheblich.4 Bei der Untersuchung einer Reihe von konsekutiven Patienten, die zur Behandlung von PCME in eine Netzhautklinik überwiesen wurden, stellte eine andere Gruppe fest, dass die Hochrisikomerkmale Diabetes mellitus, Hypertonie, frühere Augenoperationen, epiretinale Membran und komplizierte Kataraktextraktion waren. (Heier JS, et al.) In Anbetracht der Tatsache, dass eine Vielzahl von medizinischen und okulären Erkrankungen Patienten für die Entwicklung von PCME prädisponieren können, sollte die Identifizierung dieser Patienten und eine aggressive prophylaktische Therapie mit topischen NSAIDs eingesetzt werden, um das Risiko der Entwicklung von PCME zu reduzieren.
Behandlungen
– NSAIDs. Diese Medikamentenklasse hemmt die Produktion von Prostaglandinen über die Hemmung des COX-Weges (siehe Abbildung 1). Da NSAIDs keinen Einfluss auf vorgebildete oder vorhandene Prostaglandinspiegel haben, ist eine Behandlung vor einem chirurgischen Trauma unerlässlich. In einem kürzlich erschienenen Übersichtsartikel empfahl der Autor eine präoperative Behandlung mit NSAIDs für zwei Tage bei Patienten mit niedrigem Risiko und für eine Woche bei Patienten mit hohem Risiko, wobei die Behandlung für mindestens vier Wochen postoperativ in beiden Gruppen fortgesetzt werden sollte.12
Es besteht immer noch die Frage, welches NSAID am effektivsten bei der Vorbeugung oder Behandlung von PCME ist.
NSAIDs der neueren Generation, wie z.B. Bromfenac-Natrium (Xibrom) und Nepafenac, weisen Modifikationen in ihrer chemischen Struktur auf, die ihre Augenpenetration und theoretische Potenz erhöhen.13 In-vitro-Tests haben ergeben, dass die relative Potenz der COX-2-Hemmung für Bromfenac 18-mal größer ist als für Ketorolac, obwohl die klinische Bedeutung dieser Daten unbekannt ist.14 Eine Studie zur In-vivo-Pharmakokinetik ergab, dass die Kammerwasserkonzentration von handelsüblichem Nepafenac (Nepafenac plus Amfenac) signifikant höher ist als die von Bromfenac oder Ketorolac.15 Es ist jedoch nicht bekannt, ob sich diese Unterschiede in der Penetration in verbesserten klinischen Ergebnissen niederschlagen. Obwohl zahlreiche Marketing-Behauptungen aufgestellt wurden, die implizieren, dass die bessere Penetration, die strukturellen Veränderungen und die größere vorgeschlagene Potenz der neueren Generation von NSAIDs sich in einer erhöhten klinischen Wirksamkeit niederschlagen, wurde keine definitive Studie durchgeführt, um dies zu bestätigen.
– Kombinationstherapie. Eine randomisierte, doppel-maskierte, prospektive Studie, die Ketorolac versus Prednisolon versus Kombinationstherapie bei klinisch signifikanter PCME untersuchte, fand heraus, dass Patienten, die eine Kombinationstherapie erhielten, bis zum zweiten Besuch eine mittlere Veränderung der Sehkraft von ≥2 Zeilen erreichten, während die Patienten in den beiden Monotherapiegruppen bei der dreimonatigen Nachbeobachtung nie eine mittlere Verbesserung um zwei Zeilen erreichten.16 Patienten, die entweder mit der Kombinationstherapie oder mit Ketorolac allein behandelt wurden, sprachen ebenfalls schneller an als Patienten in der Prednisolon-Gruppe.
– Kortikosteroid-Injektionen. Kortikosteroide wirken weiter stromaufwärts auf dem gleichen Weg wie NSAIDs, indem sie die Freisetzung von Arachadonsäure aus den Phospholipiden der Zellmembran hemmen und dadurch die Bildung von Leukotrienen und Prostaglandinen verhindern (siehe Abbildung 1).
Die Diskussion über die wirksamste Verabreichungsform (sub-Tenon oder intravitreal), die optimale Dosierung (4 mg oder mehr) und die Patientensicherheit (Risiken von okulärer Hypertension, Netzhautablösung, Glaskörperblutung und Endophthalmitis) hält an.
Zurzeit gibt es keine randomisierten klinischen Studien, die diese Behandlungsformen bewerten, und die veröffentlichten Ergebnisse scheinen widersprüchlich zu sein.
Eine Forschergruppe fand heraus, dass intravitreales Triamcinolon bei persistierendem PCME zu einer verbesserten Sehschärfe, einer verringerten Makuladicke und erhöhten multifokalen Elektroretinogramm-Werten führte.17 In einer anderen Studie wurde berichtet, dass die Anwendung von 4 mg IVTA bei chronisch refraktärem PCME einen Monat nach der Injektion zu einer anatomischen und funktionellen Verbesserung führte, die mindestens drei Monate anhielt.18 Der positive Effekt war jedoch vorübergehend, da die Sehschärfe und die Makuladicke trotz mehrfacher Behandlungen auf das Niveau vor der Injektion zurückkehrten. In einer weiteren kleinen Serie behielten die Patienten eine Verbesserung der Sehschärfe und eine Abnahme der Makuladicke nach einer Einzeldosis von 4 mg IVTA bei refraktärer PCME bei.19
– Acetazolamid. Acetazolamid erhöht den subretinalen Flüssigkeitstransport und hat gezeigt, dass es das foveale zystoide Ödem bei Erkrankungen wie Retinitis pigmentosa, Aphakie und makulärer epiretinaler Membranbildung beseitigt.20-23 Es gibt eine Handvoll Fallberichte, die das Abklingen des PCME mit der Anwendung von oralem Acetazolamid korrelieren, aber bis heute wurden keine klinischen Studien durchgeführt.
– Antivaskuläre endotheliale Wachstumsfaktoren. Chirurgische Traumata führen zu postoperativen Entzündungen, die durch eine erhöhte Produktion von vasopermeablen Faktoren wie dem vaskulären endothelialen Wachstumsfaktor zu PCME führen können. Auch hier liefern kleine Fallserien widersprüchliche Beweise. Nach intravitrealer Injektion mit Bevacizumab (Avastin) stellte eine Gruppe fest, dass 71 Prozent der Patienten eine Verbesserung der ETDRS-Sehschärfe um zwei oder mehr Zeilen erreichten;24 und eine andere berichtete, dass alle Augen in ihrer Serie eine statistisch signifikante Verbesserung der Sehschärfe aufwiesen.25 Eine andere Studie berichtete jedoch, dass intravitreales Bevacizumab die Sehschärfe bei Patienten mit PCME nicht verbesserte.26
– Vitrektomie. Eine Pars-plana-Vitrektomie mit Membran-Peeling kann in Fällen von PCME mit einer mechanischen Komponente, die entweder bei der klinischen Untersuchung oder durch OCT identifiziert wurde, oder in Fällen eines chronischen refraktären Ödems, das nicht auf eine medikamentöse Therapie anspricht, in Betracht gezogen werden. In einer kleinen Serie führte der chirurgische Eingriff bei den meisten Patienten zu einer Verbesserung der bestkorrigierten Sehschärfe um mehr als drei Linien und in allen Fällen zu einem Abklingen der PCME.27 Es gibt auch Fallberichte in der Literatur, die auf eine Sehverbesserung nach Vitrektomie und Abschälen der inneren Begrenzungsmembran hinweisen.28 Wie bereits erwähnt, sollte eine Pars-plana-Vitrektomie bei zurückgebliebenen Linsenfragmenten, IOL-Fehlstellung oder P. acnes-Infektion in Betracht gezogen werden.
Future Directions
Wie bereits erwähnt, wirken Kortikosteroide am Anfang der Entzündungskaskade. Posurdex (Allergan) ist ein biologisch abbaubares Dexamethason-Dauerabgabesystem, das in die Glaskörperhöhle implantiert wird. Seine Polymermatrix wandelt sich allmählich in Milchsäure und Glykolsäure um, die wiederum in Wasser und Kohlendioxid abgebaut werden. In einer Phase-II-Studie zeigten 54 Prozent der Patienten, die an PCME und Uveitis-assoziiertem CME litten, eine Verbesserung der Sehschärfe um mindestens 10 Buchstaben am Tag 90 nach der Implantation, verglichen mit nur 14 Prozent, die ein ähnliches Ergebnis in der Beobachtungsgruppe zeigten.
Kürzlich hat die FDA Triesence (Alcon), Triamcinolonacetonid, für die intravitreale Injektion während einer Operation zugelassen. Dieses Medikament kann off-label im Behandlungsalgorithmus der rezidivierenden PCME eingesetzt werden.
Es ist offensichtlich, dass sich die Definition der PCME in den letzten Jahren weiterentwickelt hat. Bei ca. 3 Millionen Kataraktoperationen pro Jahr in den USA und den gestiegenen Erwartungen der Patienten ist es für Netzhautspezialisten wichtig, die unterschiedlichen Pathogenesen, Risikofaktoren und das richtige Management der PCME zu verstehen. Neue Technologien haben und werden die Diagnose, Prognose und Behandlung dieser Erkrankung revolutionieren.
Die Autoren praktizieren bei Retinal Consultants of Arizona, Phoenix. Dr. Jamal praktiziert auch bei Texas Retina Associates, Dallas, und Dr. Goldenberg praktiziert bei Associated Retinal Consultants, Royal Oak, Mich. Kontaktieren Sie Dr. Dugel unter pdugel @gmail.com.
1. Irvine SR. Ein neu definiertes Glaskörpersyndrom nach einer Kataraktoperation. Am J Ophthalmol 1953; 36:599-619.
2. Gass JD, Norton EW. Follow-up-Studie des zystoiden Makulaödems nach Kataraktextraktion. Trans Am Acad Ophthalmol Otolaryngol 1969;73(4):665-82.
3. Wright PL, Wilkinson CP, Balyeat HD, et al. Angiographic cystoid macular edema after posterior chamber lens implantation. Arch Ophthalmol 1988;106:740-744.
4. Henderson BA, Kim JY, Ament CS, et al. Clinical pseudophakic cystoid macular edema. Risikofaktoren für die Entstehung und Dauer nach der Behandlung. J Cataract Refract Surg 2007;33:1550-8.
5. McColgin AZ, Raizman MB. Wirksamkeit von topischem Voltaren bei der Verringerung des Auftretens eines postoperativen zystoiden Makulaödems. Invest Ophthmol Vis Sci 1999;40 S289.
6. Donnenfeld ED, Perry HD, Wittpenn JR, et al. Preoperative ketorolac tromethamine 0.4 percent in phacoemulsification outcomes: Pharmakokinetik-Wirkungskurve. J Cataract Refract Surg 2006;32:1474-82.
7. Almeida DR, Johnson D, Hollands H, Smallman D, et al. Effect of prophylactic nonsteroidal antiinflammatory drugs on cystoid macular edema assessed using optical coherence tomography quantification of total macular volume after cataract surgery. J Cataract Refract Surg 2008;34:64-9.
8. Wittpenn JR, Silverstein S, Heier J, et al. A Randomized, Masked Comparison of Topical Ketorolac 0.4 percent Plus Steroid vs Steroid Alone in Low-Risk Cataract Surgery Patients. Am J Ophthalmol 2008; 146:554 -560.
9. Yavas GF, Oztürk F, Küsbeci T. Preoperative topical indomethacin to prevent pseudophakic cystoid macular edema. J Cataract Refract Surg 2007;33:804-7.
10. Wolf EJ, Braunstein A, Shih C, et al. Inzidenz eines visuell signifikanten pseudophaken Makulaödems nach ereignisloser Phakoemulsifikation bei mit Nepafenac behandelten Patienten. J Cataract Refract Surg 2007;33:1546-1549.
11. Asano S, Miyake K, Ota I, et al. Reducing angiographic cystoid macular edema and blood-aqueous barrier disruption after small-incision phacoemulsification and foldable intraocular lens implantation: Multizentrischer prospektiver randomisierter Vergleich von topischem Diclofenac 0,1 Prozent und Betamethason 0,1 Prozent. J Cataract Refract Surg 2008;34:57-63.
12. O’Brien TP. Neue Richtlinien für den Einsatz von NSAID-Therapie zur Optimierung der Patientenversorgung bei Kataraktoperationen. Curr Med Res & Opin. 2005;21:1131-1137.
13. Walsh DA, Moran HW, Shamblee DA, et al. Antiinflammatory agents 3. Synthese und pharmakologische Bewertung von 2-Amino-3-benzoylphenylessigsäure und Analoga. J Medicinal Chem 1984;27:1379-1388.
14. Waterbury LD, Silliman D, Jolas T. Comparison of cyclooxygenase inhibitory activity and ocular anti-inflammatory effects of ketorolac tromethamine and bromfenac sodium. Curr Med Res Opin 2006;22: 1133-1140.
15. Walters TR, Raizman M, Ernest P, et al. In vivo pharmacokinetics and in vitro pharmacodynamics of nepafenac, amfenac, ketorolac, and bromfenac. J Cataract Refract Surg 2007;33;1539-1545.
16. Heier JS, Topping TM, Baumann W, et al. Ketorolac versus Prednisolon versus Kombinationstherapie bei der Behandlung des akuten pseudophakischen zystoiden Makulaödems. Ophthalmology 2000;107:2034-8.
17. Koutsandrea C, Moschos MM, Brouzas D, et al. Intraokulares Triamcinolonacetonid bei pseudophakem zystoiden Makulaödem: Studie mit optischer Kohärenztomographie und multifokaler Elektroretinographie. Retina 2007;27:159-64.
18. Boscia F, Furino C, Dammacco R, et al. Intravitreales Triamcinolonacetonid bei refraktärem pseudophakem zystoidem Makulaödem: Funktionelle und anatomische Ergebnisse. Eur J Ophthalmol 2005;15:89-95.
19. Karacorlu M, Ozdemir H, Karacorlu S. Intravitreales Triamcinolonacetonid zur Behandlung des chronischen pseudophakischen zystoiden Makulaödems. Acta Ophthalmol Scand 2003;81:648-52.
20. Marmor MF. Hypothese zur Kohlensäureanhydrase-Behandlung von CME: Beispiel mit epiretinaler Membran. Arch Ophthalmol 1990;108:1524-1525.
21. Cox SN, Hay E, Bird AC. Behandlung des chronischen Makulaödems mit Acetazolamid. Arch Ophthalmol 1988;106:1190-1195.
22. Fishman GA, Gilbert COT, Fiscella RG et al. Acetazolamid zur Behandlung des chronischen Makulaödems bei Retinitis pigmentosa. Arch Ophthalmol 1989;107:1445-1452.
23. Wolfensberger TJ, Chiang R, Takeuchi A et al. Inhibition of membrane-bound carbonic anhydrase enhances subretinal fluid absorption and retinal adhesiveness. Graefe’s Arch Clin Exp Ophthalmol 2000; 238:76-80.
24. Arevalo JF, Garcia-Amaris RA, Roca JA, et al. Primary intravitreal bevacizumab for the management of pseudophakic cystoid macular edema: Pilotstudie der Pan-American Collaborative Retina Study Group. J Cataract Refract Surg. 2007;33:2098-105.
25. Barone A, Russo V, Prascina F, et al. Short-term safety and efficacy of Intravitreal Bevacizumab for Pseudophakic Cystoid Macular Edema. Retina 2008 Oct 9.
26. Spitzer MS, Ziemssen F, Yoeruek E, et al. Efficacy of intravitreal bevacizumab in treating postoperative pseudophakic cystoid macular edema. J Cataract Refract Surg 2008;34:70-5.
27. Pendergast SD, Margherio RR, Williams GA, et al. Vitrektomie bei chronischem pseudophakem zystoiden Makulaödem. Am J Ophthalmol 1999;128:317-23.
28. Peyman GA, Canakis C, Livir-Rallatos C, et al. The effect of internal limiting membrane peeling on chronic recalcitrant pseudophakic cystoid macular edema: A report of two cases. Am J Ophthalmol 2002;133:571-2.