Beim Umgang mit den Isotopen eines Elements ist es wichtig zu wissen, dass diese durch den Zusatz der Massenzahl zum Namen des Elements voneinander unterschieden werden.
In Ihrem Fall wird der Name Bor-11 verwendet, um ein Isotop von Bor zu bezeichnen, das eine Massenzahl gleich #11# hat.
Da die Massenzahl definiert ist als die Summe der Anzahl der Protonen und der Anzahl der Neutronen, die das Atom in seinem Kern hat, folgt daraus, dass man schreiben kann
#color(blue)(A = Z + „Anzahl. der Neutronen“) „#, wobei
#A# – die Massenzahl
#Z# – die Ordnungszahl
Wie Sie wissen, wird die Identität eines Elements ausschließlich durch die Anzahl der Protonen in seinem Kern angegeben. Diese Zahl stellt die Ordnungszahl des Elements dar.
Um also die Ordnungszahl von Bor zu ermitteln, werfen Sie einen kurzen Blick auf das Periodensystem. Beachten Sie, dass Bor, #“B „#, das sich in Periode 2, Gruppe 13 des Periodensystems befindet, die Ordnungszahl #5# hat.
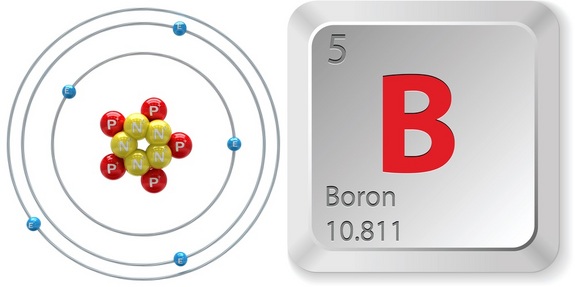
Das bedeutet, dass jedes Atom, das #5# Protonen in seinem Kern hat, ein Boratom ist.
Die Massenzahl dieses Bor-Isotops ist also gleich #11#, und die Ordnungszahl gleich #5#.