 Yoshinori Ohsumi
Yoshinori OhsumiIm Jahr 2016, verlieh die Nobelversammlung am Karolinska Institutet den Nobelpreis für Physiologie oder Medizin an Yoshinori Ohsumi für seine Entdeckungen von Mechanismen für die Autophagie.
Aber was ist Autophagie? Das Wort leitet sich aus dem Griechischen auto (selbst) und phagein (essen) ab. Das Wort bedeutet also wörtlich, sich selbst zu essen. Im Wesentlichen handelt es sich dabei um den Mechanismus des Körpers, um die ganze abgebaute, alte Zellmaschinerie (Organellen, Proteine und Zellmembranen) loszuwerden, wenn nicht mehr genug Energie zur Verfügung steht, um sie zu erhalten. Es ist ein regulierter, geordneter Prozess, um zelluläre Komponenten abzubauen und zu recyceln.

Es gibt einen ähnlichen, besser bekannten Prozess, der Apoptose genannt wird, auch bekannt als programmierter Zelltod. Zellen sind nach einer bestimmten Anzahl von Teilungen darauf programmiert zu sterben. Das mag zunächst etwas makaber klingen, aber Sie sollten sich darüber im Klaren sein, dass dieser Prozess für die Aufrechterhaltung einer guten Gesundheit unerlässlich ist. Nehmen Sie zum Beispiel an, Sie besitzen ein Auto. Sie lieben dieses Auto. Sie haben tolle Erinnerungen damit. Sie lieben es, damit zu fahren.
Aber nach ein paar Jahren fängt es an, ziemlich ramponiert auszusehen. Nach ein paar weiteren sieht es nicht mehr so toll aus. Das Auto kostet Sie jedes Jahr Tausende von Dollar an Unterhalt. Es geht immer wieder kaputt. Ist es besser, es zu behalten, wenn es nur noch ein Schrotthaufen ist? Offensichtlich nicht. Also werden Sie es los und kaufen ein schickes neues Auto.
Das Gleiche passiert im Körper. Die Zellen werden alt und schrottreif. Es ist besser, sie so zu programmieren, dass sie sterben, wenn ihr nützliches Leben vorbei ist. Das klingt wirklich grausam, aber so ist das Leben. Das ist der Prozess der Apoptose, bei dem die Zellen darauf programmiert sind, nach einer bestimmten Zeit zu sterben. Es ist wie beim Leasing eines Autos. Nach einer bestimmten Zeit wird man das Auto los, egal ob es noch funktioniert oder nicht. Dann bekommt man ein neues Auto. Sie müssen sich keine Sorgen machen, dass es zum ungünstigsten Zeitpunkt kaputt geht.
Autophagie – Ersetzen alter Teile der Zelle
Der gleiche Prozess findet auch auf subzellulärer Ebene statt. Man muss nicht unbedingt das ganze Auto ersetzen. Manchmal muss man nur die Batterie austauschen, die alte wegwerfen und eine neue besorgen. Dies geschieht auch in den Zellen. Anstatt die gesamte Zelle abzutöten (Apoptose), möchte man nur einige Teile der Zelle ersetzen. Das ist der Prozess der Autophagie, bei dem subzelluläre Organellen zerstört und an deren Stelle neue aufgebaut werden. Alte Zellmembranen, Organellen und andere Zelltrümmer können entfernt werden. Dies geschieht, indem man sie zum Lysosom schickt, einer spezialisierten Organelle, die Enzyme zum Abbau von Proteinen enthält.
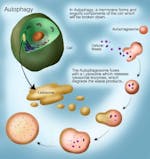
Autophagie wurde erstmals 1962 beschrieben, als Forscher in Rattenleberzellen nach der Infusion von Glukagon eine Zunahme der Anzahl von Lysosomen (der Teil der Zelle, der Dinge zerstört) feststellten. Der mit dem Nobelpreis ausgezeichnete Wissenschaftler Christian de Duve prägte den Begriff Autophagie. Beschädigte subzelluläre Teile und ungenutzte Proteine werden zur Zerstörung markiert und dann zu den Lysosomen geschickt, um die Arbeit zu beenden.
Einer der Schlüsselregulatoren der Autophagie ist die Kinase namens mammalian target of rapamycin (mTOR). Wenn mTOR aktiviert ist, unterdrückt es die Autophagie, und wenn es inaktiv ist, fördert es sie.
Was aktiviert die Autophagie?
Nährstoffentzug ist der Schlüsselaktivator der Autophagie. Erinnern Sie sich daran, dass Glukagon sozusagen das entgegengesetzte Hormon zu Insulin ist. Es ist wie das Spiel, das wir als Kinder gespielt haben – „entgegengesetzter Tag“. Wenn Insulin ansteigt, sinkt Glukagon. Wenn Insulin sinkt, steigt Glukagon an. Wenn wir essen, steigt Insulin an und Glukagon sinkt. Wenn wir nicht essen (fasten), geht Insulin nach unten und Glukagon nach oben. Dieser Anstieg von Glucagon stimuliert den Prozess der Autophagie. Tatsächlich bietet das Fasten (erhöht Glukagon) den größten bekannten Schub für die Autophagie.
Fasten ist tatsächlich weitaus vorteilhafter als nur die Stimulation der Autophagie. Es bewirkt zwei gute Dinge. Indem es die Autophagie anregt, entledigen wir uns all unserer alten, überflüssigen Proteine und Zellteile. Gleichzeitig wird durch das Fasten auch das Wachstumshormon stimuliert, das unserem Körper sagt, dass er mit der Produktion neuer, schicker Teile für den Körper beginnen soll. Wir geben unserem Körper wirklich die komplette Renovierung.
Sie müssen das alte Zeug loswerden, bevor Sie neues Zeug einbauen können. Denken Sie an die Renovierung Ihrer Küche. Wenn Sie alte lindgrüne Schränke im Stil der 1970er Jahre herumstehen haben, müssen Sie sie ausrangieren, bevor Sie neue einbauen. Der Prozess der Zerstörung (Entfernung) ist also genauso wichtig wie der Prozess der Schaffung. Wenn Sie einfach versuchen würden, neue Schränke einzubauen, ohne die alten herauszunehmen, würde das nicht so toll aussehen. So kann das Fasten in gewisser Weise den Alterungsprozess umkehren, indem es den alten zellulären Müll loswird und ihn durch neue Teile ersetzt.
Ein hochgradig kontrollierter Prozess
Autophagie ist ein hochgradig regulierter Prozess. Läuft er Amok, gerät er außer Kontrolle, wäre das schädlich, also muss er sorgfältig kontrolliert werden. In Säugetierzellen ist die totale Verarmung an Aminosäuren ein starkes Signal für die Autophagie, aber die Rolle der einzelnen Aminosäuren ist variabler. Die Aminosäurespiegel im Plasma variieren jedoch nur wenig. Es wird angenommen, dass Aminosäuresignale und Wachstumsfaktor-/Insulinsignale auf dem mTOR-Signalweg konvergieren – der manchmal als Hauptregulator der Nährstoffsignalisierung bezeichnet wird.
Bei der Autophagie werden also alte Zellbestandteile in die einzelnen Aminosäuren (die Bausteine der Proteine) zerlegt. Was passiert mit diesen Aminosäuren? In den frühen Stadien des Verhungerns beginnen die Aminosäurespiegel zu steigen. Man nimmt an, dass diese aus der Autophagie stammenden Aminosäuren an die Leber zur Glukoneogenese geliefert werden. Sie können auch über den Tricarbonsäurezyklus (TCA) zu Glukose abgebaut werden. Das dritte mögliche Schicksal der Aminosäuren ist der Einbau in neue Proteine.
Die Folgen der Anhäufung von alten Junky-Proteinen überall können in zwei Hauptkrankheiten gesehen werden – Alzheimer-Krankheit (AD) und Krebs. Bei der Alzheimer-Krankheit kommt es zu einer Anhäufung von abnormalen Proteinen – entweder Amyloid-Beta oder Tau-Protein, die das Gehirnsystem verstopfen. Obwohl wir noch keine Beweise für klinische Studien haben, würde es Sinn machen, dass ein Prozess wie die Autophagie, der die Fähigkeit hat, altes Protein zu beseitigen, die Entwicklung von AD verhindern könnte.
Was schaltet die Autophagie aus? Essen. Glukose, Insulin (oder vermindertes Glukagon) und Proteine schalten diesen Selbstreinigungsprozess aus. Und es braucht nicht viel. Selbst eine kleine Menge einer Aminosäure (Leucin) kann die Autophagie kalt stoppen. Dieser Prozess der Autophagie ist also einzigartig für das Fasten – etwas, das es bei einfacher Kalorienrestriktion oder Diäten nicht gibt.
Es gibt hier natürlich ein Gleichgewicht. Man wird sowohl von zu viel Autophagie als auch von zu wenig krank. Womit wir wieder beim natürlichen Kreislauf des Lebens wären – Schlemmen und Fasten. Nicht ständige Diäten. Dies ermöglicht Zellwachstum während des Essens und Zellreinigung während des Fastens – ein Gleichgewicht. Im Leben dreht sich alles um Balance.
–
Jason Fung