L’atome de carbone électrophile des aldéhydes et des cétones peut être la cible d’une attaque nucléophile par les amines ainsi que par les alcools. Le résultat final de l’attaque par une amine nucléophile est un groupe fonctionnel dans lequel la double liaison C=O est remplacée par une double liaison C=N, et est connu sous le nom d’imine. (Un terme équivalent est ‘base de Schiff’, mais nous utiliserons ‘imine’ tout au long de ce livre). Rappelez-vous de la section 7.5B que les imines ont un pKa d’environ 7, donc à pH physiologique, elles peuvent être dessinées avec précision comme étant soit protonées (forme d’ion iminium), soit neutres (imine).
Formation de l’ion iminium:
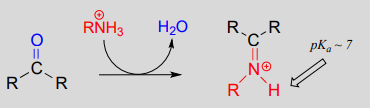
Mécanisme (enzymatique):
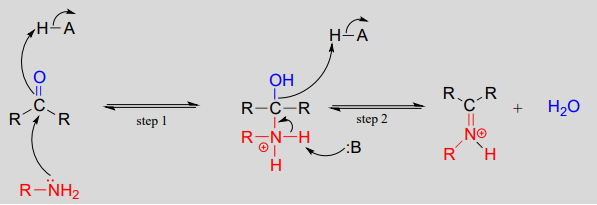
Mécaniquement, la formation d’une imine implique deux étapes. Tout d’abord, l’azote de l’amine attaque le carbone du carbonyle dans une étape d’addition nucléophile (étape 1) qui est étroitement analogue à la formation des hémiacétals et des hémikétals. Sur la base de vos connaissances du mécanisme de formation des acétals et des cétals, vous pourriez vous attendre à ce que l’étape suivante soit l’attaque par une seconde amine pour former un composé avec un carbone lié à deux groupes amine – la version azotée d’un cétal ou d’un acétal. Au lieu de cela, ce qui se passe ensuite (étape 2 ci-dessus) est que les électrons solitaires de l’azote » poussent » l’oxygène hors du carbone, formant une double liaison \(C=N\) (un iminium) et une molécule d’eau déplacée.
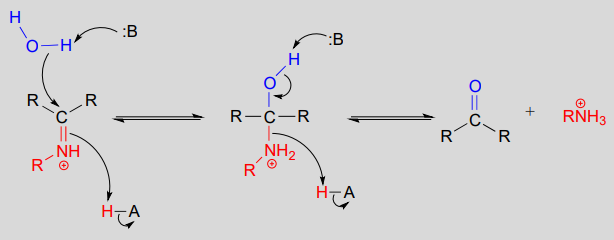
La reconversion d’un iminium en aldéhyde ou en cétone est un processus hydrolytique (les liaisons sont rompues par une molécule d’eau), et mécaniquement, c’est simplement l’inverse de la formation de l’iminiom :
Hydrolyse d’un ion iminium :
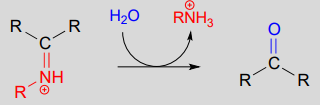
Mécanisme (enzymatique) :
Les enzymes formant des liaisons carbone-carbone appelées aldolases (que nous aborderons en détail au chapitre 12) forment souvent des liaisons iminium entre un carbone carbonyle sur un substrat et un résidu lysine du site actif de l’enzyme, comme dans cette réaction aldolase du cycle de Calvin :
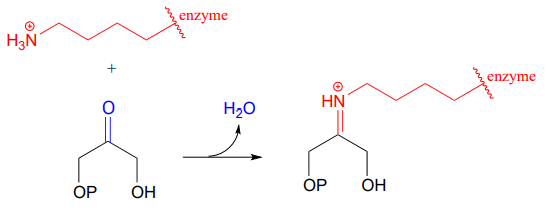
Après que la liaison carbone-carbone faisant partie d’une réaction aldolase soit achevée, la liaison iminium est hydrolysée, libérant le produit pour qu’il puisse diffuser hors du site actif et permettre à un autre cycle catalytique de commencer.
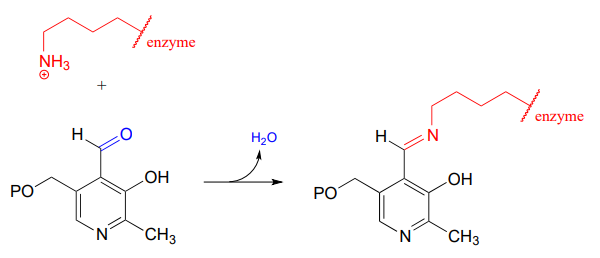
Puis, la liaison imine \(PLP\)-lysine est échangée contre une liaison imine entre \(PLP\) et le groupe amino du substrat, dans ce que l’on peut appeler une transimination.
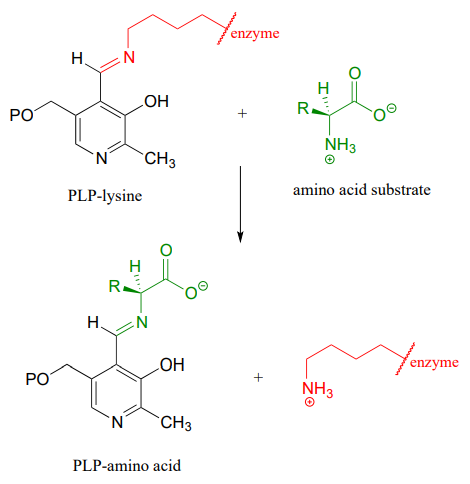
Le mécanisme d’une transimination est très similaire à celui de la formation des imines :
Réaction de transimination :
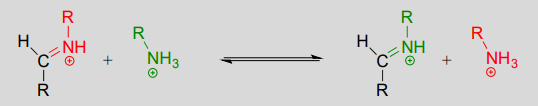
Mécanisme :
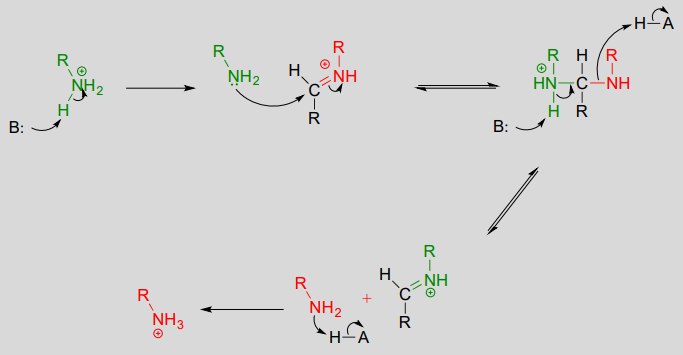
Exercice \(\PageIndex{1}\)
Dessinez une imine qui pourrait se former entre chaque paire de composés.
a.
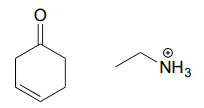
b.
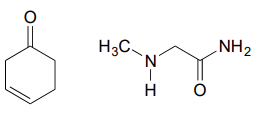
c.
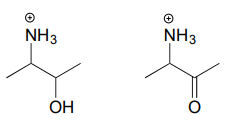
Exercice \(\PageIndex{2}\)
Dessinez le produit d’hydrolyse de l’imminium pour chacun des composés suivants.
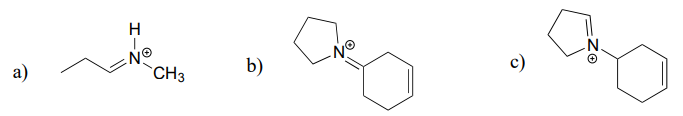
Réponse
Ajouter le texte de la réponse ici et il sera automatiquement masqué si vous avez un modèle « AutoNum » actif sur la page.
Exercice \(\PageIndex{3}\)
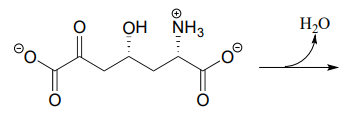
- L’intermédiaire métabolique représenté ci-dessous subit une formation intramoléculaire d’imine comme étape de la biosynthèse de la lysine (EC 4.3.3.7). Dessinez le produit de cette étape de formation d’imine intramoléculaire.
- Dessinez le produit de cette étape d’hydrolyse de l’imine (EC 2.3.1.117) de la voie de dégradation de la proline.
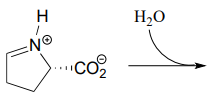
Contributeurs
-
Chimie organique à dominante biologique de Tim Soderberg (Université du Minnesota, Morris)