Objectifs d’apprentissage
- Expliquer la fonction et les changements de couleur des indicateurs acide-base
- Démontrer comment choisir l’indicateur approprié pour une expérience de titrage
- Déterminer les constantes de dissociation acide Ka ou Kai des indicateurs.
Certaines substances organiques changent de couleur en solution diluée lorsque la concentration en ions hydronium atteint une valeur particulière. Par exemple, la phénolphtaléine est une substance incolore dans toute solution aqueuse dont la concentration en ions hydronium est supérieure à 5,0 × 10-9 M (pH < 8,3). Dans les solutions plus basiques où la concentration en ions hydronium est inférieure à 5,0 × 10-9 M (pH > 8,3), elle est rouge ou rose. Les substances telles que la phénolphtaléine, qui peuvent être utilisées pour déterminer le pH d’une solution, sont appelées indicateurs acide-base. Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles.
L’équilibre dans une solution de l’indicateur acide-base orange méthylique, un acide faible, peut être représenté par une équation dans laquelle nous utilisons HIn comme représentation simple de la molécule complexe d’orange méthylique :
\}{}}=4.0×10^{-4}\]
L’anion de l’orange méthylique, In-, est jaune, et la forme non ionisée, HIn, est rouge. Lorsque nous ajoutons un acide à une solution d’orange de méthyle, l’augmentation de la concentration en ions hydronium déplace l’équilibre vers la forme rouge non ionisée, conformément au principe de Le Chatelier. Si nous ajoutons une base, nous déplaçons l’équilibre vers la forme jaune. Ce comportement est totalement analogue à l’action des tampons.
La couleur d’un indicateur est le résultat visible du rapport des concentrations des deux espèces In- et HIn. Si la plus grande partie de l’indicateur (généralement environ 60-90% ou plus) est présente sous forme d’In-, alors nous voyons la couleur de l’ion In-, qui serait jaune pour le méthyl orange. Si la majeure partie de l’indicateur est sous forme de HIn, nous voyons la couleur de la molécule de HIn : rouge pour le méthyl orange. Pour le méthyl orange, nous pouvons réarranger l’équation pour Ka et écrire :
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}\]
Cela nous montre comment le rapport de \(\ce{\dfrac{}{}\) varie avec la concentration de l’ion hydronium. L’expression ci-dessus décrivant l’équilibre de l’indicateur peut être réarrangée :
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:or\:pH=p\mathit{K}_a+log\left(\dfrac{}{\right)}\]
La dernière formule est la même que l’équation d’Henderson-Hasselbalch, qui peut être utilisée pour décrire l’équilibre des indicateurs.
Lorsque a la même valeur numérique que Ka, le rapport de to est égal à 1, ce qui signifie que 50 % de l’indicateur est présent sous la forme rouge (HIn) et 50 % sous la forme ionique jaune (In-), et la solution apparaît de couleur orange. Lorsque la concentration en ions hydronium augmente jusqu’à 8 × 10-4 M (un pH de 3,1), la solution devient rouge. Aucun changement de couleur n’est visible pour toute augmentation supplémentaire de la concentration en ions hydronium (diminution du pH). À une concentration d’ions hydronium de 4 × 10-5 M (pH de 4,4), la plus grande partie de l’indicateur est sous la forme ionique jaune, et une nouvelle diminution de la concentration d’ions hydronium (augmentation du pH) ne produit pas de changement de couleur visible. La plage de pH comprise entre 3,1 (rouge) et 4,4 (jaune) constitue l’intervalle de changement de couleur du méthyl orange ; le changement de couleur prononcé a lieu entre ces valeurs de pH.
De nombreuses substances différentes peuvent être utilisées comme indicateurs, en fonction de la réaction particulière à surveiller. Par exemple, le jus de chou rouge contient un mélange de substances colorées qui passent du rouge profond à faible pH au bleu clair à pH intermédiaire et au jaune à pH élevé (figure \(\PageIndex{1}\)). Dans tous les cas, cependant, un bon indicateur doit avoir les propriétés suivantes :
- Le changement de couleur doit être facilement détecté.
- Le changement de couleur doit être rapide.
- La molécule de l’indicateur ne doit pas réagir avec la substance titrée.
- Pour minimiser les erreurs, l’indicateur doit avoir un pKin qui se situe à une unité de pH près du pH attendu au point d’équivalence du titrage.

Le jus de chou rouge contient un mélange de substances dont la couleur dépend du pH. Chaque tube à essai contient une solution de jus de chou rouge dans de l’eau, mais le pH des solutions varie de pH = 2,0 (tout à gauche) à pH = 11,0 (tout à droite). À pH = 7,0, la solution est bleue.
On a développé des indicateurs synthétiques qui répondent à ces critères et couvrent pratiquement toute la gamme de pH. La figure \(\PageIndex{2}\) montre la plage de pH approximative sur laquelle certains indicateurs courants changent de couleur et leur changement de couleur. En outre, certains indicateurs (comme le bleu de thymol) sont des acides ou des bases polyprotiques, qui changent de couleur deux fois à des valeurs de pH très éloignées.
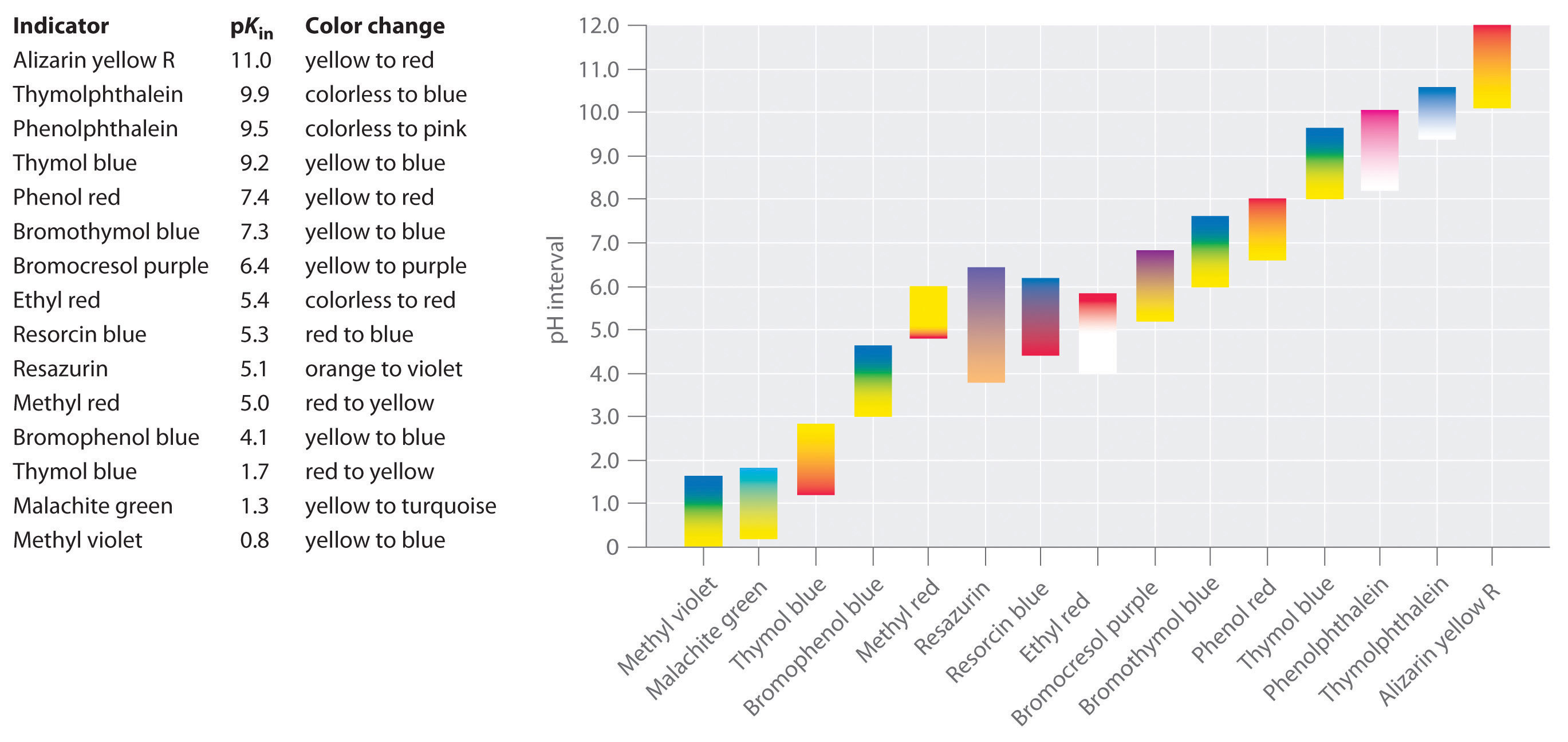
Il est important de savoir qu’un indicateur ne change pas brusquement de couleur à une valeur de pH particulière ; au contraire, il subit en réalité un titrage du pH comme tout autre acide ou base. Au fur et à mesure que la concentration de HIn diminue et que la concentration de In- augmente, la couleur de la solution passe lentement de la couleur caractéristique de HIn à celle de In-. Comme nous le verrons au chapitre 16, le rapport / passe de 0,1 à un pH inférieur d’une unité au pKin à 10 à un pH supérieur d’une unité au pKin. Ainsi, la plupart des indicateurs changent de couleur sur une plage de pH d’environ deux unités de pH.
Nous avons indiqué qu’un bon indicateur doit avoir une valeur de pKin proche du pH attendu au point d’équivalence. Pour un titrage acide fort-base forte, le choix de l’indicateur n’est pas particulièrement critique en raison de la très grande variation du pH qui se produit autour du point d’équivalence. En revanche, l’utilisation d’un mauvais indicateur pour le titrage d’un acide faible ou d’une base faible peut entraîner des erreurs relativement importantes, comme l’illustre la figure \(\PageIndex{3}\). Cette figure montre les courbes du pH en fonction du volume de base ajouté pour le titrage de 50,0 ml d’une solution 0,100 M d’un acide fort (HCl) et d’un acide faible (acide acétique) avec du \(NaOH\) 0,100 M. Les plages de pH pour lesquelles deux indicateurs courants (rouge de méthyle, \(pK_{in} = 5,0\), et phénolphtaléine, \(pK_{in} = 9,5\)) changent de couleur sont également indiquées. Les barres horizontales indiquent les plages de pH pour lesquelles les deux indicateurs changent de couleur et croisent la courbe de titrage du HCl, où elle est presque verticale. Ainsi, les deux indicateurs changent de couleur lorsque le même volume de \(NaOH\) a été ajouté (environ 50 mL), ce qui correspond au point d’équivalence. En revanche, le titrage de l’acide acétique donnera des résultats très différents selon que l’on utilise le rouge de méthyle ou la phénolphtaléine comme indicateur. Bien que la plage de pH sur laquelle la phénolphtaléine change de couleur soit légèrement supérieure au pH au point d’équivalence du titrage de l’acide fort, l’erreur sera négligeable en raison de la pente de cette partie de la courbe de titrage. Tout comme pour le titrage du HCl, l’indicateur de phénolphtaléine deviendra rose lorsqu’environ 50 ml de \(NaOH\) auront été ajoutés à la solution d’acide acétique. En revanche, le rouge de méthyle commence à passer du rouge au jaune vers pH 5, ce qui correspond au point médian du titrage de l’acide acétique, et non au point d’équivalence. L’ajout de seulement 25 à 30 ml de \(NaOH\) fera donc changer de couleur l’indicateur rouge de méthyle, ce qui entraînera une énorme erreur.
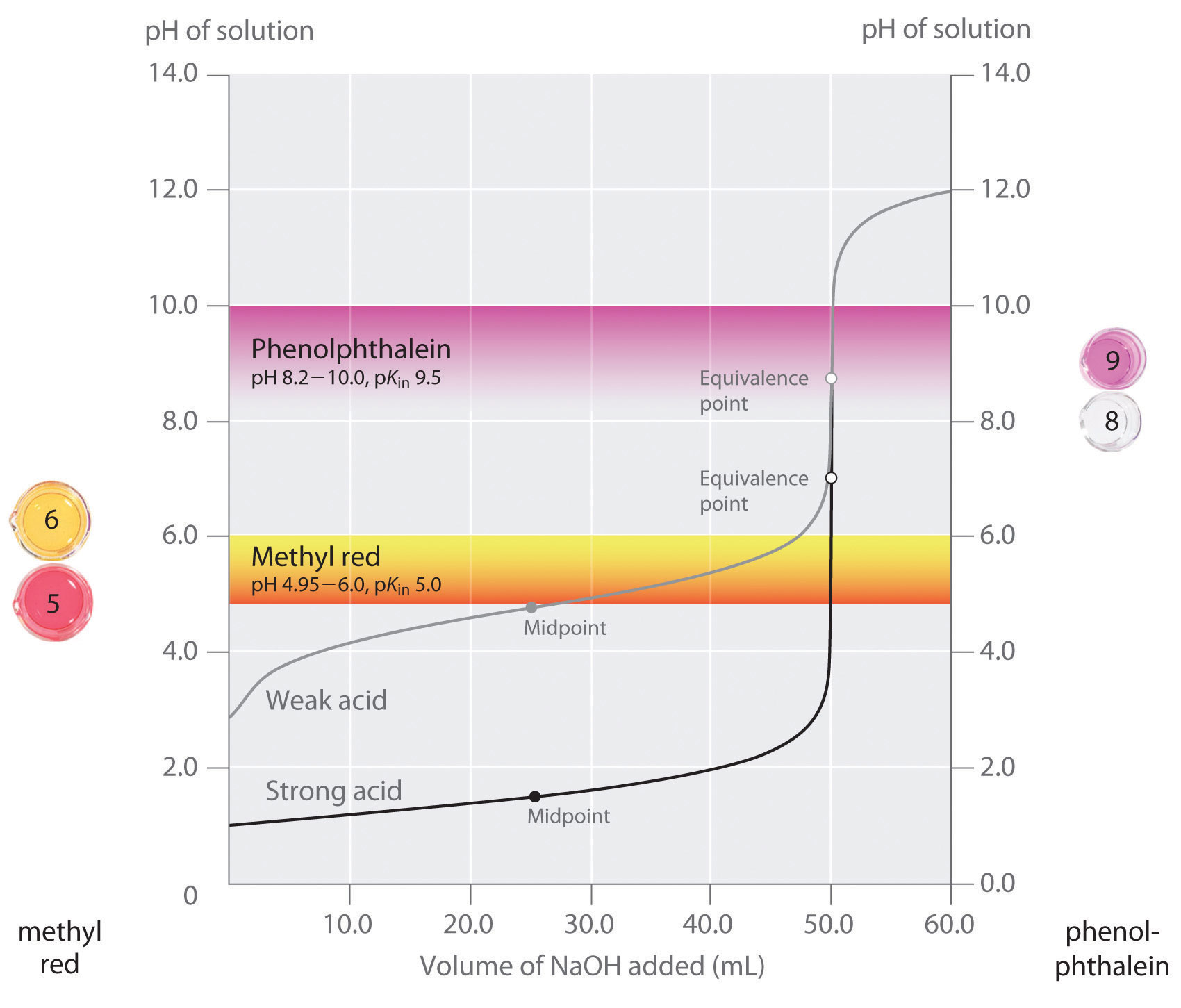
Le graphique montre les résultats obtenus en utilisant deux indicateurs (rouge de méthyle et phénolphtaléine) pour le titrage de solutions 0,100 M d’un acide fort (HCl) et d’un acide faible (acide acétique) avec 0,100 M de \(NaOH\). En raison de la raideur de la courbe de titrage d’un acide fort autour du point d’équivalence, l’un ou l’autre indicateur changera rapidement de couleur au point d’équivalence pour le titrage de l’acide fort. En revanche, le pKin du rouge de méthyle (5,0) est très proche du pKa de l’acide acétique (4,76) ; le point médian du changement de couleur du rouge de méthyle se produit près du point médian du titrage, plutôt qu’au point d’équivalence.
En général, pour les titrages d’acides forts avec des bases fortes (et vice versa), n’importe quel indicateur avec un pK in entre environ 4,0 et 10,0 fera l’affaire. Pour le titrage d’un acide faible, cependant, le pH au point d’équivalence est supérieur à 7,0, il faut donc utiliser un indicateur tel que la phénolphtaléine ou le bleu de thymol, dont le pKin > 7,0. Inversement, pour le titrage d’une base faible, où le pH au point d’équivalence est inférieur à 7,0, un indicateur tel que le rouge de méthyle ou le bleu de bromocrésol, avec un pKin < 7.0, doit être utilisé.
Exemple \(\PageIndex{1}\)
Dans le titrage d’un acide faible avec une base forte, quel indicateur serait le meilleur choix ?
- Méthyl orange
- Vert bromocrésol
- Phénolphtaléine
Solution
La bonne réponse est C. Dans le titrage d’un acide faible avec une base forte, la base conjuguée de l’acide faible rendra le pH au point d’équivalence supérieur à 7. Par conséquent, vous voudriez qu’un indicateur change dans cette gamme de pH. L’orange de méthyle et le vert de bromocrésol changent tous deux de couleur dans une plage de pH acide, tandis que la phénolphtaléine change dans un pH basique.
L’existence de nombreux indicateurs de couleurs et de valeurs de pKin différentes offre également un moyen pratique d’estimer le pH d’une solution sans utiliser un pH-mètre électronique coûteux et une électrode de pH fragile. Des bandes de papier ou de plastique imprégnées de combinaisons d’indicateurs sont utilisées comme » papier pH « , ce qui permet d’estimer le pH d’une solution en y plongeant simplement un morceau de papier pH et en comparant la couleur obtenue avec les normes imprimées sur le récipient (Figure \(\PageIndex{4}\)).
Summary
Les indicateurs acide-base sont des composés qui changent de couleur à un pH particulier. Ce sont généralement des acides ou des bases faibles dont les changements de couleur correspondent à la déprotonation ou à la protonation de l’indicateur lui-même.
Contributeurs et attributions
-
Paul Flowers (Université de Caroline du Nord – Pembroke), Klaus Theopold (Université du Delaware) et Richard Langley (Université d’État de Stephen F. Austin) avec les auteurs collaborateurs. Le contenu des manuels scolaires produit par OpenStax College est sous licence Creative Commons Attribution License 4.0. Téléchargez-le gratuitement sur http://cnx.org/contents/85abf193-2bd…[email protected]).
- {template.ContribBoundless()}}
.