Pravin U. Dugel, MD
Phoenix
L’œdème maculaire cystoïde pseudophaque a été décrit pour la première fois par A. Ray Irvine Jr, MD,1 en 1953, puis élucidé par J. Donald M Gass, MD, en 1969.2 Le Dr Gass a décrit que l’incidence maximale se produisait six semaines après l’opération et a suggéré qu’il existait une différence entre l’OMCC angiographique et l’OMCC cliniquement significatif, dans la mesure où seuls quelques patients se plaignaient d’une baisse de la vision. L’EMCP clinique est maintenant défini comme une acuité visuelle Snellen de 20/40 ou moins. Les symptômes courants comprennent une baisse de l’acuité visuelle et de la sensibilité aux contrastes ainsi qu’une métamorphopsie.
Bien que l’adoption de la phacoémulsification par rapport à l’extraction extracapsulaire de la cataracte ait fait baisser le taux d’EMCP de 16 à 24 %3, l’utilisation croissante des implants de lentilles intraoculaires multifocales a entraîné des attentes plus élevées de la part des patients. En raison de la conception de ces nouveaux implants, qui diminuent intrinsèquement la sensibilité aux contrastes, même une légère PCME peut entraîner une réduction significative de la qualité de la vision et de la satisfaction du patient. Lorsque la Food and Drug Administration approuve l’utilisation d’une nouvelle LIO, elle précise que le « taux acceptable » d’ECP cliniquement significatif doit être inférieur à 5 %. Compte tenu de l’évolution rapide de la technologie chirurgicale et des LIO, il se peut que l’EMCP « cliniquement significatif » doive être redéfini pour s’adapter à la fois aux exigences et aux attentes visuelles du patient.
Incidence
L’incidence de l’EMCP après une phacoémulsification chez des patients non compliqués et à faible risque peut varier de 2 % à 12 %4,5. On pense que l’incidence maximale se produit six semaines après l’intervention chirurgicale.2 Les facteurs prédictifs du développement de l’OMCP dans cette population comprennent des antécédents d’occlusion veineuse rétinienne, la présence d’une membrane épirétinienne et l’utilisation préopératoire de prostaglandines.4 Chez les patients présentant des caractéristiques à haut risque, comme le diabète sucré, ou dans les cas compliqués, l’incidence peut être beaucoup plus élevée. (Heier JS, et al. Characteristics of patients with CME following phacoemulsification. Présenté à la réunion annuelle de l’Académie américaine d’ophtalmologie ; novembre 2007 ; Nouvelle-Orléans, LA.)
Mécanisme
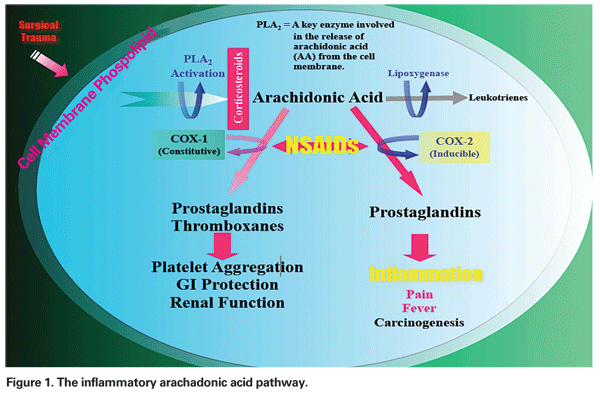
Le mécanisme par lequel l’OMCP se développe peut être multifactoriel, ayant à des degrés divers des composantes inflammatoires et mécaniques. La manipulation chirurgicale du segment antérieur déclenche la libération d’acide arachadonique par les membranes cellulaires, ce qui entraîne la production de prostaglandines et de leucotriènes via les voies de la cyclo-oxygénase (COX) et de la lipoxygénase (LOX), respectivement (voir figure 1). Ces médiateurs inflammatoires augmentent la vasoperméabilité, entraînant ainsi le développement de la PCME.
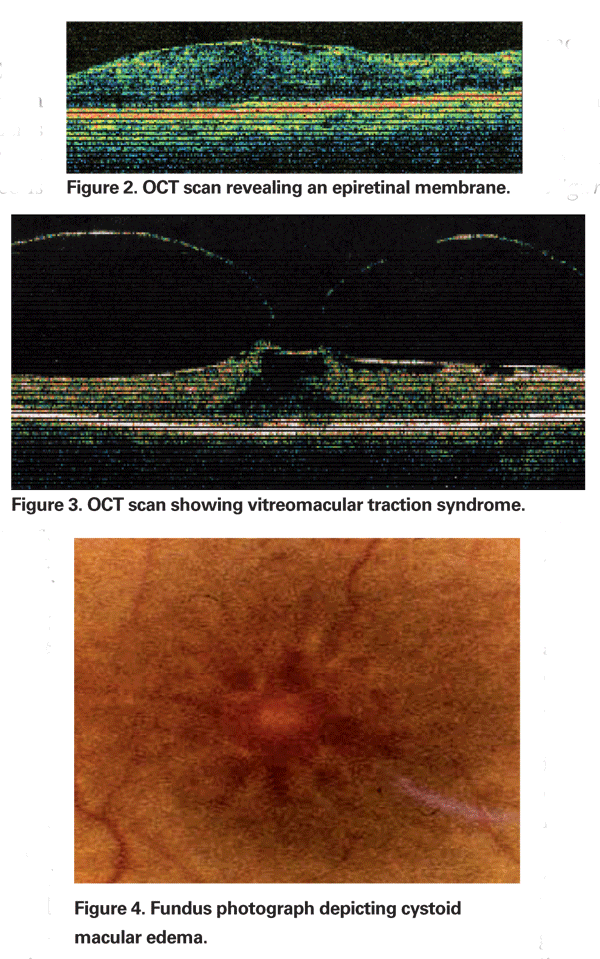
Occasionnellement, l’inflammation produite par l’extraction de la cataracte peut provoquer une contraction de la face hyaloïde postérieure, entraînant une distorsion des capillaires parafovéaux et un œdème maculaire résultant. L’utilisation croissante de la tomographie par cohérence optique est devenue un élément important de l’évaluation de l’OMCP. Les images OCT sont utiles pour identifier une composante mécanique de l’ECM, notamment une traction vitréomaculaire ou des membranes épirétiniennes (voir figures 2 & 3).
Dans de rares cas d’OMCP chronique et réfractaire chez des patients à faible risque sans autre étiologie identifiable, l’œil doit être examiné de près pour détecter des fragments de lentille retenus, une malposition de la LIO ou la présence d’une infection à Propionibacterium acnes.
Diagnostic
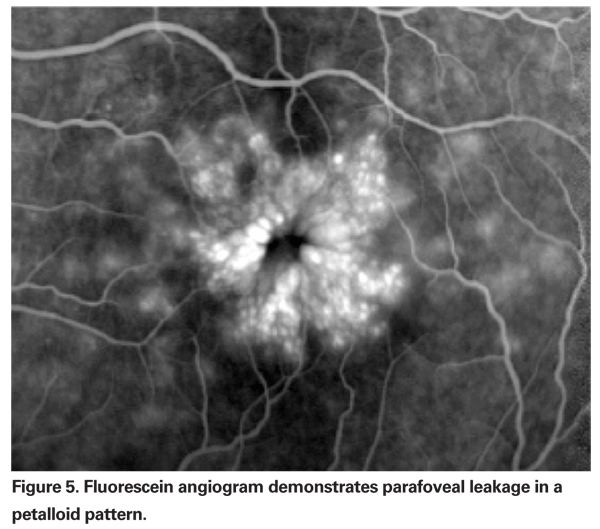
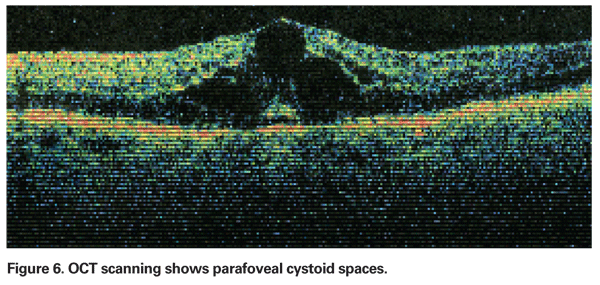
L’EPPC doit être suspecté lorsqu’un patient sans facteurs de risque sous-jacents se plaint d’une baisse de la vision ou d’une métamorphopsie après l’extraction de la cataracte. Cliniquement, on peut observer un œdème intra-rétinien contenu dans des espaces de type kyste en forme de nid d’abeille autour de la fovéa (voir figure 4). Sur l’angiographie à la fluorescéine, on peut voir un motif pétalloïde de fuite dans les espaces intra-rétiniens parafovéaux, ainsi qu’une hyperfluorescence de la papille optique (voir figure 5). L’OCT peut clairement montrer ces espaces cystoïdes et calculer l’épaisseur maculaire centrale et le volume maculaire total (voir figure 6). Les avantages de l’OCT sont sa grande sensibilité, son caractère non invasif, la livraison d’informations anatomiques et sa capacité à quantifier l’œdème maculaire, bien que la corrélation entre ces valeurs et la fonction visuelle soit discutable.
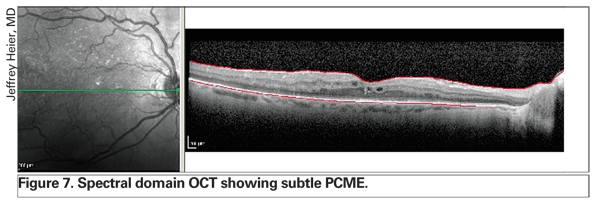
L’utilisation de l’OCT révolutionne la gestion de l’œdème rétinien. Les technologies les plus récentes, notamment l’OCT à domaine spectral, offrent une meilleure résolution et peuvent détecter les PCME subtils plus tôt que la biomicroscopie à lampe à fente et l’angiographie à la fluorescéine (voir la figure 7). En outre, cette instrumentation améliorée permet au clinicien de faire la distinction entre l’œdème exclusivement intrarétinien et le liquide épithélial sous-rétinien ou sous-pigmentaire, ce qui peut fournir des informations pronostiques (voir figure 8). Selon l’expérience de plusieurs spécialistes de la rétine, la présence d’un décollement de l’épithélium pigmentaire sous-fovéal peut laisser présager un pronostic plus défavorable.
Prévention
Il y a eu plusieurs revues rétrospectives et essais prospectifs évaluant l’effet des anti-inflammatoires prophylactiques nonanti-inflammatoires non stéroïdiens prophylactiques sur les taux de PCME lorsqu’ils sont utilisés en préopératoire par rapport à ceux utilisés en postopératoire. Dans un rapport, trois jours de prétraitement avec du kétorolac trométhamine (Acular) étaient supérieurs aux gouttes administrées une heure avant la chirurgie.6 Comparé au traitement avec des corticostéroïdes postopératoires seuls, un autre groupe a rapporté une réduction de la PCME de 12 pour cent à 0 pour cent avec deux jours de diclofénac sodique préopératoire (Voltaren) et une combinaison diclofénac/corticostéroïde postopératoire5.
En utilisant l’OCT pour quantifier le volume maculaire, les chercheurs ont constaté que deux jours de traitement préopératoire avec du kétorolac et un traitement combiné postopératoire utilisant du kétorolac/stéroïde ont conduit à une réduction de 46 pour cent du gonflement maculaire un mois après la chirurgie par rapport à un groupe de contrôle avec stéroïde seul7. Récemment, un essai prospectif randomisé comparant trois jours de kétorolac préopératoire et de thérapie combinée à un corticostéroïde seul a rapporté que, sur la base de l’OCT, les patients du groupe témoin avaient une incidence de 2,4 % de PCME contre 0 % dans la cohorte combinée8. Bien que les patients du groupe corticostéroïde aient eu une incidence significativement plus élevée d’épaississement rétinien ≥15 µm, il n’y avait pas de différence statistique dans l’acuité visuelle la mieux corrigée entre les deux groupes quatre semaines après la chirurgie.
Dans une évaluation prospective de trois groupes assignés à l’indométhacine topique pendant trois jours en préopératoire suivie d’une thérapie combinée, à la thérapie combinée postopératoire uniquement, ou à la corticothérapie uniquement, l’incidence de la PCME angiographique a été réduite de 32.8 pour cent (corticostéroïde seul) à 15 pour cent (combinaison postopératoire) et à 0 pour cent (AINS pré et postopératoire).9
Un autre rapport indique que l’ajout de népafénac sodique (Nevanac) à un régime de corticostéroïdes postopératoires a réduit le taux de PCME de 2,1 pour cent à 0 pour cent par rapport au corticostéroïde seul.10 Une récente comparaison prospective randomisée entre le diclofénac seul et la bétaméthasone en postopératoire a révélé que, cinq semaines après la chirurgie, l’incidence de l’ECM angiographique était plus faible dans le groupe AINS (18,8 pour cent) que dans le groupe corticostéroïdes (58,0 pour cent).11
Ces études montrent que l’utilisation prophylactique des AINS réduit l’incidence de la PCME, et que leur efficacité est maximale lorsqu’ils sont commencés au moins trois jours avant l’opération et poursuivis en postopératoire pendant plusieurs semaines. Cependant, le moment exact et la durée du traitement préopératoire et postopératoire, ainsi que l’identification des patients qui en bénéficieraient le plus, restent encore indéterminés.
Caractéristiques à haut risque
Comme mentionné précédemment, dans une série de 1,659 cas consécutifs, la membrane épirétinienne, des antécédents d’occlusion veineuse ou l’utilisation préopératoire d’analogues de la prostaglandine augmentaient considérablement le risque de développement de l’OMCP.4 Lors de l’examen d’une série de patients consécutifs adressés à une clinique de la rétine pour la gestion de l’OMFC, un autre groupe a trouvé que les caractéristiques à haut risque étaient le diabète sucré, l’hypertension, une chirurgie oculaire antérieure, une membrane épirétinienne et une extraction de cataracte compliquée. (Heier JS, et al.) Étant donné qu’une variété de maladies médicales et oculaires peuvent prédisposer les patients au développement de la PCME, l’identification de ces patients et un traitement prophylactique agressif avec des AINS topiques devraient être utilisés pour réduire le risque de développer la PCME.
Traitements
– AINS. Cette classe de médicaments inhibe la production de prostaglandines via l’inhibition de la voie COX (voir figure 1). Comme les AINS n’ont aucun effet sur les niveaux de prostaglandines préformées ou existantes, un traitement avant un traumatisme chirurgical est essentiel. Dans un article de synthèse récent, l’auteur a recommandé un traitement préopératoire par AINS pendant deux jours chez les patients à faible risque et une semaine chez les patients à haut risque, avec une poursuite pendant au moins quatre semaines après l’opération dans les deux groupes.12
Des questions subsistent quant à savoir quel AINS est le plus efficace pour prévenir ou traiter la PCME.
Les AINS de nouvelle génération, tels que le bromfénac sodique (Xibrom) et le népafénac, présentent des modifications de leur structure chimique, ce qui augmente leur pénétration oculaire et leur puissance théorique.13 Des essais in vitro ont révélé que la puissance relative de l’inhibition de la COX-2 est 18 fois plus importante pour le bromfénac que pour le kétorolac, bien que la signification clinique de ces données soit inconnue14. Une étude de pharmacocinétique in vivo a révélé que les concentrations dans l’humeur aqueuse du népafénac (népafénac plus amfénac) disponible dans le commerce sont significativement plus élevées que celles du bromfénac ou du kétorolac.15 Cependant, on ne sait pas si ces différences de pénétration se traduisent par une amélioration des résultats cliniques. Bien que de nombreuses allégations marketing laissent entendre que la meilleure pénétration, les modifications structurelles et la plus grande puissance proposée des AINS de nouvelle génération se traduisent par une efficacité clinique accrue, aucune étude définitive n’a été réalisée pour le confirmer.
– Traitement combiné. Un essai prospectif randomisé, à double insu, évaluant le kétorolac versus la prednisolone par rapport à la thérapie combinée pour la PCME cliniquement significative a révélé que les patients recevant la thérapie combinée ont atteint un changement moyen de ≥2 lignes de vision lors de leur deuxième visite, alors que les patients des deux groupes de monothérapie n’ont jamais atteint une amélioration moyenne de deux lignes lors du suivi de trois mois16. Les patients traités soit par le traitement combiné, soit par le kétorolac seul, ont également répondu plus rapidement que les patients du groupe prednisolone.
– Injections de corticostéroïdes. Les corticostéroïdes agissent plus en amont dans la même voie que les AINS, en inhibant la libération de l’acide arachadonique à partir des phospholipides de la membrane cellulaire, empêchant ainsi la formation à la fois des leucotriènes et des prostaglandines (voir figure 1).
Le débat se poursuit concernant la voie d’administration la plus efficace (sous-ténonienne ou intravitréenne), la posologie optimale (4 mg ou plus) et la sécurité du patient (risques d’hypertension oculaire, de décollement de la rétine, d’hémorragie vitréenne et d’endophtalmie).
Il n’existe actuellement aucun essai clinique randomisé évaluant ces modes de traitement, et les résultats publiés semblent contradictoires.
Un groupe de chercheurs a constaté que la triamcinolone intravitréenne pour le PCME persistant entraînait une amélioration de l’acuité visuelle, une diminution de l’épaisseur maculaire et une augmentation des valeurs de l’électrorétinogramme multifocal17. Un autre groupe a rapporté que l’utilisation de 4 mg d’IVTA dans la PCME réfractaire chronique a entraîné une amélioration anatomique et fonctionnelle un mois après l’injection et qui a persisté pendant au moins trois mois.18 Cependant, l’effet bénéfique était temporaire car l’acuité visuelle et l’épaisseur maculaire sont revenues aux niveaux d’avant l’injection malgré de multiples traitements. Dans une autre petite série encore, les patients ont maintenu une amélioration de l’acuité et une diminution de l’épaisseur maculaire après une dose unique de 4 mg d’IVTA pour une PCME réfractaire.19
– Acétazolamide. L’acétazolamide augmente le transport des fluides sous-rétiniens et il a été démontré qu’il supprime l’œdème cystoïde fovéal dans des troubles tels que la rétinite pigmentaire, l’aphakie et la formation d’une membrane épirétinienne maculaire.20-23 Il existe une poignée de rapports de cas corrélant la résolution de la PCME avec l’utilisation d’acétazolamide par voie orale, mais à ce jour, aucun essai clinique n’a été réalisé.
– Agents anti-facteur de croissance endothélial vasculaire. Les traumatismes chirurgicaux entraînent une inflammation postopératoire qui peut conduire à une PCME par une augmentation de la production de facteurs vasoperméables tels que le facteur de croissance endothélial vasculaire. Là encore, de petites séries de cas fournissent des preuves contradictoires. Après une injection intravitréenne de bevacizumab (Avastin), un groupe a constaté que 71 pour cent des patients gagnaient deux lignes ou plus de vision ETDRS;24 et un autre a rapporté que tous les yeux de sa série avaient une amélioration statistiquement significative de la vision.25 Cependant, une autre étude a rapporté que le bevacizumab intravitréen n’améliorait pas l’acuité visuelle chez les patients atteints de PCME.26
– Vitrectomie. La vitrectomie pars plana avec décollement de la membrane peut être envisagée en cas d’OMFC avec une composante mécanique identifiée soit à l’examen clinique soit par OCT, ou en cas d’œdème chronique réfractaire ne répondant pas au traitement médical. Dans une petite série, l’intervention chirurgicale a entraîné une amélioration de plus de trois lignes de la meilleure acuité visuelle corrigée chez la plupart des patients, et la résolution de l’OMFC dans tous les cas.27 Il existe également des rapports de cas dans la littérature indiquant une amélioration visuelle après une vitrectomie et un pelage de la membrane limitante interne.28 Comme mentionné précédemment, la vitrectomie pars plana doit être envisagée en cas de rétention de fragments de lentille, de malposition de la LIO ou d’infection par P. acnes.
Directives futures
Comme mentionné précédemment, les corticostéroïdes agissent au début de la cascade inflammatoire. Posurdex (Allergan) est un système biodégradable d’administration prolongée de dexaméthasone qui est implanté dans la cavité vitréenne. Sa matrice polymère se transforme progressivement en acides lactique et glycolique, qui sont à leur tour décomposés en eau et en dioxyde de carbone. Dans une étude de phase II, 54 % des patients souffrant de PCME et de CME associé à une uvéite ont présenté une amélioration d’au moins 10 lettres d’acuité au 90e jour post-implantation, contre seulement 14 % présentant un résultat similaire dans le groupe d’observation.
Récemment, la FDA a approuvé Triesence (Alcon), de l’acétonide de triamcinolone, pour une injection intravitréenne pendant la chirurgie. Ce médicament peut être utilisé hors AMM dans l’algorithme de traitement de la PCME récalcitrante.
Il est évident que la définition de la PCME a évolué au cours des dernières années. Avec environ 3 millions de chirurgies de la cataracte réalisées aux États-Unis par an et des attentes accrues de la part des patients, il est important que les spécialistes de la rétine comprennent la pathogenèse variée, les facteurs de risque et la gestion appropriée de la PCME. Les nouvelles technologies ont et vont révolutionner le diagnostic, le pronostic et le traitement de cette affection.
Les auteurs exercent au Retinal Consultants of Arizona, à Phoenix. Le Dr Jamal exerce également au Texas Retina Associates, à Dallas, et le Dr Goldenberg exerce à Associated Retinal Consultants, Royal Oak, Michigan. Contactez le Dr Dugel à pdugel @gmail.com.
1. Irvine SR. Un syndrome vitréen nouvellement défini après une chirurgie de la cataracte. Am J Ophthalmol 1953 ; 36:599-619.
2. Gass JD, Norton EW. Étude de suivi de l’œdème maculaire cystoïde après l’extraction de la cataracte. Trans Am Acad Ophthalmol Otolaryngol 1969;73(4):665-82.
3. Wright PL, Wilkinson CP, Balyeat HD, et al. Œdème maculaire cystoïde angiographique après implantation de lentilles de chambre postérieure. Arch Ophthalmol 1988;106:740-744.
4. Henderson BA, Kim JY, Ament CS, et al. Clinical pseudophakic cystoid macular edema. Risk factors for development and duration after treatment. J Cataract Refract Surg 2007;33:1550-8.
5. McColgin AZ, Raizman MB. Efficacité du Voltaren topique dans la réduction de l’incidence de l’œdème maculaire cystoïde postopératoire. Invest Ophthmol Vis Sci 1999;40 S289.
6. Donnenfeld ED, Perry HD, Wittpenn JR, et al. Kétorolac trométhamine 0,4 pour cent préopératoire dans les résultats de la phacoémulsification : Pharmacokinetic-response curve. J Cataract Refract Surg 2006;32:1474-82.
7. Almeida DR, Johnson D, Hollands H, Smallman D, et al. Effet des anti-inflammatoires non stéroïdiens prophylactiques sur l’œdème maculaire cystoïde évalué par quantification du volume maculaire total par tomographie par cohérence optique après une chirurgie de la cataracte. J Cataract Refract Surg 2008;34:64-9.
8. Wittpenn JR, Silverstein S, Heier J, et al. A Randomized, Masked Comparison of Topical Ketorolac 0.4 percent Plus Steroid vs Steroid Alone in Low-Risk Cataract Surgery Patients. Am J Ophthalmol 2008 ; 146:554 -560.
9. Yavas GF, Oztürk F, Küsbeci T. Preoperative topical indomethacin to prevent pseudophakic cystoid macular edema. J Cataract Refract Surg 2007;33:804-7.
10. Wolf EJ, Braunstein A, Shih C, et al. Incidence d’un œdème maculaire pseudophaque visuellement significatif après une phacoémulsification sans incident chez des patients traités au népafénac. J Cataract Refract Surg 2007;33:1546-1549.
11. Asano S, Miyake K, Ota I, et al. Réduction de l’œdème maculaire cystoïde angiographique et de la rupture de la barrière hémato-aqueuse après une phacoémulsification à petite incision et l’implantation d’une lentille intraoculaire pliable : Multicenter prospective randomized comparison of topical diclofenac 0.1 percent and betamethasone 0.1 percent. J Cataract Refract Surg 2008;34:57-63.
12. O’Brien TP. Lignes directrices émergentes pour l’utilisation de la thérapie AINS pour optimiser les soins aux patients de la chirurgie de la cataracte. Curr Med Res & Opin. 2005;21:1131-1137.
13. Walsh DA, Moran HW, Shamblee DA, et al. Agents anti-inflammatoires 3. Synthèse et évaluation pharmacologique de l’acide 2-amino-3-benzoylphénylacétique et de ses analogues. J Medicinal Chem 1984;27:1379-1388.
14. Waterbury LD, Silliman D, Jolas T. Comparaison de l’activité inhibitrice de la cyclooxygénase et des effets anti-inflammatoires oculaires du kétorolac trométhamine et du bromfénac sodique. Curr Med Res Opin 2006;22 : 1133-1140.
15. Walters TR, Raizman M, Ernest P, et al. Pharmacocinétique in vivo et pharmacodynamique in vitro du népafénac, de l’amfénac, du kétorolac et du bromfénac. J Cataract Refract Surg 2007;33;1539-1545.
16. Heier JS, Topping TM, Baumann W, et al. Ketorolac versus prednisolone versus thérapie combinée dans le traitement de l’œdème maculaire cystoïde pseudophaque aigu. Ophthalmology 2000;107:2034-8.
17. Koutsandrea C, Moschos MM, Brouzas D, et al. L’acétonide de triamcinolone intraoculaire pour l’œdème maculaire cystoïde pseudophaque : Étude par tomographie par cohérence optique et électrorétinographie multifocale. Retina 2007;27:159-64.
18. Boscia F, Furino C, Dammacco R, et al. L’acétonide de triamcinolone intravitréen dans l’œdème maculaire cystoïde pseudophaque réfractaire : Résultats fonctionnels et anatomiques. Eur J Ophthalmol 2005;15:89-95.
19. Karacorlu M, Ozdemir H, Karacorlu S. Intravitreal triamcinolone acetonide for the treatment of chronic pseudophakic cystoid macular oedema. Acta Ophthalmol Scand 2003;81:648-52.
20. Marmor MF. Hypothèse concernant le traitement par anhydrase carbonique de l’EMC : exemple avec la membrane épirétinienne. Arch Ophthalmol 1990;108:1524-1525.
21. Cox SN, Hay E, Bird AC. Traitement de l’œdème maculaire chronique avec l’acétazolamide. Arch Ophthalmol 1988;106:1190-1195.
22. Fishman GA, Gilbert COT, Fiscella RG et al. L’acétazolamide pour le traitement de l’œdème maculaire chronique dans la rétinite pigmentaire. Arch Ophthalmol 1989;107:1445-1452.
23. Wolfensberger TJ, Chiang R, Takeuchi A et al. L’inhibition de la carbonic anhydrase liée à la membrane améliore l’absorption du liquide sous-rétinien et l’adhésivité de la rétine. Graefe’s Arch Clin Exp Ophthalmol 2000 ; 238:76-80.
24. Arevalo JF, Garcia-Amaris RA, Roca JA, et al. Bevacizumab intravitréen primaire pour la gestion de l’œdème maculaire cystoïde pseudophaque : Étude pilote du Pan-American Collaborative Retina Study Group. J Cataract Refract Surg. 2007;33:2098-105.
25. Barone A, Russo V, Prascina F, et al. Sécurité et efficacité à court terme du bevacizumab intravitréen pour l’œdème maculaire cystoïde pseudophaque. Retina 2008 Oct 9.
26. Spitzer MS, Ziemssen F, Yoeruek E, et al. Efficacité du bevacizumab intravitréen dans le traitement de l’œdème maculaire cystoïde pseudophaque postopératoire. J Cataract Refract Surg 2008;34:70-5.
27. Pendergast SD, Margherio RR, Williams GA, et al. Vitrectomie pour un œdème maculaire cystoïde pseudophaque chronique. Am J Ophthalmol 1999;128:317-23.
28. Peyman GA, Canakis C, Livir-Rallatos C, et al. The effect of internal limiting membrane peeling on chronic recalcitrant pseudophakic cystoid macular edema : A report of two cases. Am J Ophthalmol 2002;133:571-2.
.