 Yoshinori Ohsumi
Yoshinori OhsumiEn 2016, l’Assemblée Nobel du Karolinska Institutet a décerné le prix Nobel de physiologie ou de médecine à Yoshinori Ohsumi pour ses découvertes des mécanismes de l’autophagie.
Mais qu’est-ce que l’autophagie ? Le mot dérive du grec auto (soi) et phagein (manger). Le mot signifie donc littéralement se manger soi-même. Essentiellement, il s’agit du mécanisme du corps pour se débarrasser de toute la machinerie cellulaire dégradée et ancienne (organelles, protéines et membranes cellulaires) lorsqu’il n’y a plus assez d’énergie pour la soutenir. C’est un processus régulé et ordonné de dégradation et de recyclage des composants cellulaires.

Il existe un processus similaire, mieux connu, appelé apoptose également appelé mort cellulaire programmée. Les cellules, après un certain nombre de divisions, sont programmées pour mourir. Bien que cela puisse paraître un peu macabre au premier abord, il faut savoir que ce processus est essentiel au maintien d’une bonne santé. Par exemple, supposons que vous possédiez une voiture. Vous aimez cette voiture. Vous avez de bons souvenirs avec elle. Vous aimez la conduire.
Mais après quelques années, elle commence à avoir l’air un peu abîmée. Après quelques autres, elle n’a pas l’air très bien. La voiture vous coûte des milliers de dollars chaque année à entretenir. Elle tombe en panne tout le temps. Est-il préférable de la garder alors qu’elle n’est plus qu’un tas de ferraille ? De toute évidence, non. Alors vous vous en débarrassez et vous achetez une nouvelle voiture tape-à-l’œil.
La même chose se produit dans le corps. Les cellules deviennent vieilles et junkies. Il est préférable qu’elles soient programmées pour mourir lorsque leur vie utile est terminée. Cela semble vraiment cruel, mais c’est la vie. C’est le processus d’apoptose, où les cellules sont prédestinées à mourir après un certain temps. C’est comme louer une voiture. Après un certain temps, vous vous débarrassez de la voiture, qu’elle fonctionne encore ou non. Ensuite, vous achetez une nouvelle voiture. Vous n’avez pas à vous inquiéter qu’elle tombe en panne au pire moment.
Autophagie – remplacer les anciennes parties de la cellule
Le même processus se produit également au niveau subcellulaire. Vous n’avez pas nécessairement besoin de remplacer toute la voiture. Parfois, vous avez juste besoin de remplacer la batterie, de jeter l’ancienne et d’en obtenir une nouvelle. Cela se produit également dans les cellules. Au lieu de tuer toute la cellule (apoptose), vous voulez seulement remplacer certaines parties de la cellule. C’est le processus d’autophagie, au cours duquel les organelles subcellulaires sont détruites et de nouvelles sont reconstruites pour les remplacer. Les vieilles membranes cellulaires, les organelles et autres débris cellulaires peuvent être éliminés. Cela se fait en les envoyant vers le lysosome qui est un organite spécialisé contenant des enzymes pour dégrader les protéines.
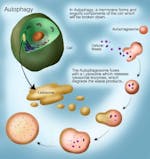
L’autophagie a été décrite pour la première fois en 1962 lorsque des chercheurs ont noté une augmentation du nombre de lysosomes (la partie de la cellule qui détruit les choses) dans des cellules de foie de rat après avoir perfusé du glucagon. Le scientifique Christian de Duve, lauréat du prix Nobel, a inventé le terme « autophagie ». Les parties subcellulaires endommagées et les protéines inutilisées sont marquées pour être détruites, puis envoyées dans les lysosomes pour finir le travail.
L’un des principaux régulateurs de l’autophagie est la kinase appelée cible mammalienne de la rapamycine (mTOR). Lorsque mTOR est activée, elle supprime l’autophagie, et lorsqu’elle est dormante, elle la favorise.
Qu’est-ce qui active l’autophagie ?
La privation de nutriments est l’activateur clé de l’autophagie. Rappelez-vous que le glucagon est en quelque sorte l’hormone opposée à l’insuline. C’est comme le jeu auquel nous jouions quand nous étions enfants – » le jour opposé « . Si l’insuline augmente, le glucagon diminue. Si l’insuline diminue, le glucagon augmente. Lorsque nous mangeons, l’insuline augmente et le glucagon diminue. Lorsque nous ne mangeons pas (jeûne), l’insuline diminue et le glucagon augmente. Cette augmentation du glucagon stimule le processus d’autophagie. En fait, le jeûne (qui augmente le glucagon) fournit le plus grand coup de pouce connu à l’autophagie.
Le jeûne est en fait bien plus bénéfique que la simple stimulation de l’autophagie. Il fait deux bonnes choses. En stimulant l’autophagie, nous nous débarrassons de toutes nos protéines et parties cellulaires anciennes et encombrantes. Dans le même temps, le jeûne stimule l’hormone de croissance, qui indique à notre corps de commencer à produire de nouvelles parties de son corps. Nous donnons vraiment à notre corps la rénovation complète.
Vous devez vous débarrasser des vieilles choses avant de pouvoir mettre de nouvelles choses. Pensez à la rénovation de votre cuisine. Si vous avez de vieilles armoires vert lime style années 1970 qui traînent, vous devez les mettre au rebut avant d’en mettre de nouvelles. Le processus de destruction (retrait) est donc tout aussi important que le processus de création. Si vous essayez simplement d’installer de nouvelles armoires sans enlever les anciennes, ce ne sera pas très joli. Ainsi, le jeûne peut, d’une certaine manière, inverser le processus de vieillissement, en se débarrassant des vieilleries cellulaires et en les remplaçant par de nouvelles pièces.
Un processus hautement contrôlé
L’autophagie est un processus hautement régulé. S’il s’emballe, hors de contrôle, cela serait préjudiciable, il doit donc être soigneusement contrôlé. Dans les cellules de mammifères, l’épuisement total des acides aminés est un signal fort pour l’autophagie, mais le rôle des acides aminés individuels est plus variable. En revanche, les taux plasmatiques d’acides aminés ne varient que très peu. On pense que les signaux des acides aminés et les signaux des facteurs de croissance / de l’insuline convergent vers la voie mTOR – parfois appelée le régulateur principal de la signalisation des nutriments.
Donc, au cours de l’autophagie, les anciens composants cellulaires sont décomposés en acides aminés constitutifs (l’élément constitutif des protéines). Qu’advient-il de ces acides aminés ? Dans les premiers stades de la famine, les niveaux d’acides aminés commencent à augmenter. On pense que ces acides aminés issus de l’autophagie sont acheminés vers le foie pour la gluconéogenèse. Ils peuvent également être décomposés en glucose par le cycle de l’acide tricarboxylique (TCA). Le troisième destin potentiel des acides aminés est d’être incorporés dans de nouvelles protéines.
Les conséquences de l’accumulation de vieilles protéines junky un peu partout peuvent être observées dans deux conditions principales – la maladie d’Alzheimer (AD) et le cancer. La maladie d’Alzheimer implique l’accumulation de protéines anormales – soit la protéine amyloïde bêta, soit la protéine Tau qui gomme le système cérébral. Bien que nous n’ayons pas encore de preuves d’essais cliniques à ce sujet, il serait logique qu’un processus comme l’autophagie qui a la capacité d’éliminer les vieilles protéines puisse prévenir le développement de la MA.
Qu’est-ce qui désactive l’autophagie ? En mangeant . Le glucose, l’insuline (ou la diminution du glucagon) et les protéines désactivent tous ce processus d’auto-nettoyage. Et il n’en faut pas beaucoup. Même une petite quantité d’acide aminé (leucine) peut stopper net l’autophagie. Ce processus d’autophagie est donc unique au jeûne – quelque chose que l’on ne retrouve pas dans la simple restriction calorique ou les régimes alimentaires.
Il y a un équilibre ici, bien sûr. On tombe malade à cause de trop d’autophagie comme à cause de trop peu. Ce qui nous ramène au cycle naturel de la vie – festin et jeûne. Pas de régime constant. Cela permet la croissance cellulaire pendant l’alimentation, et le nettoyage cellulaire pendant le jeûne – l’équilibre. La vie est une question d’équilibre.
–
Jason Fung