Rapport de cas
Gestion de l’endomètre prolifératif sur biopsie chez les femmes postménopausées
Sidharth Srinivas1, Sachchidananda Maiti2, Perunkulam Jothilakshmi2
1Manchester Medical School, Université de Manchester, Manchester, Royaume-Uni
2Obstetrics & Gynécologie, The Pennine Acute NHS Hospitals, Crumpsall, Royaume-Uni
Adresse électronique :
 (S. Srinivas)
(S. Srinivas) Pour citer cet article :
Sidharth Srinivas, Sachchidananda Maiti, Perunkulam Jothilakshmi. Gestion de l’endomètre prolifératif sur biopsie chez les femmes ménopausées. Journal of Gynecology and Obstetrics. Vol. 4, n° 6, 2016, p. 38-43. doi : 10.11648/j.jgo.20160406.12
Reçu : 4 septembre 2016 ; Accepté : 21 septembre 2016 ; Publié : 15 octobre 2016
Abstrait : Les saignements post-ménopausiques (SPM) sont généralement causés par plusieurs pathologies endométriales (hyperplasie et carcinome) pour lesquelles il existe des traitements fondés sur des preuves. Cependant, il existe peu de littérature et aucun traitement fondé sur des preuves concernant la découverte d’un endomètre prolifératif sans atypie sur la biopsie endométriale Pipelle chez les femmes présentant des saignements post-ménopausiques. Notre objectif est d’explorer la gestion et les options de traitement pour ce sous-groupe de femmes. Il s’agit d’une étude rétrospective et observationnelle d’une série de cas de femmes présentant une PMB dans une clinique d’accès rapide en gynécologie d’un hôpital général de district à Manchester, au Royaume-Uni, sur une période de trois semaines. Quatre femmes dont la biopsie endométriale par pipelle a révélé un endomètre prolifératif ou sécrétoire ont été choisies. Leur histoire, les résultats de l’examen, les investigations, le traitement et les résultats du suivi ont ensuite été analysés. Cette série de cas a permis d’identifier le dilemme de gestion posé par les patientes présentant un endomètre prolifératif sans atypie sur le prélèvement endométrial. Les quatre patientes ont été suivies par une biopsie endométriale Pipelle répétée six semaines après leur présentation à l’unité de gynécologie spécialisée. Elles ont ensuite été conseillées ou traitées par un traitement à base de progestérone orale pendant six à huit semaines. Les options de prise en charge comprenaient le système intra-utérin (SIU) Mirena, le traitement par progestérone orale et le retour de la patiente aux soins primaires. Il n’existe pas de consensus sur l’importance de la progestérone orale ou sur la durée du suivi nécessaire pour surveiller le développement d’une hyperplasie ou d’un cancer de l’endomètre chez ce sous-ensemble de patientes. D’autres recherches sont nécessaires pour élaborer des directives de prise en charge, fondées sur des preuves, de l’endomètre prolifératif chez les femmes atteintes de PMB.
Mots-clés : Saignements post-ménopausiques, endomètre prolifératif sans atypie, traitement par progestérone
1. Introduction
Les saignements post-ménopausiques sont une présentation importante et fréquente en clinique gynécologique. Des examens urgents sont nécessaires pour exclure le cancer de l’endomètre – la tumeur maligne gynécologique la plus fréquente au Royaume-Uni . Les causes bénignes telles que la vaginite atrophique, les polypes et les fibromes sont également susceptibles de causer un stress important à la patiente. Un diagnostic histologique d’hyperplasie endométriale augmente le risque de malignité et un traitement est nécessaire pour induire une régression. En revanche, un diagnostic histologique d’endomètre prolifératif sans cellules atypiques laisse les cliniciens sans traitement fondé sur des preuves et avec une incertitude quant à son potentiel de transformation maligne.
Dans ce rapport, nous avons analysé quatre cas de PMB dont les investigations ont trouvé un endomètre prolifératif à l’histologie. Cette série de cas est intéressante car il y a peu de preuves dans la littérature sur l’endomètre prolifératif chez les femmes post-ménopausées présentant un symptôme de PMB, et par conséquent aucun traitement basé sur des preuves. Ce rapport identifiera les zones d’incertitude dans notre compréhension et notre gestion de ces patients.
Méthodes
Il s’agit d’une série de cas rétrospective et observationnelle examinant les femmes se présentant avec une PMB à une clinique d’accès rapide (RAC) de gynécologie dans un hôpital général de district à Manchester sur une période de 3 semaines en novembre 2014. Quatre patientes chez qui on a trouvé un endomètre prolifératif ou sécrétoire lors d’un prélèvement endométrial avec un dispositif Pipelle ont été choisies au hasard. Les femmes ménopausées de cette série de cas ont toutes été référées en urgence aux soins secondaires après avoir connu au moins un épisode de saignement. Des femmes de tous âges ayant subi une ménopause naturelle ont été incluses dans cette série de cas. Les notes de cas ont été utilisées pour analyser l’histoire de chaque patient, les résultats des examens, les investigations, le traitement et le suivi.
2. Série de cas
Tableau 1. Aspects pertinents de l’histoire du patient.
| Patient | Age & Statut ménopausique | Motif de consultation | Symptômes associés | Antécédents médicaux | Contraception, THS & statut tamoxifène | Analyse des frottis cervicaux | |
| 1 | 54, post-ménopause depuis 2 ans | Deux épisodes de saignements abondants pendant cinq jours chacun | Un inconfort abdominal | . malaise | Nil | Nil | Normal & up-à ce jour |
| 2 | 59, post-ménopause depuis 5 ans | Dix jours de saignements vaginaux abondants avec caillots | Gêne abdominale basse et perte de poids | Diabète sucré de type 2, hypertension et calculs biliaires | GP a initié la noréthistérone pour les saignements | Normal & up-à ce jour | |
| 3 | 52, post-ménopause 1 an | Endomètre irrégulièrement épais à l’échographie en soins primaires | Saignements intermittents avec caillots et inondations | Cancer du sein, mastectomie bi-latérale et curage des ganglions axillaires | Mirena IUS et Tamoxifen il y a un an | Normal & up-à ce jour | |
| 4 | 59, post-ménopause | Huit jours de légers saignements vaginaux continus | Douleurs abdominales légères | Hypertension, hyperthyroïdie, indice de masse corporelle rasé | Nil | Inconnu |
Tableau 2. Résultats des investigations et traitement.
| Patient | Pelvic examination & TVUS | Hystéroscopie | Biopsie de la pipelle | Répétition de la biopsie pipellaire | Traitement | Durée de suiviup |
| 1 | Normal & 1.3mm | Non réalisé | Endomètre prolifératif sans atypie ni malignité | Endomètre sécrétoire sans atypie ni malignité | MDPA 100mg BD pendant 6 à 8 semaines | 6 semaines | 2 | Normal & 10mm | Normal à part 2.5mm | Endomètre sécrétoire sans atypie ni malignité | Endomètre prolifératif sans atypie ni malignité. endomètre sans atypie ni malignité | Conseil sur le Mirena IUS | 6 semaines |
| 3 | Normal & 2mm | Non réalisé | Endomètre prolifératif sans atypie ni malignité | Endomètre prolifératif sans atypie ni malignité | Nil | 8 semaines |
| 4 | Normal & 10mm | Normal à part un petit polype | Proliférant endomètre sans atypie ni malignité | Endomètre prolifératif sans atypie ni malignité | MDPA 100mg BD pendant 6 à 8 semaines | 8 semaines |
3. Discussion
3.1. Modifications de l’endomètre pendant la ménopause
Un endomètre qui s’atrophie et perd sa couche fonctionnelle, avec un stroma endométrial qui devient fibreux et des glandes qui ne montrent aucune activité proliférative ou sécrétoire – est l’image acceptée de l’endomètre post-ménopausique . Cette régression de l’endomètre coïncide avec l’arrêt des menstruations ; par conséquent, lorsque des saignements surviennent, il faut exclure toute pathologie. La physiologie de l’endomètre post-ménopausique et son rôle dans la pathologie pelvienne ont suscité de l’intérêt au cours des dernières décennies, en particulier en ce qui concerne les précurseurs du carcinome de l’endomètre. Cependant, il y a beaucoup moins de littérature sur l’endomètre post-ménopausique par rapport à l’endomètre pendant la vie reproductive.
Dans l’ensemble, les études ont montré que les trois quarts des femmes post-ménopausées semblent avoir un endomètre atrophié avec des degrés variables de glandes kystiques dilatées. Quinze autres pour cent présentent des polypes endométriaux composés de glandes kystiques. Les 10 % restants sont constitués d’endomètres présentant une prolifération et une hyperplasie. L’atrophie endométriale est observée au cours de la première année de la ménopause et son incidence reste constante tout au long de la ménopause. Contrairement aux cas de prolifération et d’hyperplasie qui sont observés principalement dans les 5 premières années après la ménopause.
En 1954, McBride a analysé l’endomètre post-ménopausique dans une vaste étude ; en prélevant des échantillons par curetage sur 1 521 patientes à différentes périodes après la ménopause. Dans 1 315 échantillons, on n’a obtenu que du mucus, tandis que les 206 cas restants présentaient les profils endométriaux suivants : atrophie, glande kystique unique ou diffuse, hyperplasie, prolifération, polypes sécrétoires et fibro-adénomateux. Les résultats suggèrent que l’incidence de l’endomètre prolifératif ou sécrétoire est de 6,3 %. Cependant, l’auteur propose que lorsqu’aucun échantillon n’a été obtenu, l’endomètre était soit inactif, soit atrophié. Dans cette hypothèse, l’incidence de l’endomètre prolifératif ou sécrétoire est de 0,8%. Cela nous amène à penser que la véritable incidence d’un endomètre prolifératif ou sécrétoire se situe entre 6,3 % et 0,9 % .
Une étude portant sur les biopsies endométriales de femmes péri- et post-ménopausées sous THS continu a révélé que la majorité des endomètres sont soit atrophiques (68,7 %), soit prolifératifs (23,5 %). Alors que 0,6 % présentaient une hyperplasie simple sans atypie, 0,5 % avaient un endomètre sécrétoire et un adénocarcinome bien différencié a été trouvé dans 0,07 % des cas. Cela suggère que les femmes post-ménopausées recevant une stimulation hormonale ont une incidence plus élevée d’endomètre prolifératif.
3.2. Causes des saignements post-ménopausiques
Les saignements post-ménopausiques désignent tout saignement vaginal chez une femme post-ménopausée qui n’est pas le saignement cyclique attendu qui se produit avec un traitement hormonal substitutif séquentiel . Les PMB justifient une consultation urgente en gynécologie car 10 % de ces patientes sont atteintes d’un cancer de l’endomètre. Un diagnostic précoce du cancer de l’endomètre est important pour réduire la propagation locale et maligne et est associé à une survie allant jusqu’à 90 % . Le cancer de l’endomètre se manifeste souvent par une PMB précoce, mais la vaginite atrophique et les lésions bénignes telles que les polypes et les fibromes sont fréquentes. Une étude a révélé que jusqu’à 30% des cas de PMB révèlent une anomalie anatomique sous-jacente (voir tableau 3).
Tableau 3. Les causes anatomiques des saignements post-ménopausiques.
| Endometrium | Cervix | Vagin | Ovaire |
| Fibroïdes | Polypes | Vaginite atrophique | Cancer |
| Hyperplasie | Cancer | Cancer | |
| Polypes | |||
| Cancer | |||
| Endométrite |
3.3. Investigation des saignements post-ménopausiques
Conformément aux directives du National Institute of Clinical Excellence (NICE), trois des patientes de notre série de cas présentant une PMB, et ne prenant pas de THS, ont toutes été orientées vers les soins secondaires pour exclure un cancer . Ces patientes ont toutes été vues dans un délai de 2 semaines dans une clinique de gynécologie – ce qui correspond à l’objectif national pour les références urgentes.
Les patientes traitées par THS sont plus complexes car il peut être difficile de différencier les saignements cycliques normaux des saignements irréguliers. Les saignements utérins ou les taches lors de l’initiation du THS sont fréquents mais devraient cesser après 6 mois . Cependant, le NICE recommande une consultation urgente en cas de saignement post-ménopausique persistant ou inexpliqué après l’arrêt du THS pendant 6 semaines.
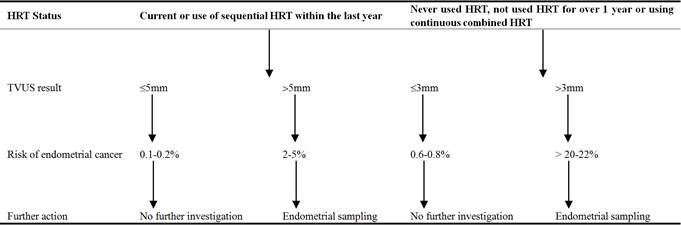
Le Scottish Intercollegiate Guidelines Network (SIGN) propose un algorithme pour l’investigation des PMB (voir tableau 4). Conformément à ces lignes directrices, les quatre patientes ont subi un examen pelvien pour rechercher toute cause bénigne de saignement, comme un ectropion cervical ou des polypes, ou pour faire naître une suspicion de malignité. Une anamnèse approfondie avec identification des facteurs de risque de cancer de l’endomètre tels que des antécédents d’anovulation chronique, d’obésité, de diabète, d’utilisation d’œstrogènes ou de tamoxifène et de syndromes génétiques est précieuse. En outre, un examen au spéculum permet aux cliniciens expérimentés de diagnostiquer les lésions vulvaires, vaginales et cervicales. Une anamnèse et un examen approfondis peuvent également faire suspecter des causes rares de saignements vaginaux, telles que des troubles de la coagulation et des leucémies.
Comme le recommande le SIGN, la TVUS a été l’examen de première ligne utilisé pour les femmes présentant des PMB dans notre série de cas. Sa base de preuves, sa commodité, son absence de complications en font une investigation idéale pour évaluer les patientes présentant un risque plus élevé de cancer . Lorsque l’endomètre est plus épais, le risque de pathologie telle que la malignité augmente, ce qui justifie un examen plus approfondi. En revanche, les femmes dont l’endomètre est mince peuvent être rassurées et rappelées pour des examens complémentaires uniquement si les saignements persistent. La fixation de la valeur seuil de l’épaisseur de l’endomètre permet d’équilibrer la nécessité d’identifier toutes les pathologies sinistres tout en minimisant la surutilisation des ressources. Fixer le seuil à 3 mm garantit une sensibilité élevée (100 %) mais compromet la spécificité (25,8 %) de l’examen, ce qui entraîne un nombre excessif de patientes à examiner. Actuellement, le seuil de 4 mm est utilisé dans la pratique clinique car il est réputé offrir une sensibilité (91,6 %) et une spécificité (44,5 %) optimales .
D’autres formes d’échographie sont disponibles, telles que le doppler transvaginal, le tridimensionnel, l’amélioration saline et la mesure de la texture de l’endomètre et l’analyse des marges. Cependant, les études n’ont pas réussi à montrer leurs avantages par rapport à la TVUS et ne sont pas recommandées ni utilisées dans la pratique clinique courante à l’heure actuelle
L’inspection directe et l’échantillonnage du tissu endométrial sont considérés comme le gold standard et la deuxième ligne d’investigation dans cette cohorte de patientes. La pratique actuelle et les directives SIGN recommandent l’utilisation de dispositifs de biopsie de l’endomètre pour approfondir l’examen des patientes jugées à risque plus élevé de cancer de l’endomètre. Conventionnellement, la dilatation & curetage était utilisée pour examiner les saignements anormaux, mais les preuves soutiennent maintenant l’utilisation de dispositifs de prélèvement de l’endomètre tels que le dispositif Pipelle – utilisé chez les quatre patientes de ma série de cas. Ce dispositif présente un taux de détection de 99,6 % pour le cancer de l’endomètre chez les femmes ménopausées, ainsi qu’une sensibilité (81 %) et une spécificité (98 %) élevées pour l’identification de l’hyperplasie atypique. En résumé, la combinaison de la TVUS et de la biopsie endométriale en Pipelle offre suffisamment d’informations diagnostiques pour diagnostiquer ou exclure les maladies endométriales bénignes et malignes .
Les patientes traitées par tamoxifène ont une incidence trois à six fois plus élevée de cancer de l’endomètre, et une orientation urgente pour ces femmes se plaignant de PMB est recommandée par le NICE . Il a été démontré que le risque de cancer et de prolifération, dû au faible effet œstrogénique du tamoxifène, augmente avec la dose et la durée du traitement. La patiente 3 de notre série de cas, une femme de 59 ans sous tamoxifène, a été examinée de manière plus approfondie au moyen d’une hystéroscopie en plus d’une TVUS et d’une biopsie par pipelle. Ceci est conforme aux directives qui suggèrent que l’hystéroscopie avec biopsie est préférable à la TVUS, car l’interprétation de l’échographie est rendue difficile par l’épaississement de l’endomètre chez les patientes sous tamoxifène.
Tableau 4. Femmes présentant des saignements post-ménopausiques (et non sous tamoxifène) .
3.4. Hyperplasie endométriale
Un diagnostic d’hyperplasie endométriale (HE) est posé chez environ 10% des femmes présentant une PMB . L’Organisation mondiale de la santé (OMS) classe l’hyperplasie de l’endomètre en types simples et complexes ; chaque type est ensuite classé en fonction de la présence ou de l’absence d’atypies nucléaires. Les femmes présentant des atypies (voir figure 2) lors de la biopsie de l’endomètre doivent faire l’objet d’un examen plus approfondi, car environ 50 % d’entre elles ont un carcinome endométrial concomitant. En outre, le risque d’évolution vers un cancer est accru en présence d’atypies (27,5 % 9 ans après le diagnostic), mais beaucoup plus faible en cas d’hyperplasie sans atypies (4,6 % 9 ans après le diagnostic). Compte tenu de la probabilité de malignité future, l’hystérectomie avec salpingo-ovariectomie bilatérale est recommandée chez les femmes post-ménopausées présentant une HE en présence d’atypies. En l’absence de cellules atypiques, les femmes peuvent être prises en charge par des progestatifs et des biopsies en série tous les 6 mois pour s’assurer de la réponse au traitement. Les progestatifs couramment utilisés sont l’acétate de mégestrol et l’acétate de médroxyprogestérone. Bien que les quatre patientes de notre série de cas ne présentent pas d’hyperplasie endométriale, on peut postuler que si des cellules atypiques avaient été trouvées, le risque de malignité et la nécessité d’effectuer d’autres examens auraient augmenté chez les patientes présentant un endomètre prolifératif ou sécrétoire.
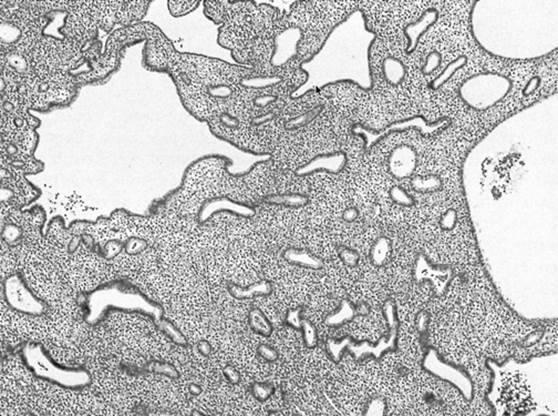
Figure 1. Une biopsie endométriale montrant une hyperplasie endométriale simple, avec des glandes endométriales réparties de manière irrégulière et largement séparées par un stroma hyperplasique.
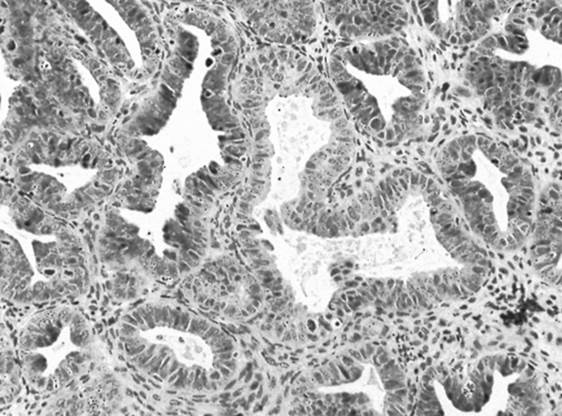
Figure 2. Une biopsie d’endomètre montrant une hyperplasie endométriale avec des cellules glandulaires atypiques .
3.5. Pathogénie de l’endomètre prolifératif
Mon rapport a identifié des femmes post-ménopausées dont les biopsies imitaient l’endomètre trouvé dans le cycle menstruel mensuel d’une femme reproductrice. Une activité mitotique accrue de l’épithélium stromal accompagnée d’une hyperplasie cellulaire et d’une augmentation de la matrice extracellulaire entraîne un épaississement de l’endomètre pendant la phase proliférative de l’endomètre (voir figure 3). Cette prolifération est stimulée par les œstrogènes sécrétés par les follicules en développement pendant le cycle menstruel. La progestérone s’oppose aux actions des œstrogènes et ses effets interrompent la phase proliférative du cycle endométrial. La progestérone induit la phase sécrétoire en stimulant les glandes endométriales et en augmentant la vascularisation (voir figure 4). L’épaisseur de l’endomètre augmente à mesure que les glandes, les cellules stromales et les vaisseaux sanguins s’engorgent. Chez les femmes ménopausées, on pense que de faibles niveaux d’œstrogènes et de progestérone provenant de sources extra-folliculaires stimulent la prolifération de l’endomètre. En outre, les phytoestrogènes tels que les graines oléagineuses, les produits à base de soja et le tofu sont des substances végétales qui sont structurellement et fonctionnellement similaires à l’estradiol. Malgré des études suggérant que les phytoestrogènes n’induisent pas de prolifération et n’augmentent pas le risque de cancer de l’endomètre, leurs effets à long terme sont relativement inconnus. De même, une incertitude entoure l’utilisation en vente libre de l’actée à grappes noires – un remède à base de plantes ayant des effets prolifératifs potentiels sur l’endomètre.
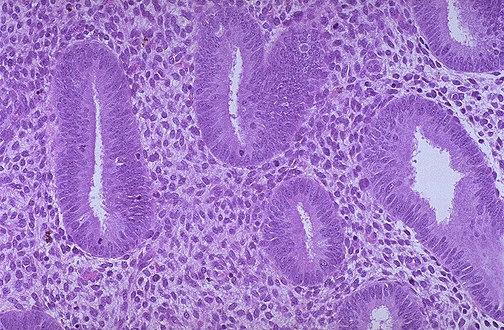
Figure 3. L’aspect microscopique d’un endomètre prolifératif, avec prolifération de glandes tubulaires et stroma dense .
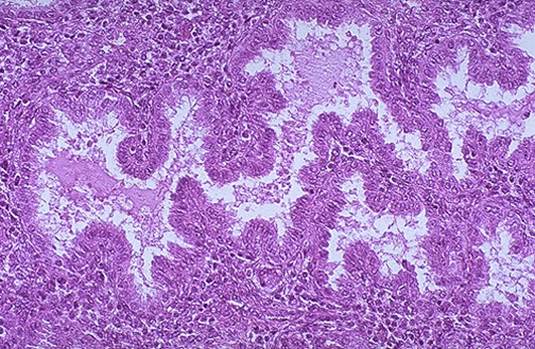
Figure 4. L’aspect microscopique de l’endomètre sécrétoire et de grandes glandes tortueuses remplies de sécrétions .
Les études ont montré que l’endomètre prolifératif n’est pas rare et suggèrent également que les cancers de l’endomètre proviennent d’un fond d’activité proliférative et non d’inertie . La probabilité qu’un simple endomètre prolifératif se transforme en tumeur maligne est toutefois très faible et nettement inférieure au risque de 0,3 à 1 % d’hyperplasie endométriale évoluant vers un cancer. Toutefois, les facteurs de risque comprennent l’augmentation de l’indice de masse corporelle et l’âge. Ces deux facteurs sont associés à une aromatisation périphérique et à des comorbidités communes parmi les patientes atteintes d’un cancer de l’endomètre.
3.6. Prise en charge de l’endomètre prolifératif
A notre connaissance, aucune étude publiée ne s’intéresse à la prise en charge de la prolifération endométriale sans atypie dans les saignements post-ménopausiques. Par conséquent, il n’existe actuellement aucun traitement fondé sur des preuves pour ces femmes. Il n’existe pas non plus de consensus sur la dose et la durée recommandées du traitement par MDPA dans ce sous-groupe de patientes. En outre, il n’y a pas d’accord sur la fréquence du suivi nécessaire pour écarter des pathologies prolifératives endométriales plus sinistres.
Il existe quelques écoles de pensée parmi les gynécologues sur la meilleure façon de gérer ces patientes. Comme le risque de transformation de l’endomètre prolifératif en cancer est supposé très faible, une option consiste à rassurer la patiente avant de la renvoyer vers les soins primaires. D’autre part, une approche plus conservatrice implique l’utilisation d’un traitement systémique à base de progestérone pour induire la régression de l’endomètre. L’acétate de médroxyprogestérone oral peut être prescrit pour une période relativement courte (six à huit semaines dans notre série de cas) pour induire la régression de l’endomètre. Les avantages du traitement par progestérone doivent être soigneusement mis en balance avec ses effets secondaires, tels que le risque de thrombose veineuse profonde. Une option à plus long terme envisagée par certains gynécologues est le système intra-utérin Mirena, une forme de contraception réversible à action prolongée qui amincit l’endomètre en libérant de la progestérone dans l’utérus. Ces deux formes de progestérone sont également utilisées dans l’hyperplasie de l’endomètre et il a été démontré qu’elles protègent l’endomètre contre la prolifération et la transformation maligne . Le SIU Mirena est autorisé à fournir une protection endométriale pendant 4 ans. La deuxième patiente de notre série de cas a été mise sous traitement par progestérone après qu’une biopsie Pipelle ait révélé un endomètre prolifératif, tandis que la quatrième patiente a été mise sous le même traitement après confirmation de l’histologie par une nouvelle biopsie Pipelle. En raison du manque de preuves, on ne sait pas si une biopsie répétée est nécessaire pour confirmer les résultats ou si une seule biopsie est suffisante pour traiter. Nous avons également constaté que les patientes de notre série de cas étaient traitées par médroxyprogestérone orale pendant 6 à 8 semaines, mais aucune étude à notre connaissance ne s’est penchée sur la durée idéale du traitement. Une approche plus radicale pour traiter l’endomètre prolifératif serait une hystérectomie pour les épisodes répétés de PMB afin d’éliminer tout risque de transformation en carcinome endométrial. Cependant, les risques anesthésiques et opératoires et l’impact psychologique en font une solution de dernier recours. Un suivi et une biopsie endométriale Pipelle répétée ont été organisés dans un délai de 6 semaines pour trois des quatre patientes. Cependant, il n’existe pas de données sur la fréquence du suivi ou l’évaluation de la réponse au traitement. En outre, il n’est pas clair si les facteurs de risque tels que l’IMC élevé et le cancer du sein devraient réduire le seuil pour proposer une biopsie Pipelle répétée.
4. Conclusion
Ce rapport a identifié les tendances actuelles dans la gestion de l’endomètre prolifératif avec la médroxyprogestérone orale. De multiples zones d’incertitude telles que la durée du traitement et le suivi ont été mises en évidence. Davantage de recherches sur l’endomètre prolifératif dans la PMB sont nécessaires afin d’élaborer des directives de traitement fondées sur des preuves.
- UK CR. Statistiques sur le cancer : Registrations Series. 2011.
- McBride. L’endomètre normal post-ménopausique. J Obstet Gynaecol Br Emp 1954;61 (5):691-7.
- Noer T. L’histologie de l’endomètre sénile. Acta Pathologica Microbiologica Scandinavica 1961;51 (3):193.
- Korhonen MO, Symons JP, Hyde BM, Rowan JP, Wilborn WH. Classification histologique et résultats pathologiques pour les spécimens de biopsie de l’endomètre obtenus à partir de 2964 femmes périménopausées et postménopausées subissant un dépistage pour les hormones continues comme thérapie de remplacement (étude CHART 2). American Journal of Obstetrics and Gynecology 1997;176 (2):377.
- Goldstein RB, Bree RL, Benson CB, Benacerraf BR, Bloss JD, Carlos R, et al. Evaluation of the woman with postmenopausal bleeding : Déclaration de la conférence de consensus parrainée par la Society of Radiologists in Ultrasound. J Ultrasound Med 2001;20 (10):1025-36.
- SIGN. Enquête sur les saignements post-ménopausiques. 2002.
- Paley PJ. Dépistage des principales tumeurs malignes affectant les femmes : Lignes directrices actuelles. American journal of obstetrics and gynecology 2001;184 (5):1021.
- NICECG27. Lignes directrices pour l’orientation en cas de suspicion de cancer. 2005.
- Nand SL, Webster MA, Baber R, O’Connor V. Bleeding pattern and endometrial changes during continuous combined hormone replacement therapy. The Ogen/Provera Study Group. Obstet Gynecol 1998;91 (5 Pt 1):678-84.
- Davidson KG, Dubinsky TJ. Évaluation ultrasonographique de l’endomètre dans les saignements vaginaux post-ménopausiques. Radiol Clin North Am 2003;41 (4):769-80.
- Gupta JK, Chien PFW, Voit D, Clark TJ, Khan KS. Épaisseur endométriale ultrasonographique pour le diagnostic de la pathologie endométriale chez les femmes présentant des saignements post-ménopausiques : une méta-analyse. Acta Obstetricia et Gynecologica Scandinavica 2002;81 (9):799.
- Dijkhuizen FPHLJ, BrÃ-Lmann HAM, Potters AE, Bongers MY, Heintz APM. La précision de l’échographie transvaginale dans le diagnostic des anomalies de l’endomètre. Obstetrics & Gynecology 1996;87 (3):345-349.
- Ciatto S, Cecchini S, Gervasi G, Landini A, Zappa M, Crocetti E. Surveillance du cancer de l’endomètre par échographie transvaginale chez les patientes atteintes d’un cancer du sein sous traitement au tamoxifène. Br J Cancer 2003;88 (8):1175-9.
- Weber G, Mere E, Bahlmanw E, Riisch B. Evaluation de différents paramètres de diagnostic échographique transvaginal chez les femmes présentant des saignements post-ménopausiques. Ultrasound in Obstetrics and Gynecology 1998;12 (4):265.
- Gruboeck K, Jurkovic D, Lawton F, Savvas M, Tailor A, Campbell S. La valeur diagnostique des mesures d’épaisseur et de volume de l’endomètre par échographie tridimensionnelle chez les patientes présentant des saignements post-ménopausiques. Ultrasound in Obstetrics and Gynecology 1996;8 (4):272.
- Dijkhuizen FPHLJ, Mol BWJ, Brölmann HAM, Heintz APM. La précision de l’échantillonnage de l’endomètre dans le diagnostic des patients atteints de carcinome et d’hyperplasie de l’endomètre. Cancer 2000;89 (8):1765.
- Van den Bosch T, Vandendael A, Van Schoubroeck D, Wranz PA, Lombard CJ. Combinaison de l’échographie vaginale et du prélèvement endométrial de bureau dans le diagnostic de la maladie endométriale chez les femmes ménopausées. Obstet Gynecol 1995;85 (3):349-52.
- Curtis RE, Boice JD, Shriner DA, Hankey BF, Fraumeni JF. Second Cancers After Adjuvant Tamoxifen Therapy for Breast Cancer. Journal of the National Cancer Institute 1996;88 (12):832-835.
- Karlsson B, Granberg S, Wikland M, Torvid K, Marsal K, et al. Transvaginal ultrasonography of the endometrium in women with postmenopausal bleeding âa Nordic multicenter study. American Journal of Obstetrics and Gynecology 1995;172 (5):1488.
- Lacey JV, Chia VM. L’hyperplasie endométriale et le risque de progression vers le carcinome. Maturitas 2009;63 (1):39.
- Lacey JV, Sherman ME, Rush BB, Ronnett BM, Ioffe OB, Duggan MiA, et al. Risque absolu de carcinome de l’endomètre pendant un suivi de 20 ans chez les femmes atteintes d’hyperplasie de l’endomètre. Journal of Clinical Oncology 2010;28 (5):788-792.
- Silverberg. Tumeurs du corps utérin et maladie trophoblastique gestationnelle. AFIP Atlas of Tumor Pathology 1995.
- Balk JL, Whiteside DA, Naus G, DeFerrari E, Roberts JM. Une étude pilote des effets de la supplémentation en phytoestrogènes sur l’endomètre post-ménopausique. J Soc Gynecol Investig 2002;9 (4):238-42.
- Pathologie FG. http://library.med.utah.edu/WebPath/FEMHTML/FEMIDX.html#2.
- Sivridis E, Giatromanolaki A. Activité proliférative dans l’endomètre post-ménopausique : le potentiel tapi pour donner naissance à un adénocarcinome endométrial. J Clin Catholic 2004;57 (8):840-4.
- Baak JP, Wisse-Brekelmans EC, Fleege JC, van der Putten HW, Bezemer PD. Evaluation du risque de cancer de l’endomètre dans l’hyperplasie, au moyen de caractéristiques morphologiques et morphométriques. Pathol Res Pract 1992;188 (7):856-9.
- Wan YL, Holland C. The efficacy of levonorgestrel intrauterine systems for endometrial protection : a systematic review. Climacteric;14 (6):622-632.