Objectifs d’apprentissage
- Définir la pression.
- Apprendre les unités de pression et comment les convertir entre elles.
La théorie cinétique des gaz indique que les particules de gaz sont toujours en mouvement et entrent en collision avec d’autres particules et les parois du récipient qui les contient. Bien que les collisions avec les parois du récipient soient élastiques (c’est-à-dire qu’il n’y a pas de gain ou de perte d’énergie nette à cause de la collision), une particule de gaz exerce une force sur la paroi pendant la collision. L’accumulation de toutes ces forces réparties sur la surface des parois du récipient provoque ce que nous appelons la pression. La pression (P) est définie comme la force de toutes les collisions particules de gaz/paroi divisée par la surface de la paroi :
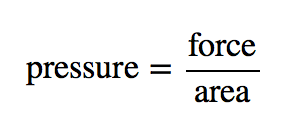
Tous les gaz exercent une pression ; c’est l’une des quantités fondamentales mesurables de cette phase de la matière. Même notre atmosphère exerce une pression – dans ce cas, le gaz est » retenu » par la gravité de la terre, plutôt que d’être dans un récipient. La pression de l’atmosphère est de 101 325 Pa.
La pression a une variété d’unités. L’unité de pression officielle, approuvée par le SI, est le pascal (Pa), qui est défini comme 1 N/m2 (un newton de force sur une surface d’un mètre carré). Cependant, cette valeur est généralement trop faible pour être utile. Une unité courante de pression est l’atmosphère (atm), qui a été définie à l’origine comme la pression atmosphérique moyenne au niveau de la mer.
Cependant, la « pression atmosphérique moyenne au niveau de la mer » est difficile à cerner en raison des variations de pression atmosphérique. Une unité plus fiable et plus courante est le millimètre de mercure (mmHg), qui correspond à la quantité de pression exercée par une colonne de mercure d’exactement 1 mm de hauteur. Une unité équivalente est le torr, qui est égal à 1 mmHg (le torr doit son nom à Evangelista Torricelli, un scientifique italien du XVIIe siècle qui a inventé le baromètre à mercure). Avec ces définitions de la pression, l’unité atmosphère est redéfinie : 1 atm est défini comme étant exactement 760 mmHg, ou 760 torr. On a donc les équivalences suivantes :
1 atm = 760 mmHg = 760 torr
On peut utiliser ces équivalences comme toutes les équivalences-pour effectuer des conversions d’une unité à une autre. En les rapportant à l’unité formelle SI de pression, 1 atm = 101,325 Pa.
Exemple 1
Combien d’atmosphères y a-t-il dans 595 torr ?
Solution
En utilisant les équivalences de pression, nous construisons un facteur de conversion entre torr et atmosphères : 1 atm = 760 torr. Ainsi,

Comme les chiffres du facteur de conversion sont exacts, le nombre de chiffres significatifs de la réponse finale est déterminé par la valeur initiale de la pression.
Testez-vous
Combien d’atmosphères y a-t-il dans 1 022 torr ?
Réponse
1,345 atm
Exemple 2
L’atmosphère de Mars est constituée en grande partie de CO2 à une pression de 6,01 mmHg. Quelle est cette pression en atmosphères ?
Solution
Utiliser les équivalences de pression pour construire le bon facteur de conversion entre millimètres de mercure et atmosphères.
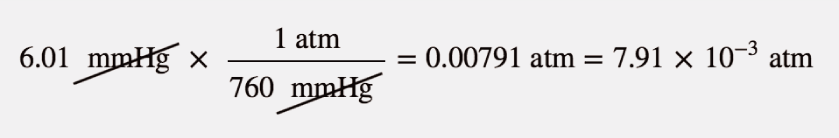
À la fin, nous avons exprimé la réponse en notation scientifique.
Testez vous-même
La pression atmosphérique est faible dans l’œil d’un ouragan. Lors d’un ouragan de 1979 dans l’océan Pacifique, une pression de 0,859 atm a été rapportée à l’intérieur de l’œil. Quelle est cette pression en torr ?
Réponse
652 torr
Principaux enseignements
- La pression est une force exercée sur une zone.
- La pression a plusieurs unités courantes qui peuvent être converties.
Exercices
-
Définir la pression. Quelles en sont les causes ?
-
Définir et mettre en relation trois unités de pression.
-
Si une force de 16.7 N est pressée contre une surface de 2,44 m2, quelle est la pression en pascals?
-
Si une force de 2,546 N est pressée contre une surface de 0.0332 m2, quelle est la pression en pascals?
-
Expliquer pourquoi la définition originale de l’atmosphère ne fonctionnait pas bien.
-
Quelles unités de pression sont égales entre elles?
-
Combien d’atmosphères sont dans 889 mmHg ?
-
Combien d’atmosphères sont dans 223 torr ?
-
Combien de torr sont dans 2,443 atm ?
-
Combien de millimètres de mercure sont dans 0,334 atm ?
-
Combien de millimètres de mercure sont dans 334 torr ?
-
Combien de torr sont dans 0,777 mmHg ?
-
Combien de pascals sont dans 1 torr ?
-
Une pression de 0,887 atm équivaut à combien de pascals ?
Réponses
La pression est une force par unité de surface. Elle est causée par les particules de gaz qui frappent les parois de leur récipient.
6,84 Pa
Parce que la pression atmosphérique au niveau de la mer est variable, ce n’est pas une unité de pression cohérente.
1,17 atm
1,857 torr
334 mmHg
133 Pa
.