Objectifs d’apprentissage
- Apprendre les termes de base utilisés pour décrire la matière.
La définition de la chimie – l’étude des interactions de la matière avec d’autres matières et avec l’énergie – utilise certains termes qu’il faut aussi définir. Nous commençons l’étude de la chimie en définissant quelques termes de base.
Matière. Un livre est de la matière, un ordinateur est de la matière, la nourriture est de la matière, et la saleté dans le sol est de la matière. Parfois, la matière peut être difficile à identifier. Par exemple, l’air est de la matière, mais parce qu’il est si mince comparé aux autres matières (par exemple, un livre, un ordinateur, la nourriture et la terre), nous oublions parfois que l’air a une masse et occupe de l’espace. Les choses qui ne sont pas de la matière comprennent les pensées, les idées, les émotions et les espoirs.
Exemple 1
Quel est, parmi les éléments suivants, la matière et la non-matière ?
- un hot dog
- l’amour
- un arbre
Solution
- Un hot dog a une masse et prend de l’espace, donc c’est de la matière.
- L’amour est une émotion, et les émotions ne sont pas de la matière.
- Un arbre a une masse et prend de l’espace, donc c’est de la matière.
Testez-vous
Lequel des éléments suivants est de la matière et non de la matière ?
- La lune
- Une idée pour une nouvelle invention
Réponse
- La lune est de la matière.
- L’invention elle-même peut être de la matière, mais son idée ne l’est pas.
Figure 1.1 Les phases de la matière

« Ice cubes » par Darren Hester est autorisé sous la licence Creative Commons Attribution-Share Alike 2.5 Generic ; « Glass of Water » par Greg Riegler est autorisé sous la licence Creative Commons Attribution 2.0 Generic ; Tea Time par Vélocia est autorisé sous licence Creative Commons Attribution-NonCommercial- NoDerivs 2.0 Generic.
Pour comprendre la matière et ses changements, nous devons être en mesure de la décrire. Il existe deux façons fondamentales de décrire la matière : les propriétés physiques et les propriétés chimiques. Les propriétés physiques sont des caractéristiques qui décrivent la matière telle qu’elle existe. Parmi les nombreuses caractéristiques physiques de la matière, citons la forme, la couleur, la taille et la température. Une propriété physique importante est la phase (ou l’état) de la matière. Les trois phases fondamentales de la matière sont le solide, le liquide et le gaz (voir la figure 1.1 » Les phases de la matière « ).
Figure 1.2 Propriétés chimiques
Le fait que cette allumette brûle est une propriété chimique de l’allumette.

« allumé une allumette » (http://commons.wikimedia.org/wiki/File:Match_stick,_lit_a_match,_match_box,_fire.JPG) par Jith JR est sous licence Creative Commons Attribution-Share Alike 3.0 Unported.
Les propriétés chimiques sont des caractéristiques de la matière qui décrivent comment la matière change de forme en présence d’une autre matière. Un échantillon de matière brûle-t-il ? La combustion est une propriété chimique. Se comporte-t-il violemment lorsqu’on le met dans l’eau ? Cette réaction est également une propriété chimique (Figure 1.2 » Propriétés chimiques « ). Dans les chapitres suivants, nous verrons comment les descriptions des propriétés physiques et chimiques sont des aspects importants de la chimie.
Figure 1.3 Changements physiques
La glace solide fond en eau liquide – un changement physique.

« Melting Ice Cubes » (https://www.flickr.com/photos/jariceiii/5012344135/) par Jar est sous licence Creative Commons Attribution 2.0 Generic.
Si la matière restait toujours la même, la chimie serait plutôt ennuyeuse. Heureusement, une partie importante de la chimie implique le changement. Un changement physique se produit lorsqu’un échantillon de matière change une ou plusieurs de ses propriétés physiques. Par exemple, un solide peut fondre (Figure 1.3 » Changements physiques « ), ou l’alcool contenu dans un thermomètre peut changer de volume lorsque la température change. Un changement physique n’affecte pas la composition chimique de la matière.
Un changement chimique est le processus de démonstration d’une propriété chimique, comme l’allumette qui brûle dans la figure 1.2 » Propriétés chimiques « . Lorsque la matière de l’allumette brûle, sa composition chimique change, et de nouvelles formes de matière avec de nouvelles propriétés physiques sont créées. Notez que les changements chimiques sont fréquemment accompagnés de changements physiques, car la nouvelle matière aura probablement des propriétés physiques différentes de la matière d’origine.
Exemple 2
Décrivez chaque processus comme un changement physique ou un changement chimique.
- L’eau dans l’air se transforme en neige.
- Les cheveux d’une personne sont coupés.
- La pâte à pain devient du pain frais dans un four.
Solution
- Parce que l’eau passe d’une phase gazeuse à une phase solide, c’est un changement physique.
- Vos longs cheveux sont raccourcis. C’est un changement physique.
- Parce que la température du four, des changements chimiques se produisent dans la pâte à pain pour faire du pain frais. Ce sont des changements chimiques. (En fait, une grande partie de la cuisine implique des changements chimiques.)
Testez-vous
Identifiez chaque processus comme un changement physique ou un changement chimique.
- Un feu fait rage dans une cheminée.
- L’eau est réchauffée pour faire une tasse de café.
Réponses
- changement chimique
- changement physique
Un échantillon de matière qui a les mêmes propriétés physiques et chimiques partout est appelé une substance. On utilise parfois l’expression substance pure, mais le mot pur n’est pas nécessaire. La définition du terme substance est un exemple de la façon dont la chimie a une définition spécifique pour un mot qui est utilisé dans le langage courant avec une définition différente, plus vague. Ici, nous utiliserons le terme substance avec sa définition chimique stricte.
La chimie reconnaît deux types de substances différentes : les éléments et les composés. Un élément est le type le plus simple de substance chimique ; il ne peut pas être décomposé en substances chimiques plus simples par des moyens chimiques ordinaires. Il existe environ 115 éléments connus de la science, dont 80 sont stables. (Les autres éléments sont radioactifs, un état que nous examinerons au chapitre 15 « Chimie nucléaire »). Chaque élément possède un ensemble unique de propriétés physiques et chimiques. Le fer, le carbone et l’or sont des exemples d’éléments.
Un composé est une combinaison de plus d’un élément. Les propriétés physiques et chimiques d’un composé sont différentes des propriétés physiques et chimiques de ses éléments constitutifs, c’est-à-dire qu’il se comporte comme une substance complètement différente. On connaît plus de 50 millions de composés, et on en découvre d’autres chaque jour. Parmi les exemples de composés, citons l’eau, la pénicilline et le chlorure de sodium (le nom chimique du sel de table courant).
Les éléments et les composés ne sont pas les seules façons dont la matière peut être présente. Nous rencontrons fréquemment des objets qui sont des combinaisons physiques de plus d’un élément ou d’un composé. Les combinaisons physiques de plus d’une substance sont appelées mélanges. Il existe deux types de mélanges. Un mélange hétérogène est un mélange composé de deux substances ou plus. Il est facile de dire, parfois à l’œil nu, que plus d’une substance est présente. Un mélange homogène est une combinaison de deux ou plusieurs substances qui est si intimement mélangée que le mélange se comporte comme une seule substance. Un autre mot pour désigner un mélange homogène est solution. Ainsi, une combinaison de sel et de laine d’acier est un mélange hétérogène car il est facile de voir quelles particules de la matière sont des cristaux de sel et lesquelles sont de la laine d’acier. En revanche, si vous prenez des cristaux de sel et que vous les dissolvez dans de l’eau, il est très difficile de dire que vous avez plus d’une substance présente juste en regardant – même si vous utilisez un puissant microscope. Le sel dissous dans l’eau est un mélange homogène, ou une solution (figure 1.4 » Types de mélanges « ).
Figure 1.4 Types de mélanges

Exemple 3
Identifiez les combinaisons suivantes comme des mélanges hétérogènes ou des mélanges homogènes.
- L’eau gazeuse (Le dioxyde de carbone est dissous dans l’eau.)
- Un mélange de limaille métallique de fer et de poudre de soufre (Le fer et le soufre sont tous deux des éléments.)
Solution
- Parce que le dioxyde de carbone est dissous dans l’eau, on peut déduire du comportement des cristaux de sel dissous dans l’eau que le dioxyde de carbone dissous dans l’eau est (aussi) un mélange homogène.
- En supposant que le fer et le soufre soient simplement mélangés, il devrait être facile de voir ce qui est du fer et ce qui est du soufre, il s’agit donc d’un mélange hétérogène.
Testez-vous
Les combinaisons suivantes sont-elles des mélanges homogènes ou des mélanges hétérogènes ?
- Le corps humain
- Un amalgame, une combinaison de quelques autres métaux dissous dans une petite quantité de mercure
Réponses
- Mélange hétérogène
- Mélange homogène
Il existe d’autres descripteurs que nous pouvons utiliser pour décrire la matière, notamment les éléments. Nous pouvons généralement diviser les éléments en métaux et non-métaux, et chaque ensemble partage certaines propriétés (mais pas toujours toutes). Un métal est un élément qui est solide à température ambiante (bien que le mercure soit une exception bien connue), qui est brillant et argenté, qui conduit bien l’électricité et la chaleur, qui peut être broyé en feuilles fines (une propriété appelée malléabilité) et qui peut être étiré en fils fins (une propriété appelée ductilité). Un non-métal est un élément qui est cassant à l’état solide, qui ne conduit pas bien l’électricité ou la chaleur et qui ne peut pas être transformé en feuilles ou en fils fins (figure 1.5 » Semi-métaux « ). Les non-métaux existent également dans une variété de phases et de couleurs à température ambiante. Certains éléments ont des propriétés à la fois métalliques et non métalliques et sont appelés semi-métaux (ou métalloïdes). Nous verrons plus loin comment ces descriptions peuvent être attribuées assez facilement à divers éléments.
Figure 1.5 Semi-métaux

« Verser du mercure liquide bionerd » est autorisé sous licence Creative CommonsAttribution 3.0 Unported ; « Sulphur-vulcano » par Heidi Soosalu est autorisé sous licence Creative Commons Attribution-Share Alike 3.0 Unported.
La figure 1.6 « Décrire la matière » est un organigramme des relations entre les différentes façons de décrire la matière.
Figure 1.6 Décrire la matière
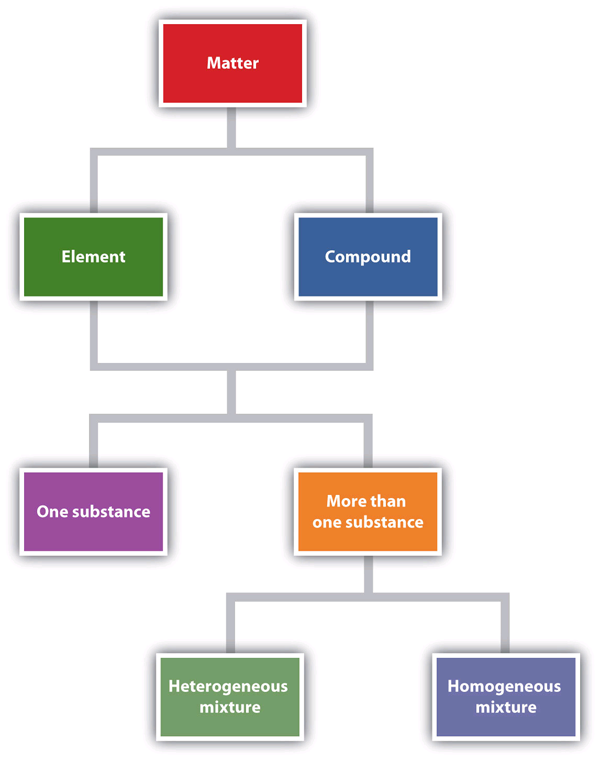
Cet organigramme montre comment la matière peut être décrite.
La chimie est partout : Le matin
La plupart des gens ont un rituel matinal, un processus qu’ils suivent chaque matin pour se préparer à la journée. La chimie apparaît dans plusieurs de ces activités.
- Si vous prenez une douche ou un bain le matin, vous utilisez probablement du savon, du shampoing, ou les deux. Ces articles contiennent des produits chimiques qui interagissent avec l’huile et la saleté sur votre corps et vos cheveux pour les enlever et les laver. Beaucoup de ces produits contiennent également des produits chimiques qui vous font sentir bon ; on les appelle des parfums.
- Lorsque vous vous brossez les dents le matin, vous utilisez généralement du dentifrice, une forme de savon, pour nettoyer vos dents. Les dentifrices contiennent généralement de minuscules particules dures appelées abrasifs qui frottent physiquement vos dents. De nombreux dentifrices contiennent également du fluorure, une substance qui interagit chimiquement avec la surface des dents pour aider à prévenir les caries.
- Peut-être prenez-vous des vitamines, des compléments ou des médicaments tous les matins. Les vitamines et autres compléments contiennent des substances chimiques dont votre corps a besoin en petites quantités pour fonctionner correctement. Les médicaments sont des produits chimiques qui aident à combattre les maladies et à promouvoir la santé.
- Peut-être que vous faites des œufs au plat pour le petit-déjeuner. Faire frire des œufs implique de les chauffer suffisamment pour qu’une réaction chimique se produise afin de cuire les œufs.
- Après avoir mangé, les aliments contenus dans votre estomac subissent une réaction chimique afin que le corps (principalement les intestins) puisse absorber les aliments, l’eau et les autres nutriments.
- Si vous conduisez ou prenez le bus pour aller à l’école ou au travail, vous utilisez un véhicule qui brûle probablement de l’essence, une matière qui brûle assez facilement et fournit de l’énergie pour alimenter le véhicule. Rappelez-vous que la combustion est un changement chimique.
Ce ne sont là que quelques exemples de l’impact de la chimie sur votre vie quotidienne. Et nous ne sommes même pas encore arrivés au déjeuner !
Figure 1.7 La chimie dans la vie réelle

« Soaps and Shampoos » by Takashi Ota is licensed under Creative Commons Attribution 2.0 Générique ; » English Breakfast » est autorisé sous licence Creative Commons Attribution-Share Alike 3.0 Unported ; » Langley, Trans-Canada Highway » par James est autorisé sous licence Creative Commons Attribution- Share Alike 3.0 Unported.

Source vidéo : The chemical world by keyj (https://viuvideos.viu.ca/media/The+Chemical+World/0_ixlxmwe8)
Key Takeaways
- La chimie est l’étude de la matière et de ses interactions avec les autres matières et l’énergie.
- La matière est tout ce qui a une masse et occupe de l’espace.
- La matière peut être décrite en termes de propriétés physiques et de propriétés chimiques.
- Les propriétés physiques et les propriétés chimiques de la matière peuvent changer.
- La matière est composée d’éléments et de composés.
- Les combinaisons de différentes substances sont appelées mélanges.
- Les éléments peuvent être décrits comme des métaux, des non-métaux et des semi-métaux.
Exercices
- Identifiez chacun d’entre eux comme étant de la matière ou non.
a) un livre
b) la haine
c) la lumière
d) une voiture
e) un œuf au plat
2. Donnez un exemple de matière dans chaque phase : solide, liquide ou gazeuse.
3. Chaque affirmation représente-t-elle une propriété physique ou une propriété chimique ?
a) Le soufre est jaune.
b) La laine d’acier brûle lorsqu’elle est enflammée par une flamme.
c) Un gallon de lait pèse plus de huit livres.
4. Chaque énoncé représente-t-il une propriété physique ou une propriété chimique ?
a) Un tas de feuilles pourrit lentement dans la cour arrière.
b) En présence d’oxygène, l’hydrogène peut interagir pour faire de l’eau.
c) L’or peut être étiré en fils très fins.
5. Chaque énoncé représente-t-il un changement physique ou un changement chimique ?
a) L’eau bout et devient de la vapeur.
b) Les aliments sont transformés en forme utilisable par le système digestif.
c) L’alcool contenu dans de nombreux thermomètres gèle à environ -40 degrés Fahrenheit.
6. Chaque énoncé représente-t-il un changement physique ou un changement chimique ?
a) Le graphite, une forme de carbone élémentaire, peut être transformé en diamant, une autre forme de carbone, à des températures et des pressions très élevées.
b) La maison d’en face a été peinte d’une nouvelle couleur.
c) Les éléments sodium et chlore s’associent pour donner une nouvelle substance appelée chlorure de sodium.
7. Faites la distinction entre un élément et un composé. Environ combien de chacun sont connus ?
8. Quelle est la différence entre un mélange homogène et un mélange hétérogène ?
9. Identifiez chacun comme un mélange hétérogène ou un mélange homogène.
a) Le sel est mélangé au poivre.
b) Le sucre est dissous dans l’eau.
c) Les pâtes sont cuites dans l’eau bouillante.
10. Identifiez chacun d’eux comme un mélange hétérogène ou un mélange homogène.
a) l’air
b) la saleté
c) un téléviseur
11. Dans l’exercice 9, quels choix sont également des solutions
12. Dans l’exercice 10, quels choix sont également des solutions ?
13. Pourquoi le fer est-il considéré comme un métal ?
14. Pourquoi l’oxygène est-il considéré comme un non-métal ?
15. Faites la distinction entre un métal et un non-métal.
16. Quelles sont les propriétés des semi-métaux ?
17. Le carbone élémentaire est un solide noir d’aspect terne qui conduit bien la chaleur et l’électricité. Il est très cassant et ne peut pas être transformé en feuilles minces ou en longs fils. Parmi ces propriétés, comment le carbone se comporte-t-il comme un métal ? Comment le carbone se comporte-t-il en tant que non-métal ?
18. Le silicium pur est brillant et argenté mais ne conduit pas bien l’électricité ou la chaleur. Parmi ces propriétés, comment le silicium se comporte-t-il comme un métal ? Comment le silicium se comporte-t-il comme un non-métal ?
Réponses
a) matière
b) non-matière
c) non-matière
d) matière
a) propriété physique
b) propriété chimique. chimique
c) propriété physique
a) changement physique
b) changement chimique
c) changement physique
7. Un élément est une partie chimique fondamentale d’une substance ; il existe environ 115 éléments connus. Un composé est une combinaison d’éléments qui agit comme une substance différente ; il y a plus de 50 millions de substances connues.
a) hétérogène
b) homogène
c) hétérogène
11. Le choix b est une solution.
13. Le fer est un métal car il est solide, il est brillant et il conduit bien l’électricité et la chaleur.
15. Les métaux sont généralement brillants, conduisent bien l’électricité et la chaleur et sont malléables et ductiles ; les non-métaux sont de couleurs et de phases variées, sont cassants en phase solide et ne conduisent pas bien la chaleur ou l’électricité.
17. Le carbone se comporte comme un métal car il conduit bien la chaleur et l’électricité. C’est un non-métal car il est noir et cassant et ne peut être transformé en feuilles ou en fils.
.