Comme indiqué dans les sections précédentes, la molécule d’eau polaire permet aux molécules d’eau de former des liaisons entre elles. Ces liaisons sont appelées des liaisons hydrogène. Si nous considérons le chlorure de sodium (sel), un composé contenant des liaisons ioniques, nous pourrions démontrer que simplement en plaçant du sel de table dans l’eau, par exemple, nous pouvons réduire de 80 fois l’attraction électrostatique entre les ions de sodium et de chlorure. Au fur et à mesure que de plus en plus d’ions de sodium et de chlore sont libérés par l’affaiblissement de l’attraction électrostatique qui les maintient ensemble, ils s’entourent des molécules polaires de l’eau – ce que l’on appelle » l’hydratation « . »

L’eau dissout plus de substances que tout autre liquide courant en décomposant les » sels » en » ions » constitutifs (par exemple, NaCl en Na+ et Cl-) et en hydratant ces ions pour les empêcher d’interagir. Ainsi, les molécules d’eau polaires ont une attraction pour les ions (atomes ou groupes d’atomes ayant une charge), où les « cations » sont des ions à charge positive et les « anions » à charge négative. La plupart des éléments ont une solubilité élevée dans l’eau, ce qui signifie que de grandes concentrations de ces éléments peuvent s’accumuler avant que la capacité des molécules d’eau à isoler les ions ne soit dépassée. Le point auquel Na et Cl, par exemple, commencent à précipiter un sel dans l’eau de mer est appelé « saturation ». Pour le NaCl (le minéral « halite »), cela ne se produit qu’à partir de l’eau de mer actuelle, lorsque l’évaporation se produit et que le volume de l’eau de mer est réduit à environ 10 % de son volume initial.
L’eau de mer est essentiellement une solution de NaCl qui a une concentration moyenne de 35 g de NaCl/kg d’eau (ou 3,5 % de sel). Na et Cl composent plus de 85% du total des solides dissous (sel), mais d’autres ions importants sont présents. L’abondance relative des ions dans l’eau de mer est classée dans l’ordre : Cl, Na, SO4, Mg, Ca, K. Ensemble, ces ions constituent >99% des solides dissous dans l’eau de mer. Avec seulement quatre autres éléments – HCO3 (bicarbonate), Br, Sr, B, F – nous avons 99,99 % de tous les solides dissous. Les charges doivent s’équilibrer, ainsi la charge positive associée à Na+, Mg+2, Ca+2, K+ est égale à la charge négative associée à Cl-, SO4-2 (et HCO3-). Nous pensons que vous ne voudriez pas qu’il en soit autrement. Pensez à ce que serait le flux du courant de la mer vers vous, assis sur la plage, si les charges n’étaient pas équilibrées – choquant !
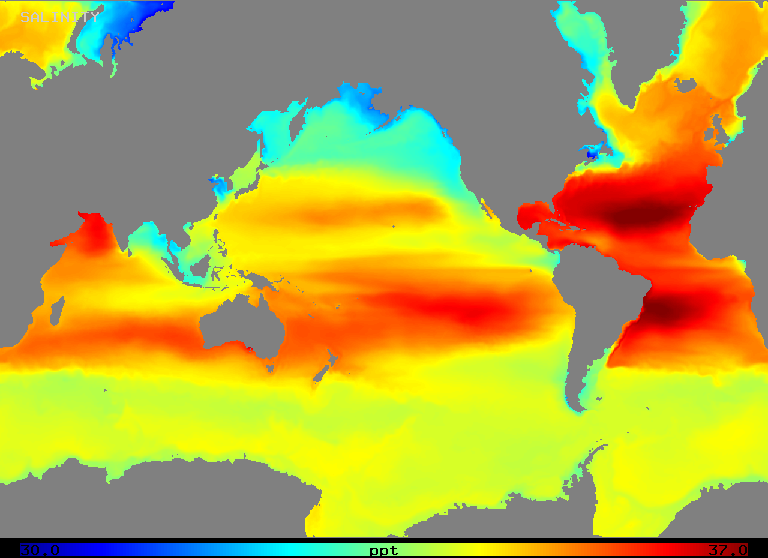
La salinité varie sur une plage d’environ 32 à 37 o/oo en pleine mer, comme l’illustre la figure 2 (ci-dessous). Notez que les zones de plus forte salinité se trouvent dans les régions où l’évaporation nette est la plus élevée, comme on pourrait s’y attendre.
Toutes les autres substances dissoutes dans l’eau de mer sont à des concentrations très faibles (partie par million ou milliard) (ppm ou ppb ; 10-6 à 10-9). Cela inclut des nutriments importants tels que le phosphate et le nitrate qui sont recyclés par les organismes (éléments dits « bio-limitants ») et essentiels à la vie. De nombreux métaux sont présents à l’état de traces (vous voulez devenir riche ? Il y a environ 9 millions de tonnes d’or dissous dans l’eau de mer, ce qui est à peu près égal à tout l’or extrait sur terre au cours de l’histoire).
Comme indiqué précédemment, l’évaporation de l’eau de mer produit une séquence prévisible de sels minéraux (les minéraux deviennent saturés à un certain point). Après l’évaporation de quelques % de la masse d’eau, le CaCO3 (calcite) précipite ; après une évaporation de 81 %, le CaSO4 (gypse) est entièrement précipité ; après une évaporation d’environ 90,5 %, le NaCl (halite) est entièrement précipité ; à 96 % d’évaporation, les sels de K et de Mg (w/ SO4 et Cl) tombent. Il y a suffisamment de sel dans l’océan pour recouvrir les terres d’une couche de 170 m d’épaisseur. Les dépôts naturels provenant d’anciens océans comme celui-ci sont appelés « évaporites ».
Les dépôts naturels provenant des anciens océans comme celui-ci sont appelés « évaporites ».