Par Caroline Helwick
Le 25 mai 2019

Chez des patients présentant un myélome multiple couvant à risque intermédiaire à élevé, le traitement par lénalidomide en monothérapie, par rapport à l’observation, a conduit à une réduction de 72 % du risque de progression de la maladie à 3 ans.1 Les résultats de l’étude de phase III E3A06 ont été présentés lors d’un point presse en amont du congrès annuel 2019 de l’ASCO par Sagar Lonial, MD, FACP, de l’Université Emory, à Atlanta.
« Nous avons montré, dans la plus grande étude randomisée à ce jour sur le myélome couvant, que nous pouvons prévenir le développement d’un myélome symptomatique chez une fraction significative de patients », a déclaré le Dr Lonial. Plus de 90% du groupe d’intervention sont restés sans progression à 3 ans, a-t-il rapporté.

Nous ne savons pas si une véritable stratégie de traitement fait une différence, mais nous avons montré que l’intervention peut faire une différence.
– Sagar Lonial, MD, FACPTweet this quote
Bien que les patients atteints de myélome multiple couvant – une entité précoce et asymptomatique ne présentant pas les critères CRAB (calcium élevé, insuffisance rénale, anémie, lésions osseuses)-sont généralement suivis et non traités, certains chercheurs se demandent si une intervention précoce ne pourrait pas améliorer les résultats et même guérir la maladie avant que son plein impact ne se fasse sentir.
« Il ne fait aucun doute que les patients atteints de myélome multiple ont besoin d’un traitement immédiat pour inverser les signes de lésions organiques, mais un défi auquel nous avons été confrontés est d’essayer d’identifier les patients sans lésions organiques qui présentent le plus grand risque de progression de la maladie, et d’essayer d’intervenir », a déclaré le Dr Lonial.
Les patients classés comme ayant une maladie couvante ont généralement un risque de progression de la maladie d’environ 10% par an. Après 5 ans, environ la moitié de ces patients auront une maladie symptomatique, a-t-il ajouté.
Découvertes antérieures du Spanish Myeloma Group
L’étude s’appuie sur des travaux antérieurs du Spanish Myeloma Group, qui a rapporté dans l’essai PETHEMA de 2015, plus petit, que le lénalidomide/dexaméthasone améliorait la survie sans progression et la survie globale, par rapport à l’observation, chez les patients à haut risque de maladie -progression2.
Cette étude a toutefois fait l’objet de critiques qui ont été évitées par la conception de l’étude actuelle : les patients n’ont pas été sélectionnés à l’aide de techniques d’imagerie avancées ; les investigateurs ont appliqué une définition dépassée du risque élevé ; et le régime comprenait de la dexaméthasone, ce qui rendait impossible d’isoler l’effet du lénalidomide, a-t-il dit.
« Le fait que l’étude n’ait pas utilisé l’imagerie moderne est important, car les patients dont les radiographies sont négatives peuvent présenter une maladie osseuse par imagerie par résonance magnétique (IRM) ou tomographie par émission de positons (TEP) », a noté le Dr Lonial. « Dans notre étude, nous avons exigé une IRM avant l’entrée dans l’étude pour être sûrs de ne pas recruter des patients qui avaient déjà un myélome, ce qui était la principale critique de l’essai espagnol. »
E3A06 a également éliminé la dexaméthasone, qui peut supprimer ou éliminer le clone malin et produire une réponse temporaire, par opposition au contrôle du clone, comme c’était le but de l’utilisation du lénalidomide en monothérapie, a-t-il dit.
L’essai précédent, donc – bien que considéré comme important – n’a pas changé la norme de soins, « mais maintenant, a-t-il dit, avec l’essai E3A06, en agrégat avec l’essai PETHEMA, beaucoup d’entre nous soutiennent qu’une intervention précoce avec une stratégie de prévention peut réduire le risque de conversion en myélome symptomatique. »
Détails de l’essai E3A06
E3A06 était un essai intergroupe randomisé de phase III qui a testé l’effet du lénalidomide en monothérapie par rapport à l’observation chez des patients classés comme ayant un myélome couvant à risque intermédiaire ou à haut risque. L’éligibilité exigeait un taux de plasmocytes ≥ 10 % et un rapport de chaînes légères libres sériques anormal (< 0,26 ou > 1,65).
Dans une phase initiale de rodage de phase II, 44 patients ont reçu du lénalidomide pour démontrer la sécurité. Dans l’essai de phase III, 182 patients ont été répartis au hasard entre le lénalidomide (25 mg/j pendant 21 jours sur 28) et l’observation. Les caractéristiques de base étaient similaires entre les deux groupes. Le suivi médian était de 71 mois pour la partie phase II et de 28 mois pour la phase III. Le critère d’évaluation principal était la survie sans progression.
Réduction significative du risque de progression
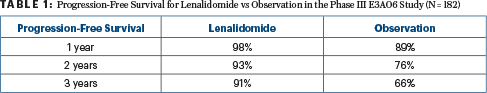
Après 3 ans, 87% de la cohorte de phase II, qui ont tous reçu du lénalidomide, étaient sans progression, ainsi que 78% après 5 ans. Pour la comparaison de phase III, les taux de survie sans progression à 1 an, 2 ans et 3 ans étaient de 98 %, 93 % et 91 % pour le lénalidomide contre 89 %, 76 % et 66 %, respectivement, pour l’observation (hazard ratio = 0,28 ; P = 0,0005), comme le montre le tableau 1. Le taux de réponse global avec le lénalidomide était de 47,7 % pour l’étude de phase II et de 48,9 % pour l’étude de phase III, aucune réponse n’ayant été observée dans le bras d’observation.
Intéressant, lorsqu’il a été réparti en groupes à risque faible, intermédiaire et élevé, on a constaté que chaque sous-ensemble bénéficiait « presque également » d’une intervention précoce. « Cela suggère que, si les patients à haut risque sont ceux que nous ciblons actuellement, le groupe intermédiaire, pour lequel aucun essai n’a encore montré un avantage dans la prévention de la maladie symptomatique, pourrait être un domaine fertile pour des recherches plus approfondies. Nous constatons un bénéfice pour les patients à risque intermédiaire, mais le suivi de la survie globale est trop court pour dire que ces patients devraient tous être traités », a-t-il conclu.
Les patients à risque intermédiaire faible ont été recrutés lorsque l’étude a assoupli les critères d’éligibilité pour des ratios de chaînes légères libres seulement légèrement anormaux. Bien qu’ils aient eux aussi tiré un bénéfice, ce n’est pas un groupe à considérer pour un traitement à l’heure actuelle, a-t-il ajouté.
Evénements indésirables
Des toxicités non hématologiques de grade 3 à 4 ont été observées chez environ 28% des patients, et une toxicité hématologique de grade 3 à 4 (principalement une neutropénie) chez environ 6%. L’incidence cumulée des tumeurs malignes primaires secondaires invasives était de 5,2 % pour le lénalidomide et de 3,5 % pour l’observation.
Il n’y avait pas de différences dans les scores de qualité de vie entre les bras. Cependant, 80% des patients de la phase II et 51% de la phase III ont arrêté le lénalidomide.
Looking Ahead
Une stratégie préventive pour le myélome couvant est susceptible d’être moins intensive que les stratégies de traitement employées pour la maladie symptomatique, a-t-il déclaré. « Nous nous concentrons sur l’amélioration de la surveillance immunitaire du clone malin existant et sur la prévention de la progression de ce clone, par opposition à l’éradication de la maladie, qui est l’objectif du traitement », a déclaré le Dr Lonial.
Les études en cours portent en fait sur des interventions plus agressives, comme l’association de lénalidomide, de dexaméthasone et de daratumumab, ou d’autres nouveaux agents actifs. D’autres études évaluent le bénéfice d’un traitement d’induction, d’une consolidation, d’une transplantation et de deux ans d’entretien en cas de maladie couvée, a-t-il précisé.
« Nous ne savons pas si une véritable stratégie de traitement fait la différence, mais nous avons montré que l’intervention peut faire la différence », a-t-il déclaré. « Il est maintenant temps d’explorer d’autres idées, avec des régimes plus intensifs et avec un objectif différent. » ■
DISCLOSURE : Le Dr Lonial a été consultant ou conseiller pour Celgene, Bristol-Myers Squibb, Janssen Oncology, Novartis, GlaxoSmithKline, Amgen, AbbVie, Takeda, Merck et Juno Therapeutics ; et a reçu des fonds de recherche de Celgene, Bristol-Myers Squibb et Takeda.
1. Lonial S, Jacobus SJ, Weiss M, et al : E3A06 : Essai randomisé de phase III sur le lénalidomide par rapport à l’observation seule chez les patients atteints de myélome multiple couvant asymptomatique à haut risque. Réunion annuelle de l’ASCO 2019. Résumé 8001. Sera présenté le 2 juin 2019.
2. Mateos M-V, Hernandez M-T, Giraldo P, et al : Lenalidomide plus dexaméthasone pour le myélome multiple smoldering à haut risque. N Engl J Med 369:438-447, 2013.
.