Le PED séreux dans la DMLA
Le décollement de l’épithélium pigmentaire (PED) rétinien fait partie du spectre clinique de la dégénérescence maculaire liée à l’âge (DMLA).
Cependant, différents types de DEP ont été rapportés dans la littérature et ils ont été associés ou non à la DMLA.
Le DEP séreux est défini comme une zone d’élévation séreuse de l’épithélium pigmentaire rétinien (EPR), nettement délimitée et en forme de dôme. L’histopathologie de la DEP séreuse correspond au détachement de la membrane basale de l’EPR, ainsi que de l’EPR sus-jacente de la membrane de Bruch restante en raison de l’accumulation de liquide(1).
La présence de cette lésion est un facteur pronostique négatif de la DMLA en termes de résultat d’acuité visuelle.
Bien qu’aucune indication thérapeutique précise n’ait été fixée à ce jour, la détection précoce de la DEP séreuse est importante pour le pronostic et la prise en charge des patients atteints de DMLA.
Dans la DMLA, la DEP séreuse peut être associée ou non à de nouveaux vaisseaux choroïdiens (néovascularisation choroïdienne – NVC). Cependant, le type vascularisé est de loin le plus observé.
Plusieurs théories concernant la relation entre la DEP séreuse et la NVC ont été proposées.
Pour expliquer sa pathogenèse, Gass a théorisé la croissance de nouveaux vaisseaux provenant de la choroïde (néovascularisation de type 1 (NV)) à l’intérieur de l’épaisseur de la membrane de Bruch, qui fuient activement, augmentant la pression hydrostatique et provoquant le détachement de l’EPR parmi les couches moins adhérentes(2).
Ce concept a été ultérieurement soutenu par la preuve que le développement de la NVC s’accompagne de mécanismes inflammatoires qui ajoutent davantage de dommages à la membrane de Bruch, favorisant la séparation de l’EPR de la couche collagénique interne(3-5).
Lorsque la croissance de nouveaux vaisseaux commence à partir de la rétine interne, plus récemment décrite comme NV de type 3 et également connue sous le nom de prolifération angiomateuse rétinienne (RAP), il a été supposé que la formation de PED séreux, qui est très fréquemment associée, peut être liée à l’invasion de l’EPR par le complexe néovasculaire6-8).
A l’inverse, d’autres auteurs ont observé que la présence de PED peut représenter une condition préexistante qui peut favoriser la croissance du CNV par une nouvelle atteinte de la membrane de Bruch, expression de la même maladie en cours(9,10).
Bien que la pathogenèse du DEP ne soit pas complètement comprise, d’après ces études, la formation du NV semble être un moment charnière.
À l’examen du fond d’œil, le DEP séreux apparaît comme une zone ronde ou ovale, en forme de dôme distinct, de décollement régulier de l’EPR et de la rétine neurosensorielle sus-jacente, de couleur jaune à orange et de surface lisse. Les marges sont généralement nettement délimitées ; et une atrophie focale de l’EPR et des figures pigmentaires sont fréquemment observées(9,11).
Cependant, la présence concomitante de NV peut générer divers aspects ophtalmoscopiques associés, tels que des composantes hémorragiques et exsudatives, des zones d’élévation irrégulière de l’EPR et un décollement séreux de la neurorétine environnante.
La présentation du NV de type 1 situé à la marge du DEP peut varier, entraînant généralement un aspect réniforme ou cranté, ou un décollement de l’EPR à côté plat(12).
Le DEP séreux peut être imagé par angiographie à la fluorescéine (AF), angiographie au vert d’indocyanine (ICGA) et tomographie par cohérence optique (OCT).
L’AF représente toutefois l’étalon-or pour le diagnostic du DEP séreux.
Examinée par FA, la DEP séreuse présente classiquement une hyperfluorescence uniforme précoce de toute la lésion, légèrement retardée par rapport à la fluorescence de fond, qui augmente progressivement de luminosité au fur et à mesure de l’examen (pooling).
L’hyperfluorescence de la DEP séreuse ne change généralement pas de taille ou de forme pendant les phases angiographiques.
L’AF peut également démontrer la présence de NV, généralement associés au DEP séreux comme NV de type 1, comme des zones de coloration sous-rétinienne tardive indistincte, plus évidentes lorsqu’elles sont situées à la marge du décollement de l’EPR ou correspondant à l' »encoche »(11).
La présence de NV peut également être déduite par la présence d’une composante hémorragique du DEP, le ménisque sombre décrit par Gass(12).
Cependant, une localisation plus précise de la composante néovasculaire peut être obtenue avec l’ICGA numérique. La molécule de vert d’indocyanine possède des propriétés biophysiques qui, contrairement à la fluorescéine, la rendent utile pour mettre en évidence l’anatomie des vaisseaux à travers l’EPR, le sang et l’exsudation trouble.
Dans le détail, l’ICGA permet de mieux délimiter la présence et le type de nouveaux vaisseaux associés à un DEP séreux, et pour cette raison est considéré comme un outil fondamental dans la gestion de cette maladie(13-15).
Sur l’ICGA, le DEP séreux apparaît comme une lésion hypofluorescente, aux marges nettement délimitées, qui reste constamment hypofluorescente pendant toutes les phases de l’examen(16).
Lorsque les nouveaux vaisseaux ne sont pas présents, aucun signe de zones hyperfluorescentes localisées n’est détectable ; le contour du DEP est nettement arrondi et il est donc considéré comme un DEP séreux pur.
Chez des patients atteints de DMLA, Yannuzzi a trouvé une incidence de 4% de DEP non vascularisé parmi les DEP séreux(15).
Lorsque la composante néovasculaire est présente, il a été suggéré le terme de DEP vascularisé(15),.qui représente environ 24% des DMLA exsudatives nouvellement diagnostiquées(17).
Les nouveaux vaisseaux associés à la DEP séreuse sont représentés dans différents sous-types.
La vidéoangiographie à haute vitesse avec l’ophtalmoscope laser à balayage apparaît comme un outil précieux qui permet à l’ophtalmologiste d’identifier le schéma des nouveaux vaisseaux et leur comportement angiographique(18).
Reconnaître les différents types de NV, en distinguant les résultats angiographiques, est obligatoire pour l’évolution naturelle distincte, le pronostic visuel et la réponse différente au traitement des trois principaux types de nouveaux vaisseaux associés au DEP séreux dans la DMLA.
Le type le plus courant de nouveaux vaisseaux associés à la DEP séreuse est celui qui se produit à partir de la choroïde sous la monocouche d’EPR(15-,17).
Ces nouveaux vaisseaux ont été récemment classés comme NV de type 1 et sont de loin le type de NV le plus courant dans la DMLA(19)(Figure 1).

Figure 1 – PED vascularisé avec NV de type 1. (A) FA, (B)ICGA et (C) OCT.
Dans les phases précoces, l’ICGA montre l’artère nourricière du NV qui naît de la circulation choroïdienne, puis la veinule drainante.
En même temps, le réseau capillaire de la membrane néovasculaire peut être détecté.
Contrairement à la fluorescéine, le vert d’indocyanine fuit légèrement et l’hyperfluorescence du NV est généralement minime, à l’exception de certains cas qui présentent une fuite intense, considérée comme de nouveaux vaisseaux très actifs.
Fréquemment, dans les phases tardives, une zone bien définie d’hyperfluorescence légère correspondant au réseau de NV peut être appréciable.
Le deuxième type de nouveaux vaisseaux compliquant les PED séreux sont les RAP(7,20-22), également appelés NV de type 3(19).
Ces lésions vasculaires, rapportées par différents auteurs, peuvent impliquer la rétine externe et l’EPR, par une progression dont l’hypothèse est qu’elle provient de la circulation rétinienne et/ou de la choroïde.
L’ICGA montre typiquement la présence d’un « point chaud », dû à l’hyperfluorescence précoce du complexe néovasculaire intrarétinien, qui augmente au cours de l’angiographie, avec une fuite intense dans les phases tardives.
Sa luminosité est renforcée par l’hypofluorescence environnante du PED sous-jacent (Figure 2).
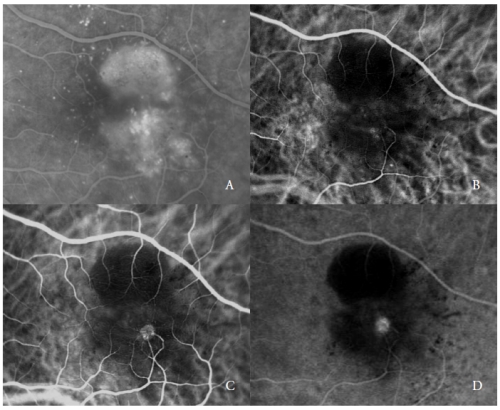
Figure 2 – PED vascularisé avec NV de type 3 (RAP). FA (A) et ICGA phases précoces (B) et tardives (C et D).
Dans les phases tardives de la maladie, le complexe néovasculaire choroïdien est généralement connecté à un ou plusieurs vaisseaux rétiniens qui apparaissent tortueux et dilatés(7,22,23).
La NV de type 3 peut être unique ou multiple, son origine est typiquement extrafovéale, et une hémorragie intrarétinienne en correspondance de la lésion néovasculaire est fréquemment observée(20).
Le troisième type de nouveaux vaisseaux associés à la DEP séreuse dans la DMLA correspond à une vasculopathie choroïdienne polypoïdale (VCP)(24).
La VPC est une forme particulière de NVC, caractérisée par la présence de dilatations rondes orange, anévrismales, ressemblant à des polypes, à la limite d’un réseau vasculaire ramifié d’origine choroïdienne.
Bien que le VCP affecte plus fréquemment les populations noires et asiatiques d’âge moyen, son spectre clinique s’étend aux Blancs, où il a été constaté qu’il était présent chez 8 à 13 % des patients présentant des lésions concomitantes de DMLA.
Dans ces cas, lorsque les manifestations attribuables à la fois au VCP et à la DMLA sont présentes, certains auteurs considèrent le VCP comme un sous-type de NVC dans la DMLA(24,25).
La manifestation hémorragique est fréquente chez les patients atteints de VCP.
Le DEP séreux associé au VCP montre fréquemment un niveau sanguin dans la partie inférieure du décollement.
L’ICGA est l’examen de pointe pour distinguer les caractéristiques typiques des deux composantes vasculaires.
Le réseau vasculaire est caractérisé par la présence d’une ou plusieurs lésions anévrismales qui présentent une fluorescence vive dès les phases précoces, suivie dans les phases tardives d’un effacement du colorant, appelé « wash-out », typique de cette maladie (figure 3).
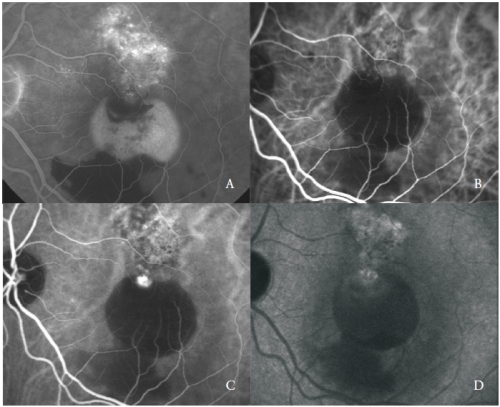
Figure 3 – PED vascularisé avec PCV : FA (A) et phases précoce (B), moyenne (C) et tardive (D) de l’ICGA.
Néanmoins, certaines structures de type polyp peuvent fuir activement montrant une coloration tardive de leurs parois et de l’exsudation environnante.
Les lésions polypoïdes sont généralement situées à la marge du PED séreux(26).
La reconnaissance de ces lésions est critique en raison de leur évolution clinique, de leur pronostic et de leur réponse au traitement différents par rapport aux autres sous-types de DMLA néovasculaire.
L’OCT fournit des images qui permettent une corrélation exacte avec les résultats angiographiques.
Dans les scans transversaux d’OCT, la DEP séreuse apparaît comme une élévation en forme de dôme optiquement vide de la bande externe hautement réfléchissante – l’EPR, qui se détache abruptement de la membrane de Bruch(26).
La rétine sus-jacente, habituellement adhérente à la DEP bulleuse, aux marges de la lésion, peut être légèrement détachée de l’EPR sous-jacent.
Des informations supplémentaires peuvent être fournies par l’OCT dans les DEP vascularisées(28).
Les coupes tomographiques, guidées par FA et ICGA dans la zone correspondant au CNV, montrent une élévation plus lisse de l’EPR, continue avec le décollement séreux, avec une rétrodiffusion plus profonde, due à la présence du tissu fibrovasculaire.
Des zones hyporéflectives d’espaces optiquement vides homogènes renvoyant à une accumulation de liquide sont fréquemment présentes dans les espaces intrarétiniens et sous-rétiniens(29).
Les espaces optiquement vides intrarétiniens sont plus prononcés lorsque le DEP séreux est associé à un NV de type 3, notamment de forme kystique (figure 4).
En positionnant la ligne de balayage correspondant au « point chaud », l’anomalie néovasculaire est représentée comme une zone pré-épithéliale dense ou hyperréfléchissante dans les couches rétiniennes internes, où les couches hyperréfléchissantes externes ne sont plus détectables(30).
L’EPR proche de cette lésion présente fréquemment des effractions ou des interruptions dans sa couche hyperréfléchissante(31).
La mesure topographique rétinienne soutient une augmentation de l’épaisseur rétinienne.
Dans les yeux atteints de PED et de PCV séreux, les lésions polypoïdales montrent une saillie nette de l’EPR, similaire à la PED mais en pente raide.
La cavité des polypes, généralement vide optiquement, est contiguë à une élévation irrégulière de l’EPR, expression de la composante néovasculaire occulte de la lésion(32,33).
Le liquide sous-rétinien et intrarétinien, observé comme des zones vides optiques hypofluorescentes, est lié à l’activité du PCV (figure 4-B).
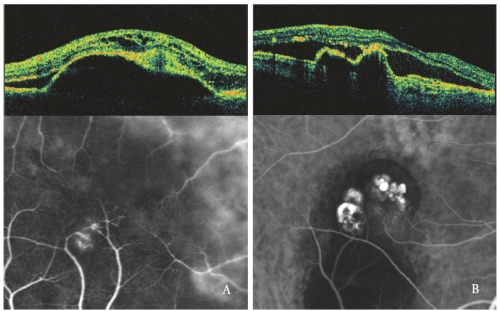
Figure 4 – NV de type 3 (RAP) (à gauche) et PCV (à droite) : Schémas OCT et ICGA.
L’introduction récente de l’angiographie OCT (OCT-A) a permis d’imager la perfusion des différentes couches rétiniennes, sans injection de colorant et en utilisant le flux endoluminal comme contraste intrinsèque.
La figure 5 fournit un exemple de la façon dont l’OCT-A image le réseau choroïdien dans un cas de PCV.
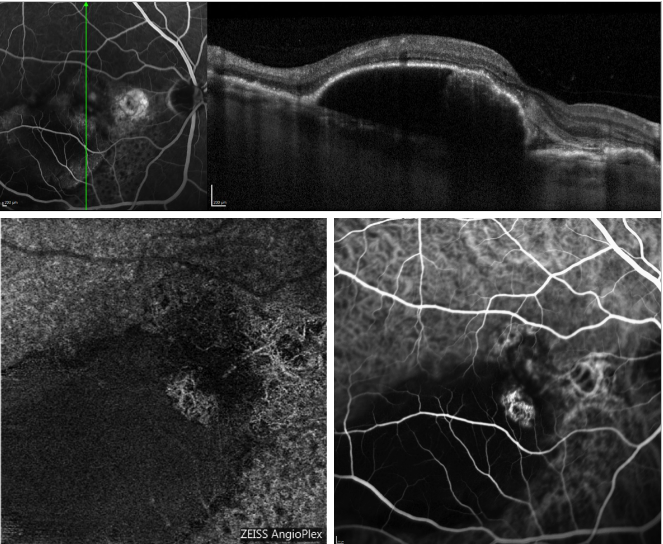
Figure 5 – PED séreux et PCV récurrent (FA, OCT, ICGA et OCT-A). En haut, scan OCT acquis simultanément avec la FA ; En bas, aspect du profil des polypes sur OCT-A (à gauche) et ICGA (à droite).
Toutefois, la nature statique de cet examen et la présence d’artefacts possibles sont des limites importantes qu’il faut reconnaître.
En ce qui concerne le PED séreux, l’ombrage dû à la perte de transmission du signal en correspondance du PED peut rendre difficile la détection du complexe CNV sur l’OCT-A (figure 6).
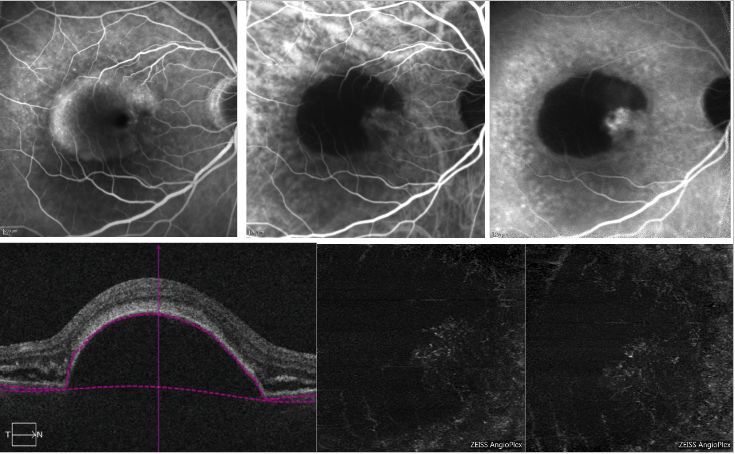
Figure 6 – PED vascularisé et PED séreux avec NV de type 1 (FA, ICGA et OCT-A) . En haut, l’AF (à gauche) montre une accumulation de colorant due à la présence d’un PED séreux ; l’ICGA (en haut, au milieu et à droite) montre un réseau néovasculaire sur le bord du PED (encoche) ; En bas, l’OCT-A ne fournit pas une imagerie précise du réseau néovasculaire.
L’évolution naturelle du PED séreux dépend de la présence ou non de la composante néovasculaire(34).
Dans les PED séreux purs, on observe généralement un élargissement lent de la lésion, avec une progression minime de la perte visuelle sur une longue période (mois ou années).
Cependant, beaucoup peuvent développer ultérieurement une néovascularisation, qui l’aggrave(35).
L’évolution naturelle dans les PED vascularisés peut varier, et elle est liée au type de nouveaux vaisseaux associés.
La complication aiguë la plus fréquente des PED est la déchirure de l’EPR(36-39).
Elle survient généralement au bord du DEP, à l’intersection de l’EPR détaché et de l’EPR attaché.
Cliniquement, la déchirure ou rip de l’EPR apparaît comme une zone bien définie de choroïde nue, contiguë à une zone rugueuse hyperpigmentée plus sombre, qui correspond au monticule de l’EPR qui s’est arraché(40,41).
L’EPR arraché roule généralement vers le CNV, et sa propension à se déchirer peut être prédite par l’observation de caractéristiques pré-déchirées, telles qu’une augmentation de la taille et une modification de la forme, la présence de petits trous aux marges de l’EPR, la présence d’hémorragies ou de liquide sous-rétinien, mais les aspects les plus notables sont le remplissage irrégulier du PED visible à la FA, la hauteur du PED > 580 nm, la durée > 4.5 mois, lignes radiales hyperréfléchissantes sur l’imagerie de proche réflectance, plus petit ratio de PED vascularisé et traitement anti-facteur de croissance endothélial vasculaire (anti-VEGF)(42-46).
Les déchirures de PED surviennent soit spontanément, soit après un traitement, formellement la photocoagulation au laser, la thérapie photodynamique et l’injection intravitréenne de stéroïdes ou d’agents anti-VEGF(47- 58).
La pathogénie exacte des déchirures de l’EPR est mal comprise.
Concernant l’évolution naturelle des DEP, l’hypothèse a été émise que les forces de cisaillement tangentielles dans le DEP peuvent provoquer la rupture de la membrane basale de l’EPR au bord du décollement ; cependant, il est plus probable que ce soit le résultat de plusieurs variables, où la présence d’un CNV joue un rôle majeur.
Plusieurs relations de cause à effet ont été rapportées pour les déchirures de l’EPR survenant après le traitement, notamment la chaleur générée par la photocoagulation, l’augmentation brutale du liquide intra EPR, une contraction du NVC associé et la résolution soudaine concomitante du liquide sous EPR.
La présence combinée d’une traction vitréomaculaire et la déformation du globe due au traumatisme mécanique par l’aiguille ont également été rapportées comme agents causaux(59).
Après une déchirure de l’EPR, la majorité des patients se plaignent d’une baisse visuelle soudaine et sévère.
Dans un petit pourcentage d’yeux, où la déchirure épargne la fovéa, les patients peuvent connaître une préservation temporaire d’une bonne fonction visuelle(60).
Cependant, à long terme, la progression d’une cicatrice sous-rétinienne entraîne une baisse visuelle sévère. Dans le pronostic de la DEP séreuse, il faut également prendre en compte le risque élevé d’atteinte bilatérale(61).
Le traitement de la DEP séreuse, associée ou non à un NVC, a toujours été un défi et il n’existe jusqu’à présent aucune directive recommandée pour leur prise en charge.
Les PED séreux purs ont été traités dans le passé avec une grille laser ou une photocoagulation dispersée, néanmoins avec des résultats décevants(61).
Le traitement des PED séreux, associés ou non à un CNV, a toujours été un défi et il n’y a jusqu’à présent aucune directive recommandée pour leur gestion. Les PED séreux purs ont été traités dans le passé avec une grille laser ou une photocoagulation dispersée, avec des résultats décevants(62).
Aucune autre approche n’a été tentée pour traiter ces lésions.
Lorsqu’un filet néovasculaire est présent, le traitement des PED séreux a été axé sur la gestion du NVC. Cependant, étant donné que les PED vascularisés n’ont jamais été inclus dans les grands essais contrôlés randomisés, nous devons prendre la décision de traitement sur la base de petites séries publiées, qui sont souvent rétrospectives et impliquent effectivement différentes approches thérapeutiques.
Maintenant, à l’ère de la thérapie anti-VEGF, tous les traitements employés précédemment semblent insatisfaisants.
La photocoagulation au laser a été largement employée et pourrait encore avoir une indication limitée lorsqu’un NVC bien défini par ICGA se trouve à distance de l’EPR détaché(63).
La thérapie photodynamique (PDT) à la vertéporfine seule s’est avérée nocive, augmentant le risque de déchirure de l’EPR, d’hémorragies et de baisse soudaine de l’acuité visuelle(39,48,49,64) (figure 7).
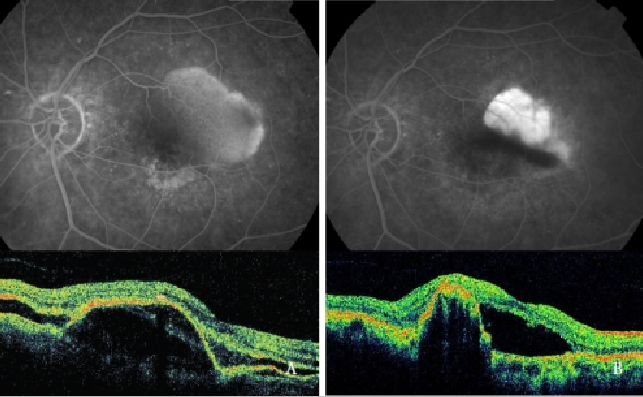
Figure 7 – PED vascularisé avec CNV (NV de type 1) avant (gauche) et après (droite) PDT : Déchirure de l’EPR (FA et OCT).
Cependant, la PDT combinée à l’injection intravitréenne d’acétonide de triamcinolone (IVTA) a été démontrée comme potentiellement capable de stabiliser l’acuité visuelle et de réduire les récidives(65).
Néanmoins, le taux élevé de complications (cataracte et glaucome) a réduit l’utilisation de la triamcinolone intravitréenne.
Après les résultats encourageants obtenus avec la thérapie intravitréenne anti-VEGF dans le traitement du CNV occulte, l’utilisation du traitement anti-VEGF a été étendue au PED vascularisé avec des résultats décevants(66-69).
Les complications aiguës et la mauvaise réponse anatomique au traitement invalident fréquemment nos tentatives de guérison de la lésion. On a signalé que des déchirures de l’EPR et des hémorragies sous-rétiniennes compliquaient les traitements intravitréens au ranibizumab et au bevacizumab(51-57).
De plus, le fluide sous-épithélial ne répond guère au traitement anti-VEGF, peut-être en raison des changements d’hydroconductivité de la membrane de Bruch(69).
Dans une série de cas rétrospective de 328 patients traités respectivement par bevacizumab, ranibizumab, pegaptanib et PDT+IVTA, après un suivi moyen de 42,4 semaines, les auteurs ont rapporté une stabilisation significative de l’acuité visuelle dans chaque groupe, meilleure dans ceux du bevacizumab et du ranibizumab par rapport aux deux autres, et une fréquence globale de déchirures de l’EPR de 12.5%.
Pourtant, ils concluent qu’avec ces traitements, seule une régression partielle des lésions peut être obtenue, et le risque de déchirures de l’EPR n’est pas évité(69).
Une autre étude rétrospective(58). a revu les résultats des patients atteints de PED vascularisés traités par PDT seule, PDT combinée avec IVTA ou injections intravitréennes anti-VEGF seules (bevacizumab ou ranibizumab) et a montré de meilleurs résultats fonctionnels pour le groupe de traitement anti-VEGF.
De plus, dans cette série, le NV de type 1 avec PED vascularisé par rapport au NV de type 3, ainsi qu’une meilleure acuité visuelle au départ, ont montré un plus grand risque de déchirure aiguë de l’EPR après traitement(58).
Dans une étude prospective récente(19), le traitement du PED associé au NV de type 1 sous-fovéal par injection intravitréenne de ranibizumab et avec une phase de charge de 3 mois et une stratégie pro re nata n’a donné que des résultats partiels sur un suivi de 24 mois.
Récemment, plusieurs études ont étudié l’efficacité du traitement par aflibercept intravitréen des PED dans la DMLA montrant une bonne réponse anatomique avec une amélioration ou pas de changement significatif de l’acuité visuelle(70-73).
De plus, l’aflibercept intravitréen s’est révélé être un traitement prometteur dans les PED résistants au traitement par ranibizumab intravitréen(72-74)..
Plusieurs études ont identifié les facteurs qui pourraient influencer la réponse des PED au traitement anti-VEGF(75-78).
Dirani et al.(75) ont montré qu’une meilleure amélioration visuelle était associée à une acuité visuelle de base plus faible, à la présence de liquide sous-rétinien et au RAP. En outre, dans leur série, la réduction de la PED était associée à une PED plus élevée au départ, à une PED séreuse prédominante et à l’utilisation d’aflibercept.
Cho et al.(76), dans une série de cas récente, ont constaté que la hauteur de la PED au départ, le PCV ou la RAP plus faibles par rapport à la DMLA néovasculaire typique, la PED séreuse par rapport à la PED fibrovasculaire et l’aflibercept par rapport au ranibizumab, ont une plus grande chance de résolution de la PED pendant le traitement anti-VEGF des PED.
Cependant, dans une récente analyse post hoc d’un essai contrôlé randomisé de phase III(77), il a été montré que, 24 mois après l’initiation du traitement anti-VEGF, environ la moitié des patients présentant un DEP au départ ont montré une résolution complète du DEP, indépendamment du statut du DEP et de la taille au départ.
Récemment, Chen et al.(78) ont souligné l’importance de différencier les yeux présentant un PED car ils ont de meilleurs résultats anatomiques et fonctionnels avec moins d’injections par rapport aux PED avec NV de type 1.
À l’avenir, de nouvelles combinaisons thérapeutiques et de nouvelles stratégies thérapeutiques, ainsi que l’identification de nouveaux biomarqueurs cliniques de réponse au traitement, contribueront à améliorer le pronostic des patients affectés par un PED vascularisé.
Les patients atteints d’un PED vascularisé peuvent être traités par des traitements anti-VEGF.