Lorsque l’on traite des isotopes d’un élément, il est important de rappeler qu’ils se distinguent les uns des autres par l’ajout du numéro de masse au nom dudit élément.
Dans votre cas, le nom bore-11 est utilisé pour désigner un isotope du bore dont le numéro de masse est égal à #11#.
Puisque le nombre de masse est défini comme la somme du nombre de protons et du nombre de neutrons que l’atome possède dans son noyau, il s’ensuit que vous pouvez écrire
#color(blue)(A = Z + « no. de neutrons ») » « #, où
#A# – le numéro de masse
#Z# – le numéro atomique
Comme vous le savez, l’identité d’un élément est donnée exclusivement par le nombre de protons qu’il possède dans son noyau. Ce nombre représente le numéro atomique de l’élément.
Donc, pour identifier le numéro atomique du bore, jetez un coup d’œil rapide à un tableau périodique. Remarquez que le bore, # »B « #, qui est situé dans la période 2, groupe 13 du tableau périodique, a un numéro atomique égal à #5#.
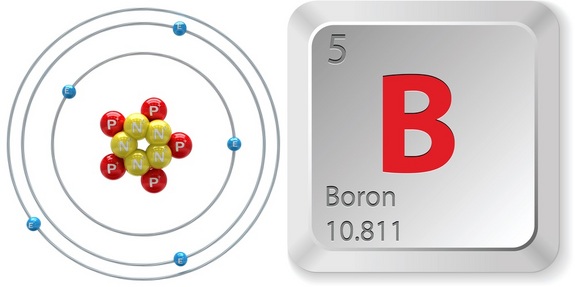
Cela signifie que tout atome qui a #5# protons dans son noyau sera un atome de bore.
Donc, le numéro de masse de cet isotope du bore est égal à #11#, et le numéro atomique à #5#.