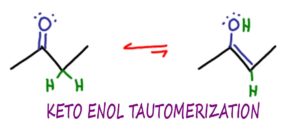
 La tautomérisation céto énol ou KET, est une réaction de chimie organique dans laquelle les molécules de cétone et d’énol peuvent s’isomériser ou s’interconvertir, typiquement dans une réaction catalysée par un acide ou une base.
La tautomérisation céto énol ou KET, est une réaction de chimie organique dans laquelle les molécules de cétone et d’énol peuvent s’isomériser ou s’interconvertir, typiquement dans une réaction catalysée par un acide ou une base.
La tautomérisation des cétones et des énols apparaîtra assez souvent dans votre cours de chimie organique, en commençant par les réactions d’hydratation des alcynes, et en réapparaissant dans vos réactions avancées (orgo 2) d’énolate et de condensation.
La tautomérisation est un type très spécifique d’isomérisation,
dans ce cas, l’interconversion entre les formes cétone et énol d’une molécule.

La cétone fait référence au groupe fonctionnel cétone – bien que le KET ne soit pas limité aux cétones JUST.
Les aldéhydes, qui sont très similaires aux cétones,
à l’exception d’un hydrogène terminal,
peuvent également subir une tautomérisation.
 Enol vient de ‘Ene’ comme dans alcène,
Enol vient de ‘Ene’ comme dans alcène,
une double liaison carbone-carbone.
Et ‘ol’ comme dans alcool – un groupe OH.
Vous vous sentez rouillé ? Revoyez les groupes fonctionnels de la chimie organique
Si la tautomérisation est comme l’isomérisation,
voyez les tautomères comme des isomères, plus précisément des isomères constitutionnels.
Le terme Tautomères fait référence aux deux formes spécifiques de la molécule qui peuvent s’interconvertir à l’équilibre.
Dans le cas de la KET, les formes céto et énol sont des tautomères l’une de l’autre.

Qui est le plus stable, céto ou énol ?
Malgré le fait qu’il s’agisse d’une réaction réversible, la forme céto est plus stable et donc favorisée par l’équilibre.
C’est parce que le carbone double lié à l’oxygène est plus stable qu’un carbone simple lié à l’oxygène et simple lié à l’hydrogène.
Heureusement, cette mathématique provient de la thermodynamique couverte de nouveau en chimie générale et quelque chose que vous n’avez pas à calculer au niveau de la chimie organique (certains professeurs l’exigent encore cependant).
Ce n’est pas une règle absolue.
Il y a certaines situations où la forme énol fournira une plus grande stabilité à la molécule globale. Regardez l’exemple ci-dessous :

La forme céto a un carbonyle plus stable, mais la forme énol permet à la liaison pi de faire partie d’un système aromatique beaucoup plus stable (revoir l’aromaticité ici). Par conséquent, la forme énol de cette molécule prédominera à l’équilibre.
La tautomérisation céto énol apparaîtra dans diverses réactions organiques, à commencer par l’hydroboration et l’oxymercuration des alcynes.
KET dans l’oxymercuration des alcynes
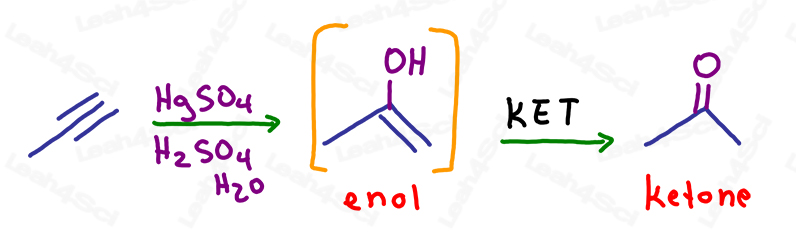
Comme pour les alcènes, la réaction d’oxymercuration rompt simplement UNE liaison pi pour ajouter un alcool au carbone le plus substitué, selon la règle de Markovnikov.
La molécule résultante possède toujours une liaison pi : un alcène sur le même carbone que l’alcool.
C’est un énol instable et il subira automatiquement une tautomérisation céto énol pour former un produit final cétone plus stable.
KET dans l’hydroboration des alcynes
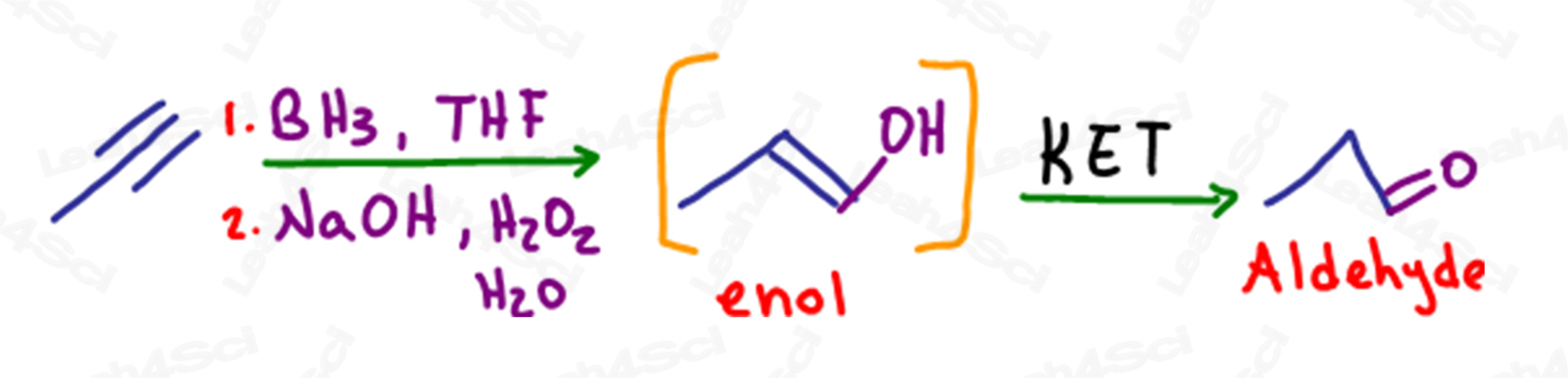
Comme pour les alcènes, l’hydroboration est une réaction anti-Markovnikov dans laquelle une liaison pi est rompue et un alcool est ajouté au carbone le moins substitué.
Dans le cas d’un alcyne terminal, lorsqu’une seule liaison pi est transformée en alcool, le carbone terminal possède toujours une liaison pi ou un alcène, ce qui en fait un énol.
Cette molécule subira également une tautomérisation pour former un produit aldéhyde plus stable.
Malgré la formation d’un aldéhyde, cette réaction est toujours considérée comme une tautomérisation céto énol.
Pour ces 2 réactions, la cétone ou l’aldéhyde résultant est déterminé par l’emplacement de l’énol.
Si l’énol est sur un carbone interne (non terminal), le produit résultant formera une cétone.
Si l’énol est terminal, alors le carbonyle résultant sera un aldéhyde.
La tautomérisation peut se produire dans des conditions catalysées par un acide et catalysées par une base.
Avec les réactions ci-dessus, considérez ce que doivent être les conditions après avoir subi une hydratation comme écrit.
La vidéo ci-dessous vous guide pas à pas
- Réaction et mécanisme de tautomérisation catalysée par un acide
- Réaction et mécanisme de tautomérisation catalysée par une base
- La réaction inverse (de la forme céto à la forme énol) pour les deux réactions
La réaction de tautomérisation catalysée par un acide.Catalyzed Tautomerization Mechanism Overview
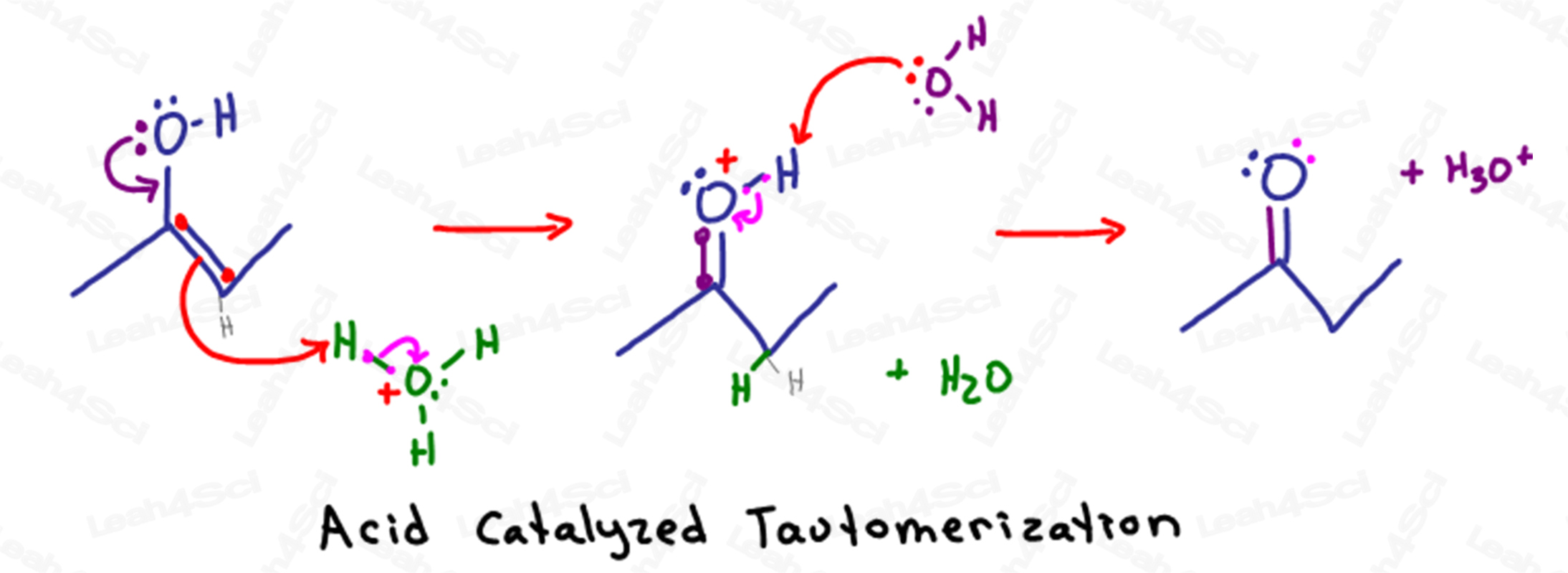
Rappellez-vous que dans les solutions aqueuses acides, nous avons beaucoup d’eau et d’hydronium (H3O+) disponibles en solution.
La tautomérisation commence lorsque les électrons partiellement négatifs de l’oxygène de l’alcool descendent jusqu’à attaquer l’atome de carbone sp2 (celui qui détient la liaison pi).
En formant une seconde liaison entre le carbone et l’oxygène, le carbone aurait un total de 5 liaisons.
Pour éviter de violer son octuor, le carbone va éjecter la liaison pi entre lui et l’autre atome de carbone sp2 en poussant les électrons sur l’autre carbone.
Au lieu de rester comme une paire solitaire sur le carbone, les électrons négatifs sont attirés par l’atome H+ partiellement positif sur une molécule d’hydronium voisine.
Comme cet atome H+ ne peut avoir qu’une seule liaison, il lâche les électrons qui le retiennent à l’oxygène, permettant à l’eau de flotter en solution.
La molécule résultante ressemble à une cétone, sauf pour l’atome d’oxygène instable.
L’oxygène, avec 2 liaisons au carbone, 1 liaison à l’hydrogène et une seule paire solitaire, a une charge positive instable.
Une autre molécule d’eau en solution utilise ses électrons partiellement négatifs pour déprotoner l’oxygène donc rendre ses électrons pour former une cétone stable neutre.
Faisons un peu de comptabilité rapide.
Cette réaction a commencé lorsque l’énol a attaqué l’hydronium, notre catalyseur acide.
Dans la dernière étape, l’eau déprotonise la cétone, reformant notre catalyseur acide hydronium.
Rappel : si l’énol est terminal, le produit résultant est un aldéhyde au lieu d’une cétone
Synthèse du mécanisme de la tautomérisation catalysée par une base
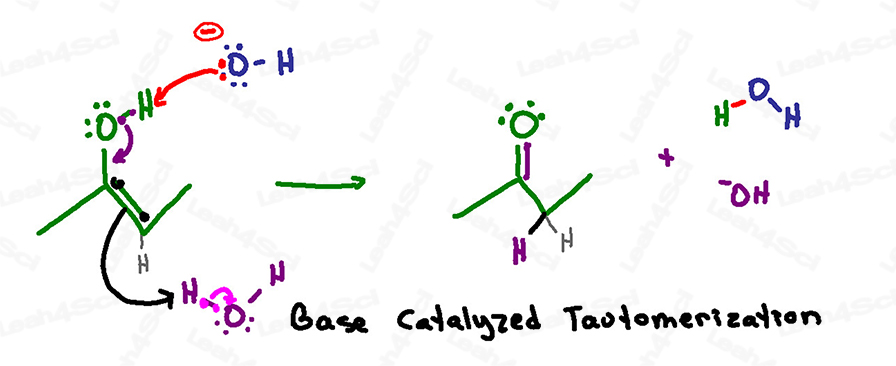
Rappel : dans une solution aqueuse basique, nous avons à la fois de l’hydroxyde et de l’eau qui flottent.
Ne jamais montrer de H+ ou d’hydronium dans une solution basique !
Cette réaction est très similaire au mécanisme catalysé par un acide, sauf que la déprotonation est la première étape plutôt que la dernière.
C’est parce que la solution basique peut gérer un oxygène négatif, mais la solution acide ne permet pas la formation d’un oxygène négatif.
Cette réaction commence lorsqu’un hydroxyde basique en solution atteint l’hydrogène acide sur l’énol.
Au lieu de se rabattre sur l’oxygène pour former un oxyde négatif, les électrons s’effondrent rapidement vers le bas pour former une liaison pi carbonyle entre le carbone et l’oxygène.
Comme pour le mécanisme catalysé par l’acide, le carbone doit éjecter sa double liaison actuelle pour éviter d’avoir 5 liaisons et de violer son octuor.
Les électrons de la liaison pi ne s’assoient pas et n’attendent pas sur l’autre carbone, au lieu de cela, ils cherchent et s’emparent d’un proton de la solution – l’attrapant sur une molécule d’eau.
En une seule série d’attaques (une étape), nous avons une cétone comme produit final.
Prêtez attention à ce qui a été utilisé et reformé dans cette réaction :
L’hydroxyde a saisi un proton formant de l’eau,
mais l’énol a saisi un proton sur l’eau formant de l’hydroxyde et reformant ainsi le catalyseur basique qui a initié cette réaction.
Rappel : si l’énol est terminal, le produit résultant est un aldéhyde au lieu d’une cétone
.