Des liaisons hydrogène peuvent se former entre le couple solitaire de l’atome d’azote très électronégatif et l’atome d’hydrogène légèrement positif d’une autre molécule.
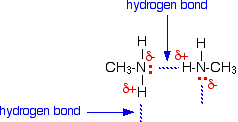
La liaison hydrogène n’est pas aussi efficace que dans l’eau, par exemple, car il y a une pénurie de paires solitaires. Certains atomes d’hydrogène légèrement positifs ne pourront pas trouver de paire solitaire avec laquelle se lier à l’hydrogène. Il y a deux fois plus d’hydrogènes appropriés que de paires solitaires.
Les points d’ébullition des amines primaires augmentent lorsque vous augmentez la longueur de la chaîne, en raison de la plus grande quantité de forces de dispersion de van der Waals entre les plus grosses molécules.
Amines secondaires
Pour une comparaison équitable, il faudrait comparer le point d’ébullition de la diméthylamine avec celui de l’éthylamine. Ce sont des isomères l’un de l’autre – chacun contient exactement le même nombre de mêmes atomes.
Le point d’ébullition de l’amine secondaire est un peu plus bas que celui de l’amine primaire correspondante avec le même nombre d’atomes de carbone.
Les amines secondaires forment toujours des liaisons hydrogène, mais le fait d’avoir l’atome d’azote au milieu de la chaîne plutôt qu’à l’extrémité rend le dipôle permanent sur la molécule légèrement inférieur.
Le point d’ébullition plus bas est dû aux attractions dipôle-dipôle plus faibles dans la diméthylamine par rapport à l’éthylamine.
Amines tertiaires
Cette fois, pour faire une comparaison juste, il faudrait comparer la triméthylamine avec son isomère le 1-aminopropane.
Si vous consultez le tableau plus haut dans la page, vous verrez que la triméthylamine a un point d’ébullition beaucoup plus bas (3,5°C) que le 1-aminopropane (48,6°C).
Dans une amine tertiaire, il n’y a pas d’atomes d’hydrogène attachés directement à l’azote. Cela signifie que la liaison hydrogène entre les molécules d’amine tertiaire est impossible. C’est pourquoi le point d’ébullition est beaucoup plus bas.
Solubilité dans l’eau
Les petites amines de tous types sont très solubles dans l’eau. En fait, celles que l’on trouve normalement sous forme de gaz à température ambiante sont normalement vendues sous forme de solutions dans l’eau – de la même manière que l’ammoniac est généralement fourni sous forme de solution ammoniacale.
Toutes les amines peuvent former des liaisons hydrogène avec l’eau – même les tertiaires.
Bien que les amines tertiaires n’aient pas d’atome d’hydrogène attaché à l’azote et ne puissent donc pas former de liaisons hydrogène avec elles-mêmes, elles peuvent former des liaisons hydrogène avec les molécules d’eau en utilisant simplement le couple solitaire sur l’azote.
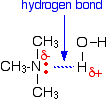
La solubilité diminue à mesure que les chaînes d’hydrocarbures s’allongent – de façon notable après environ 6 carbones. Les chaînes d’hydrocarbures doivent forcer leur chemin entre les molécules d’eau, en brisant les liaisons hydrogène entre les molécules d’eau.
Cependant, elles ne les remplacent pas par quelque chose d’aussi fort, et donc le processus de formation d’une solution devient de moins en moins faisable énergétiquement à mesure que la longueur de la chaîne augmente.
L’odeur
Les très petites amines comme la méthylamine et l’éthylamine ont une odeur très similaire à celle de l’ammoniac – bien que si vous les compariez côte à côte, les odeurs des amines soient légèrement plus complexes.
Lorsque les amines deviennent plus grosses, elles ont tendance à avoir une odeur plus « poissonneuse », ou une odeur de décomposition.
Si vous connaissez l’odeur de la fleur d’aubépine (et des choses à l’odeur similaire comme la fleur de cotoneaster), c’est l’odeur de la triméthylamine – une odeur douce et plutôt maladive comme les premiers stades de la chair en décomposition.
Questions pour tester votre compréhension
Si c’est la première série de questions que vous faites, veuillez lire la page d’introduction avant de commencer. Vous devrez utiliser le BOUTON PRÉCÉDENT de votre navigateur pour revenir ici par la suite.
Questions sur l’introduction aux amines
réponses
Où voulez-vous aller maintenant ?
Au menu des amines . .
Au menu des autres composés organiques . .
Au menu principal . .