Pravin U. Dugel, MD
Phoenix
L’edema maculare cistoide pseudofachico fu descritto per la prima volta da A. Ray Irvine Jr, MD,1 nel 1953 e ulteriormente chiarito da J. Donald M Gass, MD, nel 1969.2 Il Dr. Gass ha descritto che il picco di incidenza si è verificato a sei settimane dopo l’intervento e ha suggerito una differenza tra PCME angiografico e clinicamente significativo, in quanto solo pochi pazienti lamentavano una diminuzione della vista. La PCME clinica è ora definita come un’acuità visiva Snellen di 20/40 o peggio. I sintomi comuni includono una diminuzione dell’acuità visiva e della sensibilità al contrasto così come la metamorfopsia.
Anche se l’adozione della facoemulsificazione rispetto alla rimozione extracapsulare della cataratta ha diminuito il tasso di PCME dal 16 al 24%,3 il crescente uso di impianti di lenti intraoculari multifocali ha portato a maggiori aspettative da parte dei pazienti. A causa del design di questi nuovi impianti, che diminuiscono intrinsecamente la sensibilità al contrasto, anche una PCME lieve può comportare una riduzione significativa della qualità della visione e della soddisfazione del paziente. Quando la Food and Drug Administration approva l’uso di qualsiasi nuova IOL, afferma che il “tasso accettabile” di PCME clinicamente significativo dovrebbe essere inferiore al 5%. Data la rapida evoluzione della tecnologia chirurgica e delle IOL, la PCME “clinicamente significativa” potrebbe dover essere ridefinita per adattarsi alle esigenze e alle aspettative visive del paziente.
Incidenza
L’incidenza della PCME dopo la facoemulsificazione in pazienti non complicati e a basso rischio può variare dal 2% al 12%.4,5 Si ritiene che il picco di incidenza si verifichi sei settimane dopo l’intervento.2 I fattori predittivi dello sviluppo di PCME in questa popolazione comprendono una storia di occlusione della vena retinica, la presenza di una membrana epiretinica e l’uso preoperatorio di prostaglandine.4 Nei pazienti con caratteristiche ad alto rischio, come il diabete mellito, o in casi complicati, l’incidenza può essere molto più alta. (Heier JS, et al. Caratteristiche dei pazienti con ECM dopo la facoemulsificazione. Presentato alla riunione annuale dell’Accademia americana di oftalmologia; novembre 2007; New Orleans, LA.)
Meccanismo
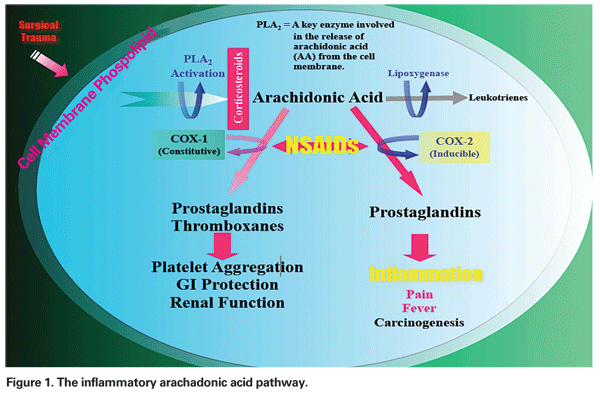
Il meccanismo con cui si sviluppa la PCME può essere multifattoriale, avendo vari gradi di componenti infiammatorie e meccaniche. La manipolazione chirurgica del segmento anteriore innesca il rilascio di acido arachadonico dalle membrane cellulari, che porta alla produzione di prostaglandine e leucotrieni attraverso le vie della ciclo-ossigenasi (COX) e della lipossigenasi (LOX), rispettivamente (Vedi Figura 1). Questi mediatori infiammatori aumentano la vasopermeabilità, portando così allo sviluppo del PCME.
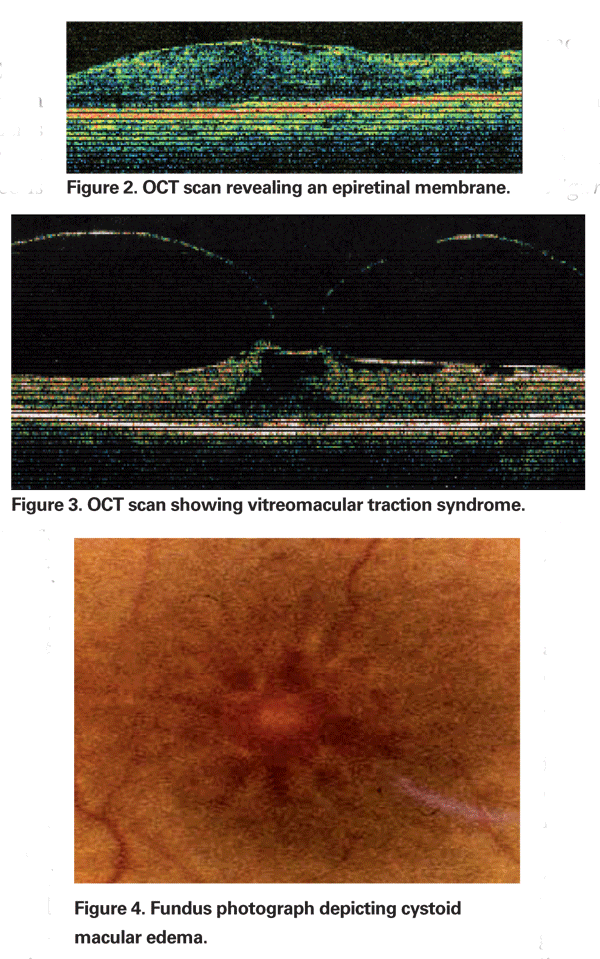
Occasione, l’infiammazione prodotta dall’estrazione della cataratta può causare la contrazione della faccia ialoide posteriore, con conseguente distorsione dei capillari parafoveali e conseguente edema maculare. L’uso crescente della tomografia a coerenza ottica è diventato un elemento importante nella valutazione del PCME. Le immagini OCT sono utili per identificare una componente meccanica dell’ECM, compresa la trazione vitreomaculare o le membrane epiretiniche (vedi figure 2 & 3).
Nei rari casi di PCME cronica e refrattaria in pazienti a basso rischio senza nessun’altra eziologia identificabile, l’occhio deve essere attentamente esaminato per i frammenti di lente trattenuti, la malposizione della IOL o la presenza di infezione da Propionibacterium acnes.
Diagnosi
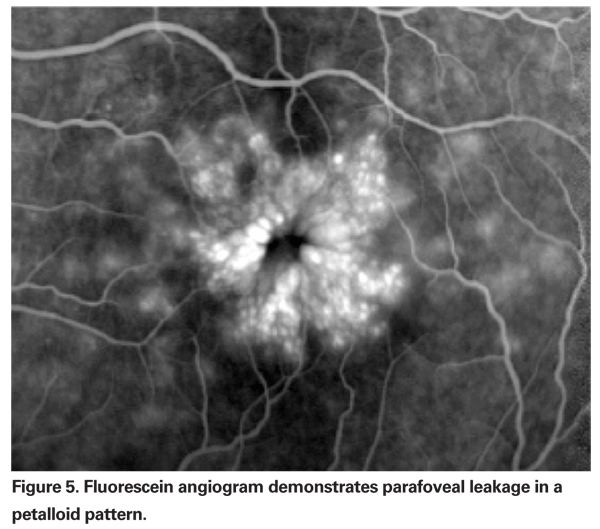
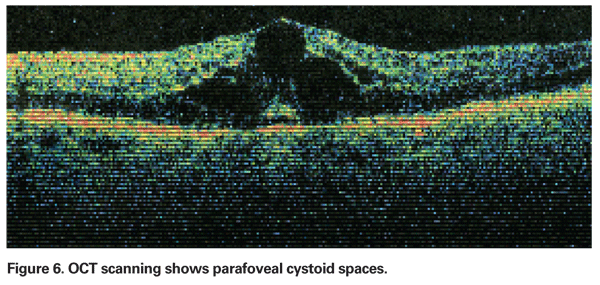
La PCME dovrebbe essere sospettata quando un paziente senza fattori di rischio sottostanti lamenta una diminuzione della vista o metamorfopsia dopo l’estrazione della cataratta. Clinicamente, l’edema intra-retinico contenuto in spazi simili a cisti in un modello a nido d’ape intorno alla fovea può essere visto (vedi Figura 4). Sull’angiogramma della fluoresceina, si può vedere un modello petalloide di perdita negli spazi intra-retinici parafoveali, insieme all’iperfluorescenza del disco ottico (vedi Figura 5). L’OCT può dimostrare chiaramente questi spazi cistoidi e calcolare lo spessore maculare centrale e il volume maculare totale (vedi Figura 6). I vantaggi dell’OCT sono la sua alta sensibilità, la non invasività, la fornitura di informazioni anatomiche e la capacità di quantificare l’edema maculare, anche se c’è una discutibile correlazione di questi valori con la funzione visiva.
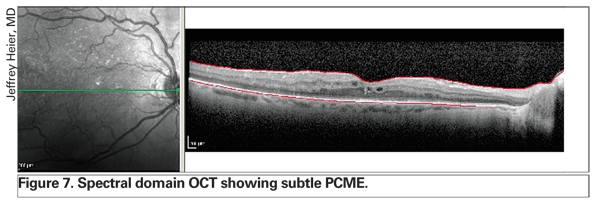
L’uso dell’OCT sta rivoluzionando la gestione dell’edema retinico. La tecnologia più recente, compreso il dominio spettrale OCT, offre una migliore risoluzione e può rilevare il PCME sottile prima della biomicroscopia con lampada a fessura e dell’angiografia con fluoresceina (vedi Figura 7). Inoltre, questa migliore strumentazione permette al medico di distinguere tra l’edema esclusivamente intraretinico e il fluido epiteliale sottoretinico o sottopigmentario, che può fornire informazioni prognostiche (vedi Figura 8). Secondo l’esperienza di diversi specialisti della retina, la presenza di un distacco epiteliale di pigmento subfoveale può far presagire una prognosi peggiore.
Prevenzione
Ci sono state diverse revisioni retrospettive e studi prospettici che hanno valutato l’effetto della profilassi nonfarmaci antinfiammatori non steroidei sui tassi di PCME quando usati preoperatoriamente rispetto al postoperatorio. In un rapporto, tre giorni di pretrattamento con ketorolac trometamina (Acular) sono stati superiori alle gocce somministrate un’ora prima dell’intervento.6 Rispetto al trattamento con i soli corticosteroidi postoperatori, un altro gruppo ha riportato una riduzione del PCME dal 12% allo 0% con due giorni di diclofenac sodico preoperatorio (Voltaren) e la combinazione diclofenac/corticosteroide postoperatoria.5
Utilizzando l’OCT per quantificare il volume maculare, i ricercatori hanno scoperto che due giorni di pretrattamento con ketorolac e la terapia combinata postoperatoria con ketorolac/steroide hanno portato a una riduzione del 46% del gonfiore maculare un mese dopo l’intervento rispetto a un gruppo di controllo di soli steroidi.7 Recentemente, uno studio prospettico randomizzato che ha confrontato tre giorni di ketorolac e terapia combinata preoperatoria con il solo corticosteroide ha riportato che, sulla base dell’OCT, i pazienti del gruppo di controllo avevano un’incidenza del 2,4% di PCME rispetto allo 0% nella coorte della combinazione.8 Anche se i pazienti nel gruppo dei corticosteroidi avevano un’incidenza significativamente maggiore di ispessimento retinico ≥15 µm, non c’era alcuna differenza statistica nell’acuità visiva meglio corretta tra i due gruppi quattro settimane dopo l’intervento.
In una valutazione prospettica di tre gruppi assegnati a indometacina topica per tre giorni preoperatoriamente seguita da terapia combinata, solo terapia combinata postoperatoria o solo corticosteroide, l’incidenza di PCME angiografica è stata ridotta dal 32.8 per cento (solo corticosteroide) al 15 per cento (combinazione postoperatoria) allo 0 per cento (FANS pre e postoperatorio).9
Un altro rapporto ha affermato che l’aggiunta di nepafenac sodico (Nevanac) a un regime corticosteroideo postoperatorio ha ridotto i tassi di PCME dal 2,1 per cento allo 0 per cento rispetto al solo corticosteroide.10 Un recente confronto prospettico randomizzato di diclofenac da solo rispetto al betametasone postoperatorio ha rilevato che, a cinque settimane dall’intervento, l’incidenza di ECM angiografica era inferiore nel gruppo FANS (18,8%) rispetto al gruppo corticosteroide (58,0%).11
Questi studi dimostrano che l’uso profilattico dei FANS riduce l’incidenza di PCME, e che la loro efficacia è maggiore se iniziati almeno tre giorni prima dell’intervento e continuati nel postoperatorio per diverse settimane. Tuttavia, la tempistica esatta e la durata del trattamento preoperatorio e postoperatorio, e l’identificazione dei pazienti che ne beneficerebbero maggiormente, rimangono ancora indeterminati.
Caratteristiche ad alto rischio
Come già detto, in una serie di 1,659 casi consecutivi, la membrana epiretinica, una storia di occlusione venosa o l’uso preoperatorio di analoghi della prostaglandina aumentavano notevolmente il rischio di sviluppo di PCME.4 Esaminando una serie di pazienti consecutivi indirizzati a una clinica retinica per la gestione della PCME, un altro gruppo ha riscontrato che le caratteristiche ad alto rischio erano diabete mellito, ipertensione, precedente chirurgia oculare, membrana epiretinica ed estrazione complicata della cataratta. (Heier JS, et al.) Dato che una varietà di malattie mediche e oculari può predisporre i pazienti allo sviluppo di PCME, l’identificazione di questi pazienti e una terapia profilattica aggressiva con FANS topici dovrebbero essere utilizzati per ridurre il rischio di sviluppare PCME.
Trattamenti
– FANS. Questa classe di farmaci inibisce la produzione di prostaglandine attraverso l’inibizione della via COX (Vedi Figura 1). Poiché i FANS non hanno alcun effetto sui livelli di prostaglandine preformate o esistenti, il trattamento prima del trauma chirurgico è essenziale. In un recente articolo di revisione, l’autore ha raccomandato un trattamento preoperatorio con FANS per due giorni nei pazienti a basso rischio e per una settimana nei pazienti ad alto rischio, con continuazione per almeno quattro settimane post-operatorie in entrambi i gruppi.12
Esistono ancora dubbi su quale FANS sia più efficace nel prevenire o trattare la PCME.
I FANS di nuova generazione, come il bromfenac sodico (Xibrom) e il nepafenac, hanno modificato la loro struttura chimica, aumentandone la penetrazione oculare e la potenza teorica.13 I test in vitro hanno rilevato che la potenza relativa dell’inibizione della COX-2 è 18 volte maggiore per il bromfenac rispetto al ketorolac, sebbene il significato clinico di questi dati sia sconosciuto.14 Uno studio di farmacocinetica in vivo ha rivelato che le concentrazioni nell’umore acqueo del nepafenac disponibile in commercio (nepafenac più amfenac) sono significativamente maggiori di quelle del bromfenac o del ketorolac.15 Tuttavia, non è noto se queste differenze di penetrazione si traducano in migliori risultati clinici. Sebbene siano state fatte numerose affermazioni di marketing che implicano che la migliore penetrazione, i cambiamenti strutturali e la maggiore potenza proposta dai FANS di nuova generazione si traducano in una maggiore efficacia clinica, non è stato fatto alcuno studio definitivo per confermarlo.
– Terapia di combinazione. Uno studio prospettico, randomizzato, in doppio mascherato, che valutava il ketorolac rispetto al prednisolone rispetto alla terapia di combinazione per PCME clinicamente significativo, ha scoperto che i pazienti che ricevevano la terapia di combinazione raggiungevano un cambiamento medio di ≥2 linee di visione entro la loro seconda visita, mentre i pazienti nei due gruppi di monoterapia non hanno mai raggiunto un miglioramento medio di due linee a tre mesi di follow-up.16 I pazienti trattati con la terapia combinata o con il solo ketorolac hanno anche risposto più rapidamente dei pazienti del gruppo prednisolone.
– Iniezioni di corticosteroidi. I corticosteroidi lavorano più a monte nello stesso percorso dei FANS, inibendo il rilascio di acido arachadonico dai fosfolipidi della membrana cellulare, impedendo così la formazione di leucotrieni e prostaglandine (Vedi Figura 1).
Il dibattito continua per quanto riguarda la via di somministrazione più efficace (sub-Tenone contro intravitreale), il dosaggio ottimale (4 mg contro maggiore), e la sicurezza del paziente (rischi di ipertensione oculare, distacco di retina, emorragia vitreale ed endoftalmite).
Attualmente, non esistono studi clinici randomizzati che valutino queste modalità di trattamento, e i risultati pubblicati appaiono contraddittori.
Un gruppo di ricercatori ha scoperto che il triamcinolone intravitreale per la PCME persistente ha portato a un miglioramento dell’acuità visiva, una diminuzione dello spessore maculare e un aumento dei valori dell’elettroretinogramma multifocale.17 Un altro ha riferito che l’uso di 4 mg di IVTA nella PCME cronica refrattaria ha prodotto un miglioramento anatomico e funzionale dopo un mese dall’iniezione e persistente per almeno tre mesi.18 Tuttavia, l’effetto benefico è stato temporaneo, poiché l’acuità visiva e lo spessore maculare sono tornati ai livelli precedenti all’iniezione nonostante i trattamenti multipli. In un’altra piccola serie, i pazienti hanno mantenuto un miglioramento dell’acuità e una diminuzione dello spessore maculare dopo una singola dose di 4 mg di IVTA per PCME refrattario.19
– Acetazolamide. L’acetazolamide aumenta il trasporto del fluido sottoretinico e ha dimostrato di rimuovere l’edema cistoide foveale in disturbi come la retinite pigmentosa, l’afachia e la formazione di membrane epiretiniche maculari.20-23 Ci sono una manciata di case report che correlano la risoluzione della PCME con l’uso di acetazolamide orale, ma ad oggi non sono stati eseguiti studi clinici.
– Agenti anti fattore di crescita endoteliale vascolare. Il trauma chirurgico porta a un’infiammazione post-operatoria che può portare a PCME attraverso un aumento della produzione di fattori vasopermeabili come il fattore di crescita endoteliale vascolare. Anche in questo caso, piccole serie di casi forniscono prove contraddittorie. Dopo l’iniezione intravitreale di bevacizumab (Avastin), un gruppo ha scoperto che il 71% dei pazienti ha guadagnato due o più linee di visione ETDRS;24 e un altro ha riferito che tutti gli occhi nella loro serie hanno avuto un miglioramento statisticamente significativo della visione.25 Tuttavia un altro studio ha riferito che il bevacizumab intravitreale non ha migliorato l’acuità visiva nei pazienti con PCME.26
– Vitrectomia. La vitrectomia pars plana con peeling della membrana può essere considerata nei casi di PCME con una componente meccanica identificata all’esame clinico o tramite OCT, o nei casi di edema cronico refrattario che non risponde alla terapia medica. In una piccola serie, l’intervento chirurgico ha portato a un miglioramento superiore a tre linee nell’acuità visiva meglio corretta nella maggior parte dei pazienti e alla risoluzione della PCME in tutti i casi.27 Esistono anche casi riportati in letteratura che indicano un miglioramento visivo dopo vitrectomia e peeling della membrana limitante interna.28 Come menzionato in precedenza, la vitrectomia pars plana dovrebbe essere considerata nei casi di frammenti di lente trattenuti, malposizione della IOL o infezione da P. acnes.
Direzioni future
Come già detto, i corticosteroidi agiscono all’inizio della cascata infiammatoria. Posurdex (Allergan) è un sistema di consegna di desametasone sostenuto biodegradabile che viene impiantato nella cavità vitrea. La sua matrice polimerica si trasforma gradualmente in acido lattico e glicolico, che vengono a loro volta scomposti in acqua e anidride carbonica. In uno studio di fase II, il 54% dei pazienti affetti da PCME e da ECM associata a uveite ha mostrato un miglioramento di almeno 10 lettere di acuità al 90° giorno post-impianto, rispetto a solo il 14% che ha mostrato un risultato simile nel gruppo di osservazione.
Recentemente, la FDA ha approvato Triesence (Alcon), triamcinolone acetonide, per l’iniezione intravitreale durante l’intervento. Questo farmaco può essere usato off-label nell’algoritmo di trattamento della PCME recalcitrante.
È evidente che la definizione di PCME si è evoluta negli ultimi anni. Con circa 3 milioni di interventi di cataratta eseguiti negli Stati Uniti all’anno e le accresciute aspettative dei pazienti, è importante che gli specialisti della retina comprendano la varia patogenesi, i fattori di rischio e la corretta gestione della PCME. La nuova tecnologia ha rivoluzionato e rivoluzionerà la diagnosi, la prognosi e il trattamento di questa condizione.
Gli autori esercitano presso Retinal Consultants of Arizona, Phoenix. Il Dr. Jamal esercita anche presso Texas Retina Associates, Dallas, e il Dr. Goldenberg esercita presso Associated Retinal Consultants, Royal Oak, Mich. Contattare il Dr. Dugel a pdugel @gmail.com.
1. Irvine SR. Una sindrome vitreale di nuova definizione dopo la chirurgia della cataratta. Am J Ophthalmol 1953; 36:599-619.
2. Gass JD, Norton EW. Studio di follow-up dell’edema maculare cistoide dopo l’estrazione della cataratta. Trans Am Acad Ophthalmol Otolaryngol 1969;73(4):665-82.
3. Wright PL, Wilkinson CP, Balyeat HD, et al. Edema maculare cistoide angiografico dopo l’impianto di lenti a camera posteriore. Arch Ophthalmol 1988;106:740-744.
4. Henderson BA, Kim JY, Ament CS, et al. Edema maculare cistoide pseudofachico clinico. Fattori di rischio per lo sviluppo e la durata dopo il trattamento. J Cataract Refract Surg 2007;33:1550-8.
5. McColgin AZ, Raizman MB. Efficacia del Voltaren topico nel ridurre l’incidenza dell’edema maculare cistoide post operatorio. Invest Ophthmol Vis Sci 1999;40 S289.
6. Donnenfeld ED, Perry HD, Wittpenn JR, et al. Ketorolac tromethamine preoperatorio 0,4 per cento nei risultati di facoemulsificazione: Curva farmacocinetica-risposta. J Cataract Refract Surg 2006;32:1474-82.
7. Almeida DR, Johnson D, Hollands H, Smallman D, et al. Effetto dei farmaci antinfiammatori non steroidei profilattici sull’edema maculare cistoide valutato utilizzando la quantificazione della tomografia a coerenza ottica del volume maculare totale dopo la chirurgia della cataratta. J Cataract Refract Surg 2008;34:64-9.
8. Wittpenn JR, Silverstein S, Heier J, et al. A Randomized, Masked Comparison of Topical Ketorolac 0.4 percent Plus Steroid vs Steroid Alone in Low-Risk Cataract Surgery Patients. Am J Ophthalmol 2008; 146:554 -560.
9. Yavas GF, Oztürk F, Küsbeci T. Indometacina topica preoperatoria per prevenire l’edema maculare cistoide pseudofachico. J Cataract Refract Surg 2007;33:804-7.
10. Wolf EJ, Braunstein A, Shih C, et al. Incidenza dell’edema maculare pseudofachico visivamente significativo dopo una facoemulsificazione senza problemi in pazienti trattati con nepafenac. J Cataract Refract Surg 2007;33:1546-1549.
11. Asano S, Miyake K, Ota I, et al. Riduzione dell’edema maculare cistoide angiografico e rottura della barriera emato-acquosa dopo la facoemulsificazione a piccola incisione e l’impianto di lenti intraoculari pieghevoli: Confronto prospettico randomizzato multicentrico tra diclofenac 0,1 per cento e betametasone 0,1 per cento. J Cataract Refract Surg 2008;34:57-63.
12. O’Brien TP. Linee guida emergenti per l’uso della terapia con FANS per ottimizzare la cura del paziente in chirurgia della cataratta. Curr Med Res & Opin. 2005;21:1131-1137.
13. Walsh DA, Moran HW, Shamblee DA, et al. agenti antinfiammatori 3. Sintesi e valutazione farmacologica di 2-amino-3-benzoilfenilacetico e analoghi. J Medicinal Chem 1984;27:1379-1388.
14. Waterbury LD, Silliman D, Jolas T. Confronto dell’attività inibitoria della cicloossigenasi e degli effetti antinfiammatori oculari del ketorolac tromethamine e del bromfenac sodico. Curr Med Res Opin 2006;22: 1133-1140.
15. Walters TR, Raizman M, Ernest P, et al. Farmacocinetica in vivo e farmacodinamica in vitro di nepafenac, amfenac, ketorolac e bromfenac. J Cataract Refract Surg 2007;33;1539-1545.
16. Heier JS, Topping TM, Baumann W, et al. Ketorolac versus prednisolone versus terapia combinata nel trattamento dell’edema maculare cistoide pseudofachico acuto. Ophthalmology 2000;107:2034-8.
17. Koutsandrea C, Moschos MM, Brouzas D, et al. Triamcinolone acetonide intraoculare per edema maculare cistoide pseudofachico: Tomografia a coerenza ottica e studio di elettroretinografia multifocale. Retina 2007;27:159-64.
18. Boscia F, Furino C, Dammacco R, et al. Triamcinolone acetonide intravitreale nell’edema maculare cistoide pseudofachico refrattario: Risultati funzionali e anatomici. Eur J Ophthalmol 2005;15:89-95.
19. Karacorlu M, Ozdemir H, Karacorlu S. Triamcinolone acetonide intravitreale per il trattamento dell’edema maculare cistoide pseudofachico cronico. Acta Ophthalmol Scand 2003;81:648-52.
20. Marmor MF. Ipotesi sul trattamento con anidrasi carbonica dell’ECM: esempio con membrana epiretinica. Arch Ophthalmol 1990;108:1524-1525.
21. Cox SN, Hay E, Bird AC. Trattamento dell’edema maculare cronico con acetazolamide. Arch Ophthalmol 1988;106:1190-1195.
22. Fishman GA, Gilbert COT, Fiscella RG et al. Acetazolamide per il trattamento dell’edema maculare cronico nella retinite pigmentosa. Arch Ophthalmol 1989;107:1445-1452.
23. Wolfensberger TJ, Chiang R, Takeuchi A et al. L’inibizione dell’anidrasi carbonica legata alla membrana migliora l’assorbimento del liquido sottoretinico e l’adesività della retina. Graefe’s Arch Clin Exp Ophthalmol 2000; 238:76-80.
24. Arevalo JF, Garcia-Amaris RA, Roca JA, et al. Bevacizumab intravitreale primario per la gestione dell’edema maculare cistoide pseudofachico: Studio pilota del Pan-American Collaborative Retina Study Group. J Cataract Refract Surg. 2007;33:2098-105.
25. Barone A, Russo V, Prascina F, et al. Sicurezza ed efficacia a breve termine del Bevacizumab intravitreale per l’edema maculare cistoide pseudofachico. Retina 2008 Oct 9.
26. Spitzer MS, Ziemssen F, Yoeruek E, et al. Efficacia del bevacizumab intravitreale nel trattamento dell’edema maculare cistoide pseudofachico postoperatorio. J Cataract Refract Surg 2008;34:70-5.
27. Pendergast SD, Margherio RR, Williams GA, et al. Vitrectomia per edema maculare cistoide pseudofachico cronico. Am J Ophthalmol 1999;128:317-23.
28. Peyman GA, Canakis C, Livir-Rallatos C, et al. L’effetto del peeling della membrana limitante interna sull’edema maculare pseudofachico cistoide cronico recalcitrante: Un rapporto di due casi. Am J Ophthalmol 2002;133:571-2.