Complicazioni precoci
Separazione mucocutanea
Necrosi dello stoma
Ritrazione dello stoma
 Complicazioni tardive
Complicazioni tardive
Stenosi stomale
Prolasso stomale
Trauma stomale
Ernia parastomale
 Conclusioni
Conclusioni
Le complicazioni che seguono la creazione chirurgica di una stomia sono un problema significativo per molti individui. Queste complicazioni sono spesso sfaccettate e coinvolgono sia aspetti fisiologici che psicosociali. L’aspetto fisiologico delle complicazioni della stomia coinvolge i cambiamenti dello stoma e della pelle peristomale (Cottam et al., 2007). In questo capitolo, discutiamo l’aspetto fisiologico delle complicanze della stomia che coinvolgono lo stoma.
Le complicanze della stomia sono un problema significativo per gli individui con una stomia, tuttavia, le definizioni e la terminologia spesso non sono coerenti in letteratura (Colwell et al., 2001; Salvadalena, 2008). Le differenze nel disegno dello studio, le definizioni e la terminologia incoerenti e la tempistica delle misurazioni rendono difficile misurare accuratamente l’incidenza delle complicazioni della stomia (Salvadalena, 2008). A causa dell’uso incoerente della terminologia, la differenziazione tra complicazioni stomia e peristomia può essere difficile.
Sono stati riportati tassi di incidenza globale delle complicazioni, anche se i range sono molto ampi. Due revisioni sistematiche complete della letteratura sulle complicanze della stomia hanno indicato che dal 18% al 55% dei pazienti con una stomia hanno sperimentato l’irritazione della pelle peristomale, dall’1% al 37% l’ernia parastomale, dal 2% al 25% il prolasso stomale, dal 2% al 10% la stenosi e dall’1% all’11% la retrazione dello stoma (Colwell et al., 2001; Salvadalena, 2008). Ratliff et al. (2005) hanno riferito che dal 10% al 70% di tutti i pazienti con una stomia sviluppano complicazioni (Ratliff et al., 2005). Mettendo questo in una prospettiva pratica, utilizzando le stime di cui sopra, le complicazioni dello stoma rappresentano un problema significativo con fino a 560.000 individui che ricevono una stomia che sperimentano complicazioni legate alla stomia. Se usiamo l’incidenza annuale, ci si può aspettare che fino a 84.000 individui con una nuova stomia sviluppino complicazioni legate alla stomia ogni anno (Pittman, 2011).
Varie caratteristiche del paziente sono state identificate come associate alle complicazioni della stomia, ma gli studi con modelli di analisi predittiva sono limitati. Diversi studi hanno identificato che un indice di massa corporea più elevato (BMI), l’età più avanzata, la chirurgia d’urgenza, le malattie infiammatorie intestinali, l’avere una ileostomia (rispetto alla colostomia), una procedura di deviazione “ad anello”, la scarsa qualità dell’intestino, la colite ischemica, la retrazione stomale, la mancanza di educazione preoperatoria e il coinvolgimento di un infermiere specializzato in ferite, stomia e continenza (WOC) influenzano lo sviluppo di complicazioni della stomia (Bass et al., 1997; Colwell et al., 2001; Duchesne et al., 2002; Park et al., 1999; Pittman et al., 2008). Nello studio retrospettivo di riferimento condotto da Bass presso il Cook County Hospital di Chicago, i tassi di complicazione sono stati confrontati tra i pazienti che hanno ricevuto l’istruzione preoperatoria e la marcatura del sito dello stoma da parte di un terapista enterostomale (infermiere WOC) e quelli che non l’hanno ricevuta (Bass et al., 1997). Hanno scoperto che tra coloro che hanno ricevuto l’istruzione preoperatoria e la marcatura del sito dello stoma da parte di un terapista enterostomico, il 32,5% ha sviluppato complicazioni rispetto al 43,5% di coloro che non hanno ricevuto questi interventi clinici (p = 0,05). Il modello concettuale delle complicazioni della stomia (Fig. 16-1) fornisce un quadro di riferimento per esplorare le complicazioni della stomia e i fattori di rischio che contribuiscono al loro verificarsi (Pittman et al., 2014).
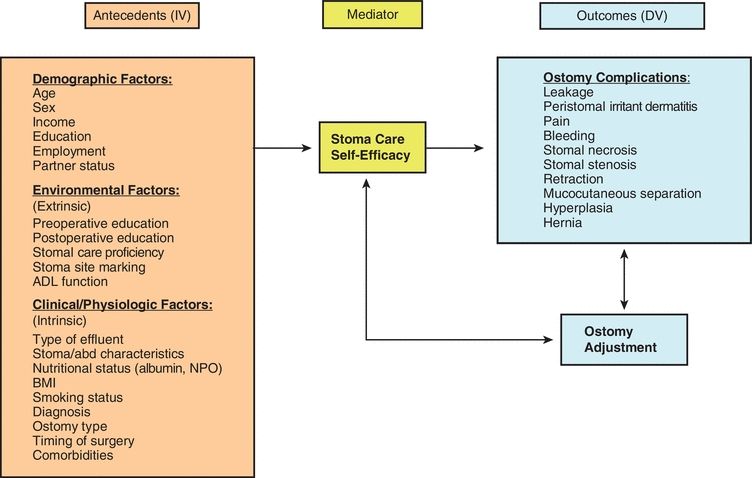
FIGURA 16-1. Pittman Ostomy Complication Conceptual Model.
Un metodo per classificare le complicazioni della stomia è quello di separarle in complicazioni precoci, entro 30 giorni dall’intervento, e tardive, >30 giorni dall’intervento (Duchesne et al, 2002; Kim & Kumar, 2006; Park et al., 1999; Shabbir & Britton, 2010). In questo capitolo, organizziamo la nostra discussione sulle complicazioni stomali utilizzando questa classificazione, riconoscendo che alcune complicazioni possono verificarsi sia in tempi precoci che tardivi.
Complicanze precoci
Le complicazioni stomali precoci sono quelle che comunemente si verificano entro 30 giorni dalla chirurgia e comprendono la separazione mucocutanea, la necrosi stomale e la retrazione stomale.
Separazione mucocutanea
Eziologia/Incidenza
La separazione mucocutanea è il distacco del tessuto stomale dalla pelle peristomale circostante (Colwell & Beitz, 2007) dello stoma, e la giunzione mucocutanea può essere il risultato di una scarsa guarigione, tensione o infezione. L’incidenza della separazione mucocutanea è stata riportata dal 4% al 24%. Park et al. (1999) hanno riportato che il 4% dei pazienti aveva una separazione mucocutanea nella loro revisione di 1.616 pazienti con stoma (Park et al., 1999). In uno studio prospettico su 3.970 stomi, Cottam et al. (2007) hanno riportato che il 24% aveva una separazione mucocutanea. In un altro studio su 71 soggetti, il 13% aveva una separazione mucocutanea (Pittman et al., 2014).
Presentazione
Gli stomi sani avranno una giunzione mucocutanea strettamente approssimata e intatta (dove lo stoma è attaccato alla parete addominale). Già 24 ore dopo l’intervento, lo stoma e la giunzione mucocutanea possono iniziare a separarsi.
Valutazione
La valutazione dello stoma viene fatta attraverso una stretta osservazione visiva dello stoma e dell’integrità della giunzione mucocutanea. La separazione è evidente se lo stoma si stacca dalla pelle peristomale (Fig. 16-2). La separazione mucocutanea può verificarsi in gradi variabili di gravità: parziale, se è solo una parte della circonferenza dello stoma, o completa, se è coinvolta l’intera circonferenza. La separazione può anche essere superficiale, solo a livello della pelle, o a tutto spessore, estendendosi a livello della fascia (Franchini et al., 1983). È necessaria un’attenta osservazione dell’area di separazione, annotando la profondità, le caratteristiche del tessuto di base della ferita (necrotico, granulare), e il tipo di drenaggio (sieroso, purulento, fecale).
CLINICAL PEARL
Utilizzare un applicatore con punta di cotone per valutare la profondità della separazione mucocutanea.
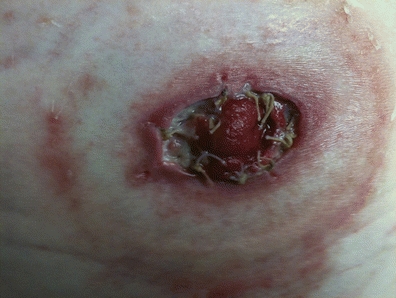
FIGURA 16-2. Separazione mucocutanea.
Gestione
La gestione della separazione mucocutanea dipende dal grado della separazione. Se la separazione è parziale e superficiale, il difetto sottocutaneo può essere piccolo e può essere gestito in modo conservativo. Il difetto sottocutaneo può essere trattato come una ferita e riempito con un prodotto avanzato per ferite come la polvere barriera cutanea, l’idrofibra o l’alginato di calcio. La barriera cutanea del sistema di imbustamento viene applicata sopra la pelle peristomale e il difetto per fornire protezione dall’effluente stomale. Il sistema di imbustamento viene cambiato quando necessario per gestire il drenaggio, valutare la guarigione e riapplicare il materiale di riempimento assorbente (Colwell, 2004).
Se il difetto è grande, allora la contaminazione fecale del difetto sottocutaneo peristomale è probabile e può verificarsi un’infezione. Più grave è la separazione, più probabile è la retrazione dello stoma. Con la guarigione, la probabilità di stenosi è alta. Se la separazione mucocutanea coinvolge lo strato fasciale (un evento riportato raramente), lo stoma può cadere nella cavità addominale e può verificarsi una contaminazione dell’addome con effluenti fecali e una peritonite generalizzata. Un ritorno in chirurgia è indicato per la riparazione.
Necrosi stomale
Eziologia/Incidenza
La necrosi stomale è definita come la morte del tessuto stomale risultante dall’alterazione del flusso sanguigno (Colwell & Beitz, 2007) ed è stata identificata come una delle complicazioni precoci più comuni (Duchesne et al, 2002; Kim & Kumar, 2006; Park et al., 1999; Shabbir & Britton, 2010). L’ischemia del tessuto stomale è solitamente causata dalla tensione o dall’inadeguatezza della vascolarizzazione mesenterica verso l’estremità intestinale. Può anche essere causata da un trauma al tessuto stomale durante la sua creazione. La necrosi dello stoma è stata associata all’obesità ed è spesso il risultato della trazione esercitata sul mesentere e sulla parete intestinale (Colwell & Fichera, 2005).
Presentazione
La necrosi stomale imminente è evidenziata da una progressione della decolorazione del tessuto stomale dal rosa al nero. Lo stoma di solito appare scuro e secco entro ore o giorni dall’intervento, per poi diventare nero e flaccido. Il grado di necrosi può variare a seconda del grado di ischemia. Può comprendere l’intero stoma, estendendosi al di sotto della fascia, o solo una parte dello stoma, e al di sopra del livello della pelle.
Valutazione
La valutazione della necrosi stomale viene fatta tramite un’attenta osservazione visiva. Entro 24 ore dall’intervento, i cambiamenti di colore dello stoma sono solitamente visibili. Il colore dello stoma progredisce da rosso scuro a nero (Fig. 16-3). Per determinare il grado o il livello di necrosi dello stoma, un tubo di vetro chiaro e lubrificato può essere inserito nello stoma. Usando una luce di penna diretta nel tubo di vetro, si può rilevare un cambiamento nel colore dello stoma, indicando così il livello di ischemia.
Pearola clinica
È consigliabile utilizzare una sacca trasparente nell’immediato periodo post-operatorio per consentire la valutazione del colore dello stoma.
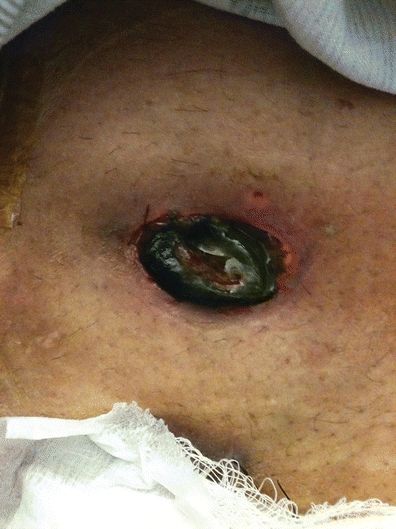
FIGURA 16-3. Necrosi stomale.
Un nuovo metodo innovativo per valutare la perfusione dei tessuti è l’angiografia laser intraoperatoria con verde indocianina. Questa tecnologia di imaging vascolare fornisce una valutazione in tempo reale della perfusione dei tessuti che è correlata ai risultati clinici e può essere utilizzata per guidare il processo decisionale chirurgico (Gurtner et al., 2013). Questo metodo è utilizzato principalmente in ambito intraoperatorio per valutare la perfusione dello stoma e dell’intestino al momento della resezione.
Gestione
La necrosi stomale è spesso una situazione di osservazione e attesa. Se l’ischemia e la necrosi sono al di sopra del livello fasciale, l’osservazione può essere adeguata. Spesso, se l’ischemia e la necrosi sono superficiali, lo strato superiore dello stoma può essere rimosso, lasciando uno stoma rosso e vitale. Se l’ischemia e la necrosi dello stoma sono sotto il livello della pelle ma ancora sopra il livello fasciale, il tessuto stomale necrotico diventerà maleodorante e flaccido. Lo sbrigliamento è spesso indicato. Dopo che il tessuto necrotico viene rimosso o si sfalda, di solito c’è una separazione mucocutanea. Mentre la separazione mucocutanea guarisce, può verificarsi una stenosi. Inoltre, il livello dello stoma sopra la pelle è diminuito, e questo spesso porta a problemi di sacca. Se l’ischemia e la necrosi si estendono più in profondità del livello fasciale, può essere indicato un intervento chirurgico urgente.
Ritrazione dello stoma
Eziologia/Incidenza
La ritrazione è la scomparsa della sporgenza del tessuto dello stoma in linea o sotto il livello della pelle (Colwell & Beitz, 2007). La retrazione è di solito causata dalla tensione sullo stoma da una varietà di ragioni: mesentere corto, parete addominale ispessita, aderenze eccessive o formazione di cicatrici, aumento del BMI, lunghezza iniziale dello stoma inadeguata, o escissione cutanea impropria, necrosi stomale e separazione mucocutanea (Colwell, 2004). L’evidenza aneddotica suggerisce che la retrazione si verifica frequentemente nei pazienti in sovrappeso con strati adiposi più grandi. Un mesentere accorciato e grasso rende difficile un’adeguata mobilizzazione dell’intestino, producendo così tensione sullo stoma (Cottam, 2005).
Ratliff e Donovan (2001) hanno trovato che 9 (4%) di 220 pazienti con stomia avevano stomi arrossati o retratti. In uno studio prospettico su 3.970 stomie, Cottam et al. (2007) hanno riferito che il 40,1% presentava retrazione. Nello studio prospettico di Pittman su 71 partecipanti con una stomia, 24 (39%) avevano retrazione (Pittman et al., 2014). In uno studio retrospettivo di 3 anni su 164 pazienti che avevano subito un intervento chirurgico con conseguente stomia, la retrazione si è verificata nel 5% di questi pazienti (Duchesne et al., 2002). Un altro studio su 97 pazienti con una stomia ha trovato il BMI associato alla retrazione (p = 0,003) (Arumugam et al., 2003). L’incidenza della retrazione sembra essere in aumento. Cottam et al. (2007) hanno riportato che l’incidenza della retrazione stomale (stoma sotto il livello della pelle) è più che raddoppiata tra il 1996 e il 2004 (22% vs. 51%) (Colwell e Beitz, 2007). In una revisione sistematica della letteratura, la retrazione dello stoma si è verificata nel 9%-15% dei condotti ileali e nell’1%-11% di tutti gli stomi (Szymanski et al., 2010). Nello studio di Pittman, i pazienti che non avevano il sito dello stoma marcato preoperatoriamente da un’infermiera WOC hanno sperimentato una maggiore gravità delle complicazioni della stomia, in particolare la retrazione dello stoma (r = 0,32, p = 0,01) (Pittman et al., 2014).
Presentazione
Uno stoma sano dovrebbe essere sopra il livello della pelle circostante. In passato, c’è stato un malinteso secondo cui le colostomie dovrebbero essere a filo della pelle. Questo non è stato confermato in letteratura o nella pratica. Nello studio di Cottam su 1.329 stomi problematici, se l’altezza dello stoma era < 10 mm, la probabilità di avere uno stoma problematico era almeno del 35% (p < 0,0001) (Cottam et al, 2007).
Valutazione
Lo stoma deve essere osservato senza il sistema di marsupio in posizione e in una varietà di posizioni: seduta, supina e in piedi. Il livello dello stoma e la pelle circostante devono essere attentamente annotati. Lo stoma può scomparire in una piega della pelle quando si sta seduti o può diventare a filo o anche retratto con i cambiamenti di posizione e con la peristalsi.
Gestione
L’obiettivo del successo della sacca dello stoma è di avere o creare una superficie di sacca piatta. Quando è presente una retrazione, l’obiettivo è di aumentare il livello dello stoma sopra la pelle. Questo può talvolta essere ottenuto utilizzando un sistema di sacchettatura convesso e/o una cintura. Se non si raggiunge un tempo di usura prevedibile e le complicazioni continuano, può essere necessario un intervento chirurgico per rivedere lo stoma. La revisione locale può essere possibile se c’è un intestino adeguato da mobilizzare sopra il livello della pelle; in caso contrario, può essere necessario un intervento più invasivo per creare un nuovo stoma.
Complicanze tardive
Le complicazioni stomali tardive sono quelle che si verificano almeno 30 giorni dopo l’intervento e spesso includono stenosi stomale, prolasso ed ernia parastomale (Duchesne et al, 2002; Kim & Kumar, 2006; Park et al., 1999; Shabbir & Britton, 2010; Steel & Wu, 2002). Con il progresso delle tecniche chirurgiche e della chirurgia laparoscopica, si stanno esplorando varie tecniche chirurgiche per ridurre al minimo il rischio di sviluppare complicazioni a lungo termine (Gurtner et al., 2013; Heiying et al, 2014).
Stenosi stomale
Eziologia/Incidenza
La stenosi stomale è la compromissione del drenaggio degli effluenti dovuta al restringimento o alla contrazione del tessuto stomale a livello cutaneo o fasciale (Colwell & Beitz, 2007). In passato, la stenosi si verificava tipicamente all’inizio del periodo postoperatorio a causa di una tecnica chirurgica inadeguata (a livello fasciale o cutaneo) o se non maturata correttamente (Hampton, 1992). Grazie al miglioramento della tecnica chirurgica, la stenosi stomale si vede raramente all’inizio ma piuttosto in ritardo nel processo di recupero, >30 giorni dopo l’intervento, di solito come risultato della separazione mucocutanea, della necrosi dello stoma o della retrazione dello stoma. Con la guarigione, la formazione di tessuto di granulazione intorno allo stoma costringe il lume. Altre cause di stenosi stomale includono la malattia cronica (Crohn o tumore), l’eccessiva formazione di cicatrici dovuta alla strumentazione (dilatazione), o l’infiammazione cronica (dermatite irritante peristomale o iperplasia) (Colwell, 2004; Hampton, 1992).
L’incidenza della stenosi stomale è stata riportata tra il 2% e il 23%. Su 316 pazienti studiati, il 10,2% è risultato avere una stenosi (Cheung, 1995). In uno studio retrospettivo di 150 ileostomie terminali permanenti, Leong e soci (1994) hanno trovato il 23% con stenosi. Pittman et al. (2014) hanno identificato il 5% nel suo studio di 71 pazienti con stomia, e Porter et al. (1989) hanno riportato un tasso di stenosi dell’11%. In uno studio retrospettivo di 1.616 cartelle cliniche dal 1976 al 1995 di pazienti che avevano ricevuto un intervento di stomia, Park et al. (1999) hanno riferito che il 34% ha sviluppato complicanze della stomia con il 72% che si è verificato tardivamente (più di 30 giorni dopo l’intervento). Le complicazioni tardive più comuni erano dermatite irritante peristomale (6%), prolasso (2%) e stenosi (2%) (Park et al., 1999). Infine, in uno studio retrospettivo di 3 anni su 164 pazienti che avevano subito un intervento chirurgico con conseguente stomia, il 17% è stato riportato con stenosi (Duchesne et al., 2002).
Presentazione
L’aspetto di un’apertura stenotica appare piccolo (Fig. 16-4). Spesso il paziente con uno stoma fecale può riferire dolore con l’evacuazione dello stoma, piccole feci nastriformi, o al contrario, stitichezza seguita da grandi evacuazioni esplosive, forte con eccesso di gas. I pazienti con urostomia possono riferire frequenti infezioni del tratto urinario, flusso di urina proiettato e/o dolore al fianco (Colwell, 2004).
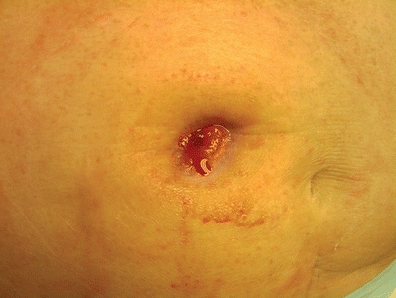
FIGURA 16-4. Stenosi stomale.
Valutazione
La valutazione di uno stoma stenotico è meglio eseguita con un dito guantato e lubrificato per valutare la dimensione e la mobilità della pelle e degli anelli fasciali. Se un dito non può essere inserito nell’apertura stomale a causa di una grave stenosi, può essere eseguito uno studio retrogrado con contrasto attraverso un piccolo catetere di gomma (Colwell, 2004).
PAROLA CLINICA
Quando si valuta lo stoma con un esame digitale spiegare al paziente che lo stoma non contiene nervi che possano causare dolore, ma se dovesse sentire una pressione di farvelo sapere in modo da poter fermare l’esame.
Gestione
La gestione di una lieve stenosi di una stomia fecale può includere una dieta a basso contenuto di residui, ammorbidenti per feci, o un’elevata assunzione di liquidi. La dilatazione dello stoma mediante l’introduzione graduale e incrementale di un dilatatore nello stoma è stata una pratica comune in passato, ma ci sono poche prove in letteratura a sostegno di questa pratica. Tuttavia, è stato riportato che la dilatazione cronica può potenzialmente causare una stenosi dello stoma (Hampton, 1992). La dilatazione stomale può essere usata per aiutare temporaneamente l’evacuazione ma non è raccomandata come pratica a lungo termine. Per i casi più gravi, la chirurgia è giustificata. Questo può comportare la liberazione dello stoma dalla pelle peristomale localmente o eseguendo una laparotomia/laparoscopio e risistemando lo stoma.
Prolasso stomiale
Eziologia/Incidenza
Il prolasso stomiale è il telescopio dell’intestino attraverso lo stoma (Colwell & Beitz, 2007). Il prolasso dello stoma può verificarsi per una serie di motivi: aumento della pressione addominale, obesità, l’apertura dello stoma nella parete addominale è troppo grande, o lo stoma è stato creato al di fuori del muscolo retto (Weideman et al., 2012).
Tutti gli stomi sono soggetti a prolasso, e i rapporti di incidenza variano. Il prolasso dello stoma si osserva spesso nelle colostomie ad anello, e l’arto distale è prevalentemente coinvolto (Shellito, 1998; Gordon et al., 1998). Cheung (1995) ha riportato che il 6,8% ha sviluppato un prolasso in 156 colostomie endosigmoidi. In uno studio su 130 soggetti con una colostomia terminale in un periodo di 6 anni, il 4% ha avuto un prolasso dello stoma (Porter et al., 1989). Il prolasso dello stoma si osserva spesso nei bambini (Franchini et al., 1983; Steinau et al., 2001). In uno studio su 144 neonati con malformazioni anorettali, l’incidenza del prolasso stomale era maggiore in quelli con colostomie ad anello rispetto a quelle divise, 17,8% e 2,8%, rispettivamente (p = 0,005) (Oda et al., 2014). Chen et al. (2013) hanno eseguito una meta-analisi comprendente cinque studi randomizzati controllati e sette studi non randomizzati con 1.687 pazienti in totale, confrontando gli esiti nelle ileostomie temporanee rispetto alle colostomie temporanee. Hanno trovato una minore incidenza di prolasso dello stoma nei pazienti con ileostomia temporanea rispetto ai pazienti con colostomia temporanea in entrambi gli studi randomizzati e non randomizzati (RR 0,15, 95% CI: 0,04 a 0,48, p = 0,001 e RR 0,26, 95% CI: 0,10 a 0,67, p = 0,005, rispettivamente) (Chen et al., 2013). In una revisione sistematica della letteratura relativa alle complicazioni dello stoma in seguito a cistectomia radicale e diversioni condotte ileali, il prolasso stomale è stato identificato nell’1,5% – 8% a una media di 2 anni dopo l’intervento (Szymanski et al., 2010). È stato riportato che fino al 50% dei pazienti con colostomia prolassata avevano anche un’ernia parastomale (Kim & Kumar, 2006).
Presentazione
Uno stoma prolassato può presentarsi in una varietà di gradi di gravità e lunghezza della protrusione stomale (Fig. 16-5). La lunghezza dello stoma prolassato guiderà la gestione. Maggiore è la lunghezza del prolasso, maggiore è la probabilità di edema stomatico, trauma e ischemia. Quando lo stoma diventa edematoso e dipendente, assume un colore rosso intenso (vasodilatazione). Con un prolasso molto prominente (da 5 a 13 pollici), lo stoma è suscettibile di traumi. La cura deve includere l’evitare l’attrito, la lacerazione o la pressione sullo stoma. In situazioni estreme, l’apporto di sangue allo stoma può essere compromesso e può verificarsi un’ischemia stomale.
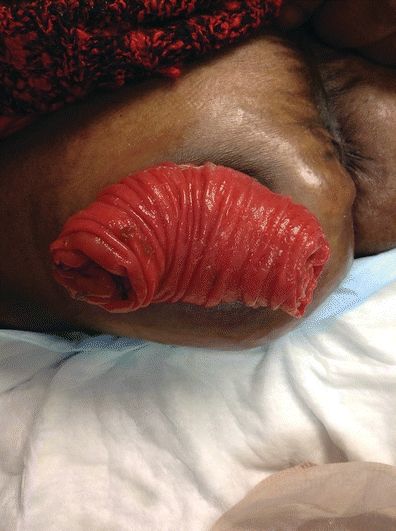
FIGURA 16-5. Prolasso stomale.