Case Report
Management of Proliferative Endometrium on Biopsy in Post-Menopausal Women
Sidharth Srinivas1, Sachchidananda Maiti2, Perunkulam Jothilakshmi2
1Manchester Medical School, University of Manchester, Manchester, Regno Unito
2Obstetrics & Gynaecology, The Pennine Acute NHS Hospitals, Crumpsall, Regno Unito
Indirizzo e-mail:
 (S. Srinivas)
(S. Srinivas) Per citare questo articolo:
Sidharth Srinivas, Sachchidananda Maiti, Perunkulam Jothilakshmi. Gestione dell’endometrio proliferativo su biopsia in donne in post-menopausa. Giornale di ginecologia e ostetricia. Vol. 4, No. 6, 2016, pp. 38-43. doi: 10.11648/j.jgo.20160406.12
Ricevuto: 4 settembre 2016; Accettato: 21 settembre 2016; Pubblicato: October 15, 2016
Abstract: Il sanguinamento post-menopausale (PMB) è solitamente causato da diverse condizioni endometriali (iperplasia e carcinoma) per le quali esistono trattamenti basati sull’evidenza. Tuttavia, c’è poca letteratura e nessun trattamento basato sull’evidenza per il riscontro di un endometrio proliferativo senza atipia sulla biopsia endometriale Pipelle nelle donne che presentano la PMB. Il nostro obiettivo è quello di esplorare la gestione e le opzioni di trattamento per questo sottogruppo di donne. Questa è una revisione retrospettiva e osservazionale di una serie di casi di donne che si presentano con PMB in una clinica di ginecologia ad accesso rapido presso un District General Hospital di Manchester, Regno Unito, per un periodo di tre settimane. Sono state scelte quattro donne che presentavano un endometrio proliferativo o secretorio alla biopsia della pipella endometriale. La loro storia, i risultati degli esami, le indagini, il trattamento e i risultati del follow-up sono stati analizzati. Questa serie di casi ha identificato il dilemma di gestione posto dalle pazienti con endometrio proliferativo senza atipia al prelievo endometriale. Le quattro pazienti sono state seguite con una biopsia endometriale Pipelle ripetuta sei settimane dopo la presentazione all’unità specialistica di ginecologia. Sono state successivamente consigliate o trattate con una terapia a base di progesterone orale per sei-otto settimane. Le opzioni di gestione comprendevano il sistema intrauterino Mirena (IUS), la terapia con progesterone orale e la dimissione della paziente alle cure primarie. Non c’è consenso sull’importanza del progesterone orale o sulla durata del follow-up necessario per monitorare lo sviluppo dell’iperplasia endometriale o del cancro in questo sottogruppo di pazienti. Sono necessarie ulteriori ricerche per sviluppare linee guida di gestione basate sull’evidenza per l’endometrio proliferativo nelle donne con PMB.
Parole chiave: Sanguinamento post menopausale, Endometrio proliferativo senza atipia, terapia con progesterone
1. Introduzione
Il sanguinamento post-menopausale è una presentazione importante e comune nella clinica ginecologica. Le indagini urgenti sono necessarie per escludere il cancro endometriale – la neoplasia ginecologica più comune nel Regno Unito. Le cause benigne come la vaginite atrofica, i polipi e i fibromi hanno anche il potenziale di causare uno stress significativo alla paziente. Una diagnosi istologica di iperplasia endometriale aumenta il rischio di malignità e il trattamento è necessario per indurre la regressione. Al contrario, una diagnosi istologica di endometrio proliferativo senza cellule atipiche lascia i medici senza un trattamento basato sull’evidenza e l’incertezza sul suo potenziale di trasformazione maligna.
In questa relazione abbiamo analizzato quattro casi di PMB le cui indagini hanno trovato endometrio proliferativo all’istologia. Questa serie di casi è interessante perché c’è una scarsità di prove in letteratura sull’endometrio proliferativo in donne in post-menopausa che presentano un sintomo di PMB, e di conseguenza nessun trattamento basato sull’evidenza. Questa relazione identificherà le aree di incertezza nella nostra comprensione e gestione di queste pazienti.
Metodi
Questa è una serie di casi retrospettiva e osservazionale che riguarda le donne che si presentano con PMB in una clinica di accesso rapido in ginecologia (RAC) in un ospedale generale distrettuale di Manchester per un periodo di 3 settimane nel novembre 2014. Sono state scelte a caso quattro pazienti con endometrio proliferativo o secretorio su un campionamento endometriale con un dispositivo Pipelle. Le donne in postmenopausa in questa serie di casi sono state tutte indirizzate urgentemente alle cure secondarie dopo aver avuto almeno un episodio di sanguinamento. In questa serie di casi, sono state incluse donne di tutte le età che hanno subito la menopausa naturale. Le note sul caso sono state utilizzate per analizzare la storia di ogni paziente, i risultati degli esami, le indagini, il trattamento e il follow-up.
2. Serie di casi
Tabella 1. Aspetti rilevanti dell’anamnesi del paziente.
| Paziente | Età & Stato menopausale | Motivo del rinvio | Sintomi associati | Anamnesi medica passata | Contraccezione, TOS & stato tamoxifene | Anamnesi dello striscio cervicale |
| 1 | 54, post-menopausa da 2 anni | Due episodi di sanguinamento pesante per cinque giorni ciascuno | Disagio addominale disagio | Niente | Nulla | Normale & fino-fino ad oggi |
| 2 | 59, in post-menopausa da 5 anni | Dieci giorni di forti perdite vaginali con coaguli | Disagio addominale e perdita di peso | Diabete mellito di tipo 2, ipertensione e calcoli biliari | Il medico ha iniziato il Norethisterone per il sanguinamento | Normale & fino-fino ad oggi |
| 3 | 52, post-menopausa 1 anno | Endometrio irregolarmente spesso all’ecografia in assistenza primaria | Sanguinamento intermittente con coaguli e allagamenti | Cancro al seno, mastectomia bilaterale e rimozione dei linfonodi ascellari | Mirena IUS e Tamoxifen un anno fa | Normale & fino-ad oggi |
| 4 | 59, post-menopausa | Otto giorni di leggero sanguinamento vaginale continuo | Lieve dolore addominale | Ipertensione, ipertiroidismo, indice di massa corporea aumentato | Nullo | Sconosciuto |
Tabella 2. Risultati dell’indagine e trattamento.
| Paziente | Esame pelvico & TVUS | Isteroscopia | Biopsia della pipella | Ripetizione biopsia della pipella | Trattamento | Durata del follow-up |
| 1 | Normale & 1.3mm | Non eseguito | Endometrio proliferativo senza atipia o malignità | Endometrio secretorio senza atipia o malignità | MDPA 100mg BD per 6-8 settimane | 6 settimane |
| 2 | Normale & 10mm | Normale a parte 2.5mm polipo polipo | Endometrio secretorio senza atipie o malignità | Proliferativo endometrio senza atipia o malignità | Consulenza suirena IUS | 6 settimane |
| 3 | Normale & 2mm | Non eseguito | Endometrio proliferativo senza atipia o malignità | Endometrio proliferativo senza atipia o malignità | Nil | 8 settimane |
| 4 | Normale & 10mm | Normale a parte un piccolo polipo | Proliferativo endometrio senza atipia o malignità | Endometrio proliferativo senza atipia o malignità | MDPA 100mg BD per 6-8 settimane | 8 settimane |
3. Discussione
3.1. Cambiamenti endometriali durante la menopausa
Un endometrio che si atrofizza e perde il suo strato funzionale, con lo stroma endometriale che diventa fibroso e le ghiandole che non mostrano né attività proliferativa né secretoria – è il quadro accettato dell’endometrio in post-menopausa. Questa regressione endometriale coincide con la cessazione delle mestruazioni, quindi quando si verifica un sanguinamento si deve escludere una patologia. La fisiologia dell’endometrio in post-menopausa e il suo ruolo nella patologia pelvica hanno suscitato interesse negli ultimi decenni, con particolare attenzione ai precursori del carcinoma endometriale. Tuttavia, c’è molta meno letteratura sull’endometrio in post-menopausa rispetto all’endometrio durante la vita riproduttiva.
In generale gli studi hanno dimostrato che tre quarti delle donne in post-menopausa sembrano avere un endometrio atrofizzato con vari gradi di ghiandole cistiche dilatate. Un altro 15% ha polipi endometriali composti da ghiandole cistiche. L’endometrio che mostra proliferazione e iperplasia rappresenta il restante 10%. L’atrofia endometriale si osserva durante il primo anno della menopausa e la sua incidenza rimane costante attraverso la menopausa. In contrasto con i casi di proliferazione e iperplasia che si vedono principalmente nei primi 5 anni dopo la menopausa.
Nel 1954 McBride ha analizzato l’endometrio post-menopausa in un grande studio; prendendo campioni con curettage da 1.521 pazienti in vari periodi dopo la menopausa. In 1.315 campioni si ottenne poco materiale se non mucoso, mentre i restanti 206 casi mostrarono i seguenti modelli endometriali: atrofia, ghiandola cistica singola o diffusa, iperplasia, proliferazione, polipi secretori e fibro-adenomatosi. I risultati suggeriscono che l’incidenza dell’endometrio proliferativo o secretorio è del 6,3%. Tuttavia, l’autore propone che laddove non è stato ottenuto alcun campione, l’endometrio era inattivo o atrofizzato. Sotto questa ipotesi, l’incidenza dell’endometrio proliferativo o secretorio è dello 0,8%. Questo ci porta a credere che la vera incidenza di un endometrio proliferativo o secretorio sia compresa tra il 6,3% e lo 0,9%.
Uno studio che ha esaminato le biopsie endometriali di donne in peri- e post-menopausa in TOS continua ha scoperto che la maggior parte degli endometri sono atrofici (68,7%) o proliferativi (23,5%). Mentre lo 0,6% ha mostrato una semplice iperplasia senza atipia, lo 0,5% aveva un endometrio secretorio e l’adenocarcinoma ben differenziato è stato trovato nello 0,07% dei casi. Questo suggerisce che le donne in post-menopausa che ricevono la stimolazione ormonale hanno una maggiore incidenza di endometrio proliferativo.
3.2. Cause del sanguinamento post-menopausale
Il sanguinamento post-menopausale si riferisce a qualsiasi sanguinamento vaginale in una donna in post-menopausa che non è il previsto sanguinamento ciclico che si verifica con la terapia ormonale sostitutiva sequenziale. PMB garantisce un riferimento urgente ginecologia come il 10% di queste pazienti hanno il cancro endometriale. Una diagnosi precoce del cancro endometriale è importante per ridurre la diffusione locale e maligna ed è associata ad una sopravvivenza fino al 90%. Il cancro endometriale spesso si presenta precocemente con la PMB, tuttavia la vaginite atrofica e le lesioni benigne come polipi e fibromi sono comuni. Uno studio ha scoperto che fino al 30% dei casi di PMB rivela un’anomalia anatomica sottostante (vedi tabella 3).
Tabella 3. Le cause anatomiche del sanguinamento post-menopausale.
| Endometrio | Cervix | Vagina | Ovario |
| Fibroidi | Polipi | Vaginite trofica | Cancro |
| Iperplasia | Cancro | Cancro | |
| Polipi | |||
| Cancro | |||
| Endometrite |
3.3. In accordo con le linee guida del National Institute of Clinical Excellence (NICE), tre delle pazienti della nostra serie di casi che presentavano la PMB, e non sottoposte a HRT, sono state tutte indirizzate alle cure secondarie per escludere il cancro. Queste pazienti sono state tutte viste entro 2 settimane in un ambulatorio di ginecologia – raggiungendo l’obiettivo nazionale per i rinvii urgenti.
Le pazienti in trattamento con TOS sono più complesse in quanto può essere difficile distinguere tra il normale sanguinamento ciclico e quello irregolare. Il sanguinamento uterino o lo spotting all’inizio della TOS è comune, ma dovrebbe cessare dopo 6 mesi. Tuttavia, il NICE raccomanda un riferimento urgente per il sanguinamento postmenopausale persistente o inspiegabile dopo la cessazione della TOS per 6 settimane.
Lo Scottish Intercollegiate Guidelines Network (SIGN) offre un algoritmo per l’indagine della PMB (vedi tabella 4). In linea con queste linee guida, tutte e quattro le pazienti hanno ricevuto un esame pelvico per cercare eventuali cause benigne di sanguinamento come ectropion cervicale, polipi o per sollevare il sospetto di malignità. Un’anamnesi accurata con identificazione dei fattori di rischio del cancro endometriale come una storia di anovulazione cronica, obesità, diabete, uso di estrogeni o tamoxifene e sindromi genetiche è importante. Inoltre, l’esame dello speculum permette ai medici esperti di diagnosticare lesioni vulvali, vaginali e cervicali. Un’anamnesi e un esame approfonditi possono anche sollevare il sospetto di cause rare di sanguinamento vaginale, come i disturbi della coagulazione e la leucemia.
Come raccomandato dal SIGN, la TVUS è stata l’indagine di prima linea utilizzata per le donne che si presentano con PMB nella nostra serie di casi. La sua base di prove, la convenienza, la mancanza di complicazioni la rende un’indagine ideale per valutare le pazienti a più alto rischio di cancro. Con un endometrio più spesso, il rischio di patologie come la malignità aumenta, garantendo ulteriori indagini. Mentre le donne con endometrio sottile possono essere rassicurate e richiamate per ulteriori indagini solo se il sanguinamento persiste. L’impostazione del valore di cut-off dello spessore dell’endometrio bilancia la necessità di identificare tutte le patologie sinistre minimizzando l’uso eccessivo di risorse. Fissare il cut-off a 3 mm garantisce un’alta sensibilità (100%) ma compromette la specificità (25,8%) dell’indagine, con il risultato di un numero eccessivo di pazienti da esaminare. Attualmente, 4 mm sono utilizzati nella pratica clinica in quanto si ritiene che offrano la sensibilità (91,6%) e la specificità (44,5%) ottimali.
Sono disponibili altre forme di ecografia come il doppler transvaginale, tridimensionale, salina potenziata e la misurazione della trama endometriale e l’analisi dei margini. Tuttavia, gli studi non sono riusciti a dimostrare i loro vantaggi rispetto alla TVUS e non sono raccomandati né utilizzati nella pratica clinica di routine al momento
L’ispezione diretta e il campionamento del tessuto endometriale è considerato il gold standard e la seconda linea di indagine in questa coorte di pazienti. La pratica attuale e le linee guida SIGN raccomandano l’uso di dispositivi di biopsia endometriale per indagare ulteriormente le pazienti ritenute ad alto rischio di cancro endometriale. Convenzionalmente la dilatazione & curettage è stata utilizzata per indagare il sanguinamento anormale, ma le prove ora supportano l’uso di dispositivi di campionamento endometriale come il dispositivo Pipelle – utilizzato in tutti e quattro i pazienti nella mia serie di casi. Ha un tasso di rilevamento del 99,6% per il cancro endometriale nelle donne in post-menopausa, così come un’alta sensibilità (81%) e specificità (98%) per identificare l’iperplasia atipica. In sintesi, una combinazione di TVUS e biopsia endometriale Pipelle offre informazioni diagnostiche sufficienti per diagnosticare o escludere la malattia endometriale benigna e maligna.
Le pazienti in trattamento con tamoxifene hanno un’incidenza da tre a sei volte superiore di cancro endometriale, e un rinvio urgente per tali donne che lamentano PMB è raccomandato dal NICE. Il rischio di cancro e di proliferazione, dovuto al debole effetto estrogenico del tamoxifene, ha dimostrato di aumentare con l’aumentare della dose e della durata del trattamento. La paziente 3 della nostra serie di casi, una donna di 59 anni in trattamento con tamoxifene, è stata indagata più estesamente per mezzo di un’isteroscopia oltre a una TVUS e una biopsia Pipelle. Questo è in linea con le linee guida che suggeriscono di preferire l’isteroscopia con biopsia alla TVUS, poiché l’interpretazione dell’ecografia è resa difficile dall’ispessimento dell’endometrio nelle pazienti che assumono tamoxifene.
Tabella 4. Donne che si presentano con sanguinamento post-menopausale (e non sotto tamoxifene).
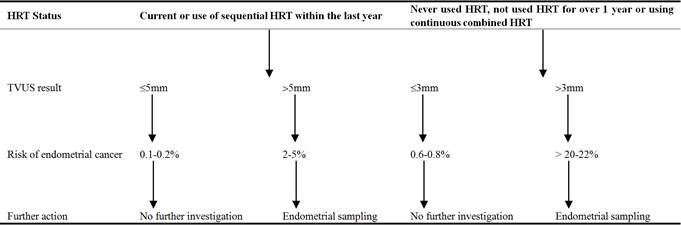
3.4. Iperplasia endometriale
Una diagnosi di iperplasia endometriale (EH) viene fatta in circa il 10% delle donne che presentano una PMB. L’Organizzazione Mondiale della Sanità (OMS) classifica l’iperplasia endometriale in tipi semplici e complessi; ogni tipo è poi ulteriormente classificato in base alla presenza o assenza di atipia nucleare. Le donne che presentano atipia (vedi figura 2) sulla biopsia endometriale richiedono ulteriori indagini perché circa il 50% ha un carcinoma endometriale concomitante. Inoltre, il rischio di progredire verso il cancro è aumentato in presenza di atipia (27,5% a 9 anni dalla diagnosi), ma molto più basso per l’iperplasia senza atipia (4,6% a 9 anni dalla diagnosi). Data la probabilità di una futura malignità, l’isterectomia con salpingo-ovariectomia bilaterale è raccomandata nelle donne in post-menopausa con EH in presenza di atipia. In assenza di cellule atipiche, le donne possono essere gestite con progestinici e biopsie seriali ogni 6 mesi per assicurare la risposta al trattamento. I progestinici comunemente usati includono il megestrolo acetato e il medrossiprogesterone acetato. Anche se le quattro pazienti della nostra serie di casi non hanno iperplasia endometriale, si può postulare che se fossero state trovate cellule atipiche, il rischio di malignità e la necessità di ulteriori indagini sarebbe aumentato nelle pazienti con endometrio proliferativo o secretorio.
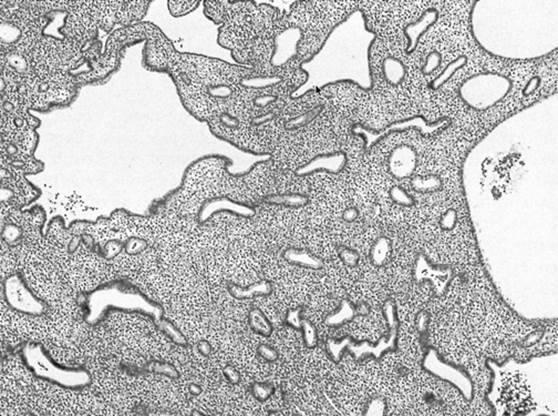
Figura 1. Una biopsia endometriale che mostra un’iperplasia endometriale semplice, con ghiandole endometriali distribuite irregolarmente e ampiamente separate dallo stroma iperplastico.
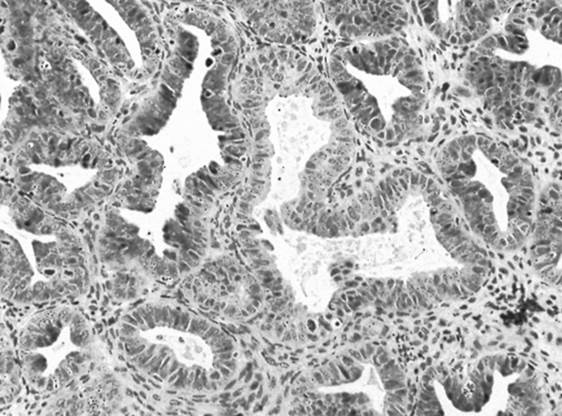
Figura 2. Una biopsia endometriale che mostra iperplasia endometriale con cellule ghiandolari atipiche
3.5. Patogenesi dell’endometrio proliferativo
Il mio rapporto ha identificato donne in post-menopausa le cui biopsie imitavano l’endometrio trovato nel ciclo mestruale mensile di una donna in riproduzione. L’aumento dell’attività mitotica dell’epitelio stromale accompagnato dall’iperplasia cellulare e dall’aumento della matrice extracellulare porta all’ispessimento dell’endometrio durante la fase proliferativa dell’endometrio (vedi figura 3). Questa proliferazione è stimolata dagli estrogeni secreti dai follicoli in sviluppo durante il ciclo mestruale. Il progesterone si oppone all’azione degli estrogeni e i suoi effetti arrestano la fase proliferativa del ciclo endometriale. Il progesterone induce la fase secretoria stimolando le ghiandole endometriali e aumentando la vascolarizzazione (vedi figura 4). Lo spessore dell’endometrio aumenta ulteriormente quando le ghiandole, le cellule stromali e i vasi sanguigni si ingrossano. Nelle donne in post-menopausa si pensa che bassi livelli di estrogeni e progesterone da fonti extra-follicolari stimolino l’endometrio a proliferare. Inoltre, i fitoestrogeni come i semi oleosi, i prodotti di soia e il tofu sono sostanze vegetali che sono strutturalmente e funzionalmente simili all’estradiolo. Nonostante gli studi suggeriscano che i fitoestrogeni non inducono la proliferazione né aumentano il rischio di cancro endometriale, i loro effetti a lungo termine sono relativamente sconosciuti. Allo stesso modo, c’è incertezza sull’uso da banco del cohosh nero – un rimedio erboristico con potenziali effetti proliferativi sull’endometrio.
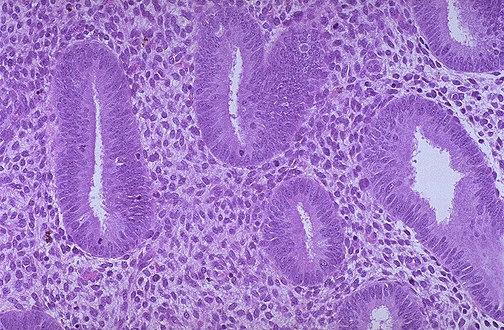
Figura 3. L’aspetto microscopico dell’endometrio proliferativo, con proliferazione di ghiandole tubolari e stroma denso.
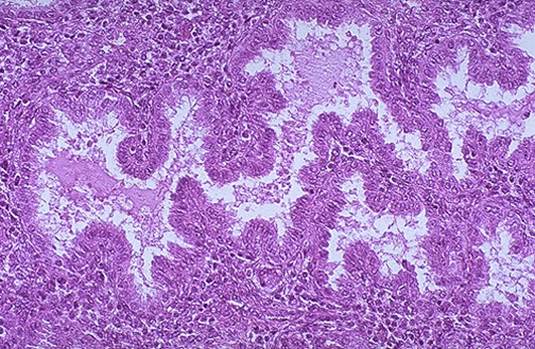
Figura 4. L’aspetto microscopico dell’endometrio secretorio e delle grandi ghiandole tortuose piene di secrezioni .
Gli studi hanno dimostrato che l’endometrio proliferativo non è raro e suggeriscono anche che i tumori dell’endometrio hanno origine da un background di attività proliferativa non inerziale. La probabilità che il semplice endometrio proliferativo si trasformi in malignità è comunque molto bassa e significativamente inferiore al rischio dello 0,3-1% dell’iperplasia endometriale che progredisce in cancro. Tuttavia, i fattori di rischio includono l’aumento dell’indice di massa corporea e l’età. Entrambi sono associati all’aromatizzazione periferica e alle comorbilità comuni tra le pazienti con cancro endometriale.
3.6. Gestione dell’endometrio proliferativo
Non esistono studi pubblicati a nostra conoscenza sulla gestione della proliferazione endometriale senza atipia nel sanguinamento post-menopausale. Di conseguenza, al momento non esiste un trattamento basato sull’evidenza per queste donne. Non c’è nemmeno un consenso sulla dose e sulla durata raccomandata del trattamento con MDPA in questo sottogruppo di pazienti. Inoltre, non c’è accordo sulla frequenza del follow-up necessario per escludere patologie endometriali proliferative più sinistre.
Ci sono alcune scuole di pensiero tra i ginecologi su come gestire al meglio queste pazienti. Dato che il rischio che l’endometrio proliferativo si trasformi in cancro si presume sia molto basso, un’opzione è quella di rassicurare la paziente prima di dimetterla alle cure primarie. D’altra parte, un approccio più conservativo prevede l’uso di una terapia sistemica con progesterone per indurre la regressione dell’endometrio. Il medrossiprogesterone acetato orale può essere prescritto per un periodo relativamente breve (da sei a otto settimane nella nostra serie di casi) per indurre la regressione endometriale. I benefici della terapia con progesterone devono essere bilanciati attentamente contro i suoi effetti collaterali come il rischio di trombosi venosa profonda. Un’opzione più a lungo termine considerata da alcuni ginecologi è il sistema intrauterino Mirena, una forma reversibile di contraccezione a lunga durata d’azione che assottiglia l’endometrio rilasciando progesterone nell’utero. Entrambe queste forme di progesterone sono utilizzate anche nell’iperplasia endometriale e hanno dimostrato di proteggere l’endometrio dalla proliferazione e dalla trasformazione maligna. Mirena IUS è autorizzato a fornire protezione endometriale per 4 anni. La seconda paziente della nostra serie di casi è stata avviata alla terapia con progesterone dopo che una biopsia Pipelle ha rilevato un endometrio proliferativo, mentre la quarta paziente è stata avviata allo stesso trattamento dopo la conferma dell’istologia con una biopsia Pipelle ripetuta. A causa della mancanza di prove, non è certo se sia necessaria una biopsia ripetuta per confermare i risultati o se una singola biopsia sia sufficiente per il trattamento. Abbiamo anche scoperto che i pazienti nella nostra serie di casi sono stati trattati con medrossiprogesterone orale per 6-8 settimane, ma nessuno studio a nostra conoscenza ha esaminato la durata ideale del trattamento. Un approccio più radicale per trattare l’endometrio proliferativo sarebbe un’isterectomia per episodi ripetuti di PMB per eliminare qualsiasi rischio di trasformazione in carcinoma endometriale. Tuttavia, l’anestesia, i rischi operativi e l’impatto psicologico ne fanno l’ultima risorsa. Un follow-up e la ripetizione della biopsia endometriale Pipelle sono stati organizzati tra 6 settimane per tre delle quattro pazienti. Tuttavia, non ci sono prove sulla frequenza del follow-up o sulla valutazione della risposta al trattamento. Inoltre, non è chiaro se fattori di rischio come l’alto BMI e il cancro al seno debbano ridurre la soglia per offrire la ripetizione della biopsia Pipelle.
4. Conclusione
Questo rapporto ha identificato le tendenze attuali nella gestione dell’endometrio proliferativo con medrossiprogesterone orale. Sono state evidenziate diverse aree di incertezza come la durata del trattamento e il follow-up. Sono necessarie ulteriori ricerche sull’endometrio proliferativo nella PMB al fine di sviluppare linee guida di trattamento basate sull’evidenza.
- UK CR. Statistiche sul cancro: Serie di registrazioni. 2011.
- McBride. L’endometrio normale in post-menopausa. J Obstet Gynaecol Br Emp 1954;61 (5):691-7.
- Noer T. The histology of the senile endometrium. Acta Pathologica Microbiologica Scandinavica 1961;51 (3):193.
- Korhonen MO, Symons JP, Hyde BM, Rowan JP, Wilborn WH. Classificazione istologica e risultati patologici per campioni di biopsia endometriale ottenuti da 2964 donne in perimenopausa e postmenopausa sottoposte a screening per gli ormoni continui come terapia sostitutiva (Studio CHART 2). American Journal of Obstetrics and Gynecology 1997;176 (2):377.
- Goldstein RB, Bree RL, Benson CB, Benacerraf BR, Bloss JD, Carlos R, et al. Valutazione della donna con sanguinamento postmenopausale: Dichiarazione della conferenza di consenso sponsorizzata dalla Società dei radiologi in ecografia. J Ultrasound Med 2001;20 (10):1025-36.
- SIGN. Investigation of Post-Menopausal Bleeding. 2002.
- Paley PJ. Screening per i principali tumori maligni che colpiscono le donne: Linee guida attuali. American journal of obstetrics and gynecology 2001;184 (5):1021.
- NICECG27. Linee guida di riferimento per il sospetto di cancro. 2005.
- Nand SL, Webster MA, Baber R, O’Connor V. Modello di sanguinamento e cambiamenti endometriali durante la terapia ormonale sostitutiva combinata continua. Il gruppo di studio Ogen/Provera. Obstet Gynecol 1998;91 (5 Pt 1):678-84.
- Davidson KG, Dubinsky TJ. Valutazione ultrasonografica dell’endometrio nel sanguinamento vaginale postmenopausale. Radiol Clin North Am 2003;41 (4):769-80.
- Gupta JK, Chien PFW, Voit D, Clark TJ, Khan KS. Spessore endometriale ultrasonografico per la diagnosi di patologia endometriale in donne con sanguinamento postmenopausale: una meta-analisi. Acta Obstetricia et Gynecologica Scandinavica 2002;81 (9):799.
- Dijkhuizen FPHLJ, BrÃ-Lmann HAM, Potters AE, Bongers MY, Heintz APM. L’accuratezza dell’ecografia transvaginale nella diagnosi di anomalie endometriali. Obstetrics & Gynecology 1996;87 (3):345-349.
- Ciatto S, Cecchini S, Gervasi G, Landini A, Zappa M, Crocetti E. Sorveglianza per il cancro endometriale con ultrasonografia transvaginale di pazienti con cancro al seno in trattamento con tamoxifene. Br J Cancer 2003;88 (8):1175-9.
- Weber G, Mere E, Bahlmanw E, Riisch B. Valutazione di diversi parametri diagnostici ecografici transvaginali in donne con sanguinamento postmenopausale. Ultrasuoni in ostetricia e ginecologia 1998;12 (4):265.
- Gruboeck K, Jurkovic D, Lawton F, Savvas M, Tailor A, Campbell S. Il valore diagnostico delle misurazioni dello spessore e del volume dell’endometrio tramite ecografia tridimensionale in pazienti con sanguinamento postmenopausale. Ultrasuoni in ostetricia e ginecologia 1996;8 (4):272.
- Dijkhuizen FPHLJ, Mol BWJ, Brölmann HAM, Heintz APM. L’accuratezza del campionamento endometriale nella diagnosi di pazienti con carcinoma endometriale e iperplasia. Cancer 2000;89 (8):1765.
- Van den Bosch T, Vandendael A, Van Schoubroeck D, Wranz PA, Lombard CJ. Combinazione di ultrasonografia vaginale e campionamento endometriale in ufficio nella diagnosi di malattia endometriale in donne in postmenopausa. Obstet Gynecol 1995;85 (3):349-52.
- Curtis RE, Boice JD, Shriner DA, Hankey BF, Fraumeni JF. Secondi tumori dopo la terapia adiuvante con tamoxifene per il cancro al seno. Journal of the National Cancer Institute 1996; 88 (12):832-835.
- Karlsson B, Granberg S, Wikland M, Torvid K, Marsal K, et al. Ecografia transvaginale dell’endometrio in donne con sanguinamento postmenopausale âa Nordic multicenter study. American Journal of Obstetrics and Gynecology 1995;172 (5):1488.
- Lacey JV, Chia VM. Iperplasia endometriale e il rischio di progressione al carcinoma. Maturitas 2009;63 (1):39.
- Lacey JV, Sherman ME, Rush BB, Ronnett BM, Ioffe OB, Duggan MiA, et al. Rischio assoluto di carcinoma endometriale durante 20 anni di follow-up tra le donne con iperplasia endometriale. Journal of Clinical Oncology 2010;28 (5):788-792.
- Silverberg. Tumori del corpo uterino e malattia trofoblastica gestazionale. AFIP Atlas of Tumor Pathology 1995.
- Balk JL, Whiteside DA, Naus G, DeFerrari E, Roberts JM. Uno studio pilota sugli effetti dell’integrazione di fitoestrogeni sull’endometrio in postmenopausa. J Soc Gynecol Investig 2002;9 (4):238-42.
- Patologia FG. http://library.med.utah.edu/WebPath/FEMHTML/FEMIDX.html#2.
- Sivridis E, Giatromanolaki A. Attività proliferativa nell’endometrio in postmenopausa: il potenziale in agguato per dare origine a un adenocarcinoma endometriale. J Clin Pathol 2004;57 (8):840-4.
- Baak JP, Wisse-Brekelmans EC, Fleege JC, van der Putten HW, Bezemer PD. Valutazione del rischio di cancro endometriale nell’iperplasia, per mezzo di caratteristiche morfologiche e morfometriche. Pathol Res Pract 1992;188 (7):856-9.
- Wan YL, Holland C. L’efficacia dei sistemi intrauterini di levonorgestrel per la protezione endometriale: una revisione sistematica. Climacteric;14 (6):622-632.