Obiettivi di apprendimento
- Definire la pressione.
- Imparare le unità di pressione e come convertirle.
La teoria cinetica dei gas indica che le particelle di gas sono sempre in movimento e si scontrano con altre particelle e con le pareti del contenitore che le contiene. Anche se le collisioni con le pareti del contenitore sono elastiche (cioè, non c’è guadagno o perdita netta di energia a causa della collisione), una particella di gas esercita una forza sulla parete durante la collisione. L’accumulo di tutte queste forze distribuite sull’area delle pareti del contenitore causa qualcosa che chiamiamo pressione. La pressione (P) è definita come la forza di tutte le collisioni tra particelle di gas e pareti divisa per l’area della parete:
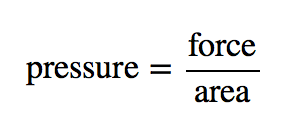
Tutti i gas esercitano pressione; è una delle quantità misurabili fondamentali di questa fase della materia. Anche la nostra atmosfera esercita una pressione – in questo caso, il gas è “trattenuto” dalla gravità della terra, piuttosto che il gas è in un contenitore. La pressione dell’atmosfera è 101,325 Pa.
La pressione ha una varietà di unità. L’unità formale di pressione approvata dal SI è il pascal (Pa), che è definito come 1 N/m2 (un newton di forza su un’area di un metro quadrato). Tuttavia, questo è di solito troppo piccolo in grandezza per essere utile. Un’unità comune di pressione è l’atmosfera (atm), che è stata originariamente definita come la pressione atmosferica media a livello del mare.
Tuttavia, la “pressione atmosferica media a livello del mare” è difficile da individuare a causa delle variazioni di pressione atmosferica. Un’unità più affidabile e comune è il millimetro di mercurio (mmHg), che è la quantità di pressione esercitata da una colonna di mercurio alta esattamente 1 mm. Un’unità equivalente è il torr, che equivale a 1 mmHg (il torr prende il nome da Evangelista Torricelli, uno scienziato italiano del XVII secolo che inventò il barometro a mercurio). Con queste definizioni di pressione, l’unità atmosfera viene ridefinita: 1 atm è definita esattamente come 760 mmHg, o 760 torr. Abbiamo quindi le seguenti equivalenze:
1 atm = 760 mmHg = 760 torr
Possiamo usare queste equivalenze come qualsiasi altra equivalenza per eseguire conversioni da un’unità all’altra. Relativamente all’unità formale SI di pressione, 1 atm = 101,325 Pa.
Esempio 1
Quante atmosfere ci sono in 595 torr?
Soluzione
Utilizzando le equivalenze di pressione, costruiamo un fattore di conversione tra torr e atmosfere: 1 atm = 760 torr. Quindi,

Perché i numeri del fattore di conversione sono esatti, il numero di cifre significative nella risposta finale è determinato dal valore iniziale della pressione.
Test Yourself
Quante atmosfere ci sono in 1.022 torr?
Risposta
1,345 atm
Esempio 2
L’atmosfera su Marte è in gran parte CO2 ad una pressione di 6,01 mmHg. Qual è questa pressione in atmosfere?
Soluzione
Utilizza le equivalenze di pressione per costruire il corretto fattore di conversione tra millimetri di mercurio e atmosfere.
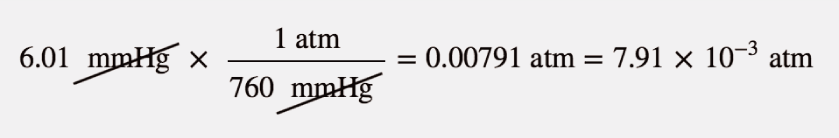
Alla fine, abbiamo espresso la risposta in notazione scientifica.
Test Yourself
La pressione atmosferica è bassa nell’occhio di un uragano. In un uragano del 1979 nell’Oceano Pacifico, è stata riportata una pressione di 0,859 atm all’interno dell’occhio. Qual è questa pressione in torr?
Risposta
652 torr
Punti chiave
- La pressione è una forza esercitata su un’area.
- La pressione ha diverse unità comuni che possono essere convertite.
Esercizi
-
Definire la pressione. Cosa la causa?
-
Definire e mettere in relazione tre unità di pressione.
-
Se una forza di 16. 7 N viene premuta contro un’area di 16.7 N viene premuta contro un’area di 2,44 m2, qual è la pressione in pascal?
-
Se una forza di 2.546 N viene premuta contro un’area di 0..0332 m2, qual è la pressione in pascal?
-
Spiega perché la definizione originale di atmosfera non funzionava bene.
-
Quali unità di pressione sono uguali tra loro?
-
Quante atmosfere ci sono in 889 mmHg?
-
Quante atmosfere ci sono in 223 torr?
-
Quanti torr ci sono in 2,443 atm?
-
Quanti millimetri di mercurio ci sono in 0,334 atm?
-
Quanti millimetri di mercurio ci sono in 334 torr?
-
Quanti torr ci sono in 0,777 mmHg?
-
Quanti pascal ci sono in 1 torr?
-
Una pressione di 0,887 atm equivale a quanti pascal?
Risposte
La pressione è forza per unità di superficie. È causata dalle particelle di gas che colpiscono le pareti del loro contenitore.
6,84 Pa
Perché la pressione atmosferica a livello del mare è variabile, non è un’unità di pressione coerente.
1,17 atm
1.857 torr
334 mmHg
133 Pa