Come indicato nelle sezioni precedenti, la molecola d’acqua polare permette alle molecole d’acqua di formare legami tra loro. Questi legami sono chiamati legami a idrogeno. Se consideriamo il cloruro di sodio (sale), un composto che contiene legami ionici, potremmo dimostrare che semplicemente mettendo il sale da cucina in acqua, per esempio, possiamo ridurre l’attrazione elettrostatica tra gli ioni di sodio e cloruro di 80 volte. Man mano che sempre più ioni di sodio e cloro vengono liberati dall’indebolimento dell’attrazione elettrostatica che li tiene insieme, essi vengono circondati dalle molecole polari dell’acqua – ciò che viene chiamato “idratazione”.”

L’acqua scioglie più sostanze di qualsiasi altro liquido comune spezzando i “sali” in “ioni” componenti (ad esempio NaCl in Na+ e Cl-) e idratando questi ioni per evitare che interagiscano. Così, le molecole d’acqua polari hanno un’attrazione per gli ioni (atomi o gruppi di atomi con una carica), dove i “cationi” sono ioni con carica positiva e gli “anioni” hanno carica negativa. La maggior parte degli elementi hanno un’alta solubilità in acqua, il che significa che grandi concentrazioni di questi elementi possono accumularsi prima che la capacità delle molecole d’acqua di isolare gli ioni sia superata. Il punto in cui Na e Cl, per esempio, comincerebbero a precipitare un sale in acqua di mare è chiamato “saturazione”. Per il NaCl (il minerale “halite”) questo si verifica solo dall’acqua di mare attuale, quando si verifica l’evaporazione e il volume dell’acqua di mare è ridotto a circa il 10% del suo volume originale.
L’acqua di mare è essenzialmente una soluzione di NaCl che ha una concentrazione media di 35 g NaCl/kg di acqua (o 3,5% di sale). Na e Cl compongono oltre l’85% dei solidi dissolti totali (sale), ma ci sono altri ioni importanti presenti. L’abbondanza relativa degli ioni nell’acqua di mare è in ordine: Cl, Na, SO4, Mg, Ca, K. Insieme, questi ioni costituiscono > il 99% dei solidi dissolti nell’acqua di mare. Con solo altri quattro elementi–HCO3 (bicarbonato), Br, Sr, B, F–abbiamo il 99,99% di tutti i solidi dissolti. Le cariche devono bilanciarsi, quindi la carica positiva associata a Na+, Mg+2, Ca+2, K+ è uguale alla carica negativa associata a Cl-, SO4-2 (e HCO3-). Non pensiamo che si possa desiderare diversamente. Pensate a quale sarebbe il flusso della corrente dal mare a voi, seduti sulla spiaggia, se le cariche non fossero bilanciate – scioccante!
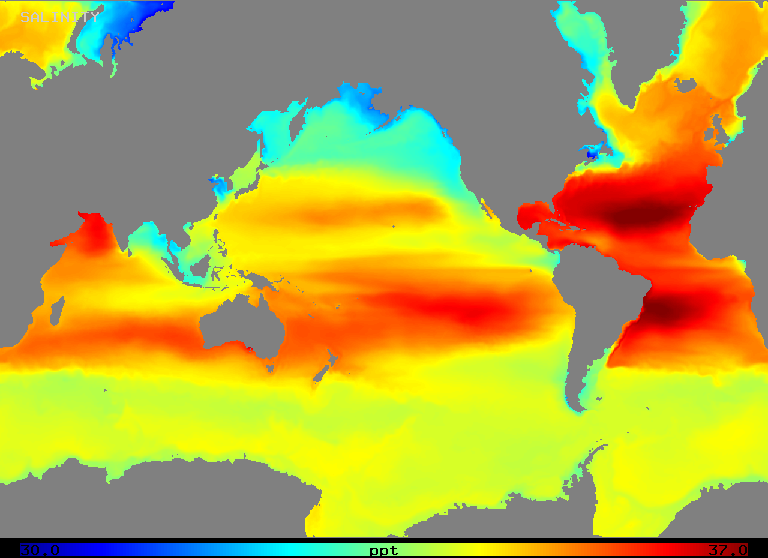
La salinità varia su una gamma da circa 32 a 37 o/oo nell’oceano aperto, come illustra la figura 2 (sotto). Si noti che le aree di maggiore salinità si verificano nelle regioni di maggiore evaporazione netta, come ci si potrebbe aspettare.
Tutte le altre sostanze disciolte in acqua di mare sono a concentrazioni molto basse (parte per milione o miliardo) (ppm o ppb; 10-6 a 10-9). Questo include nutrienti importanti come il fosfato e il nitrato che sono ciclati dagli organismi (elementi chiamati “bio-limitanti”) ed essenziali per la vita. Molti metalli hanno concentrazioni in tracce (vuoi diventare ricco? Ci sono circa 9 milioni di tonnellate d’oro disciolte nell’acqua di mare, che è circa uguale a tutto l’oro estratto sulla terra nel corso della storia).
Come indicato precedentemente, l’evaporazione dell’acqua di mare produce una sequenza prevedibile di sali minerali (i minerali si saturano ad un certo punto). Dopo l’evaporazione di qualche % della massa d’acqua, precipita il CaCO3 (calcite); dopo un’evaporazione dell’81%, precipita completamente il CaSO4 (gesso); dopo un’evaporazione del 90,5% circa, precipita completamente il NaCl (halite); al 96% di evaporazione, i sali di K e Mg (con SO4 e Cl) cadono. C’è abbastanza sale nell’oceano da coprire la terraferma con uno strato di 170 m di spessore. I depositi naturali di antichi oceani come questo sono chiamati “evaporiti”.