Quando si ha a che fare con gli isotopi di un elemento, è importante ricordare che si distinguono l’uno dall’altro aggiungendo il numero di massa al nome dell’elemento.
Nel tuo caso, il nome boro-11 è usato per designare un isotopo del boro che ha un numero di massa uguale a #11#.
Siccome il numero di massa è definito come la somma del numero di protoni e del numero di neutroni che l’atomo ha nel suo nucleo, ne segue che si può scrivere
#color(blue)(A = Z + “no. di neutroni”)” “#, dove
#A# – il numero di massa
#Z# – il numero atomico
Come sapete, l’identità di un elemento è data esclusivamente dal numero di protoni che ha nel suo nucleo. Questo numero rappresenta il numero atomico dell’elemento.
Quindi, per identificare il numero atomico del boro, dai un’occhiata veloce alla tavola periodica. Notate che il boro, #”B “#, che si trova nel periodo 2, gruppo 13 della tavola periodica, ha un numero atomico uguale a #5#.
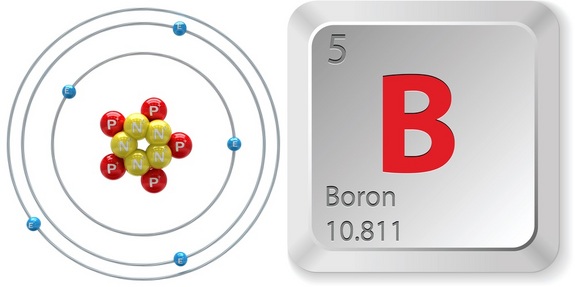
Questo significa che qualsiasi atomo che ha #5# protoni nel suo nucleo sarà un atomo di boro.
Quindi, il numero di massa di questo isotopo del boro è uguale a #11#, e il numero atomico a #5#.