INTRODUZIONE
L’insufficienza cardiaca congestizia (CHF) è una delle principali cause di ospedalizzazione, mortalità in-hospital e spesa sanitaria.1,2 Diversi tipi di ospedali e reparti clinici (ospedali terziari e di zona, reparti di cardiologia, reparti di medicina interna) ricevono pazienti con questo problema, circa il 30%-50% dei quali presenta una funzione sistolica ventricolare sinistra conservata.3-5 Esiste una certa controversia sulla prognosi di questa forma di CHF rispetto a quella in cui la funzione sistolica è ridotta,5-12 così come sui fattori prognostici associati alla mortalità.
In studi che hanno coinvolto in gran parte pazienti ambulatoriali con CHF e funzione sistolica ventricolare sinistra conservata, la malattia renale allo stadio terminale è stata trovata indipendentemente e significativamente associata a un aumento della mortalità13 ; infatti, anche forme lievi o moderate di insufficienza renale aumentavano il rischio di morte.14-17 Quando si analizza l’associazione indipendente tra insufficienza renale e mortalità nei pazienti con CHF va ricordato che l’insufficienza renale è associata a una maggiore prevalenza di altri fattori di rischio cardiovascolare (ad esempio, diabete mellito e pressione alta) che potrebbero aumentare la mortalità.18
Per quanto ne sappiamo, non è stata analizzata la relazione tra insufficienza renale e mortalità nei pazienti ospedalizzati con CHF scompensato, e in particolare in quelli con funzione sistolica ventricolare sinistra conservata. I pazienti con quest’ultimo tipo di CHF sono di solito anziani, hanno più probabilità di essere donne e di presentare una maggiore prevalenza di diabete e di pressione alta,19,20 fattori che potrebbero influenzare l’associazione tra insufficienza renale e mortalità.
Facendo uso di un registro prospettico di pazienti ricoverati per CHF nel reparto di cardiologia di un ospedale universitario, lo scopo del presente studio è stato quello di determinare se l’insufficienza renale è un predittore di mortalità quando la funzione sistolica ventricolare sinistra è conservata e quando è ridotta. Inoltre, è stata fatta un’analisi per determinare se il grado di insufficienza renale è associato a diversi profili di rischio cardiovascolare.
PATIENTI E METODI
Popolazione dello studio, criteri di selezione e definizioni
Tra il 1° gennaio 2000 e il 31 dicembre 2002, 630 pazienti con CHF, come definito dai criteri Framingham modificati (criteri principali: dispnea parossistica notturna, ortopnea, crepitio polmonare, ingorgo della vena giugulare, terzo suono cardiaco, segni radiologici di congestione polmonare e cardiomegalia; criteri minori: dispnea da sforzo, edema periferico, epatomagalia e versamento pleurico), sono stati ammessi al reparto di cardiologia di un ospedale terziario nel nord-ovest della Spagna. La diagnosi è stata raggiunta quando sono stati soddisfatti almeno 2 criteri maggiori o 1 maggiore più 2 criteri minori. I pazienti che sono stati riammessi sono stati esclusi e sono stati presi in considerazione solo i dati del primo ricovero di qualsiasi paziente durante il periodo dello studio. Per essere inclusi, i pazienti dovevano anche essere stati sottoposti a esami del sangue per determinare la loro concentrazione di creatinina sierica al momento dell’ammissione (prima di qualsiasi altro esame diagnostico o decisione terapeutica). La popolazione finale dello studio era composta da 552 pazienti.
La velocità di filtrazione glomerulare (GFR) è stata utilizzata per rappresentare la funzione renale. Questa è stata stimata utilizzando l’equazione proposta nello studio Modification of Diet in Renal Disease (186 x Cr sierico-1,154 x età-0,203 x1,210 x 0,742 ).21 Sono stati riconosciuti tre gruppi in termini di valori di GFR ottenuti: >60, 30-60, e r=0,84; P
L’influenza prognostica del GFR è stata analizzata per tutti i pazienti nel complesso e per i sottogruppi con funzione sistolica ventricolare sinistra conservata e ridotta. La classificazione dei pazienti in questi ultimi sottogruppi è stata stabilita in base alla loro frazione di eiezione ventricolare sinistra. Questa è stata determinata ecocardiograficamente in 469 pazienti utilizzando il metodo Simpson modificato, prendendo il 50% come valore di cut-off. I pazienti che non si sono sottoposti a questa procedura (15,03% della popolazione totale dello studio) non sono stati selezionati a priori; tale test è stato eseguito al momento dell’ammissione, se ritenuto clinicamente necessario dal cardiologo curante.
Variabili analizzate
Sono state registrate le seguenti variabili: demografia, fattori di rischio cardiovascolare, eziologia dell’insufficienza cardiaca, stato clinico, risultati degli esami complementari (radiografia del torace, elettrocardiogramma, analisi del sangue) e il trattamento prescritto alla dimissione. La selezione dei pazienti da includere nello studio e la raccolta dei dati sono state effettuate da 2 cardiologi con una vasta esperienza nel trattamento dell’insufficienza cardiaca. I dati clinici sono stati raccolti in modo prospettico per tutto il periodo dello studio. Tuttavia, per l’analisi della sopravvivenza, le informazioni sono state ottenute dai registri generali dell’ospedale; è stata effettuata anche un’intervista telefonica (aprile 2003).
Non erano disponibili dati affidabili sullo stato finale di 26 pazienti. Questo piccolo gruppo di pazienti non ha mostrato differenze significative rispetto ai restanti pazienti nelle loro caratteristiche cliniche.
Analisi statistica
Le variabili categoriali o dicotomiche sono state espresse come percentuali e confrontate usando il test χ² o il test esatto di Fisher. Le variabili continue sono state espresse come media ± deviazione standard (SD); il test t di Student è stato utilizzato per confrontare i diversi gruppi. Le curve di sopravvivenza sono state prodotte usando il metodo Kaplan-Meier. Queste sono state tracciate per i pazienti nel loro insieme e per i 2 sottogruppi (quelli con funzione sistolica ventricolare sinistra conservata e quelli con funzione ventricolare sinistra ridotta) per determinare la relazione tra il grado di insufficienza renale e la sopravvivenza, e per determinare la sopravvivenza dei pazienti rispetto ai diversi quartili di GFR. Il test log rank è stato utilizzato per confrontare le differenze di sopravvivenza.
L’analisi multivariata è stata eseguita utilizzando il modello di rischio proporzionale di Cox (2 fasi). Nella prima fase, sono state introdotte tutte le variabili significative nell’analisi univariata (analizzate separatamente per l’intero gruppo di pazienti e per i 2 sottogruppi) ed è stato utilizzato il metodo condizionale in avanti. Nella seconda fase, sono state introdotte le variabili risultate significative nella prima fase. I coefficienti di regressione risultanti sono stati utilizzati per stimare i rischi relativi. La validità del modello di rischio proporzionale è stata corroborata dal calcolo delle funzioni log-logiche per ciascuna delle covariabili introdotte. La significatività è stata fissata a P
RESULTS
Caratteristiche cliniche della popolazione complessiva dello studio
I 552 pazienti del presente studio avevano un’età media di 71,5 anni. Gli uomini costituivano il 58,7% della popolazione, il 49% aveva una cardiopatia ischemica e il 63% aveva la pressione alta. La maggior parte (69%) rientrava nella classe NYHA III/IV al momento dell’ammissione, e il 56% presentava una funzione sistolica ridotta. Il GFR medio era 66,9±30,4 mL/min/m² (Figura 1). Insufficienza renale grave (GFR60 mL/min/1,73 m² (insufficienza renale nulla/moderata).
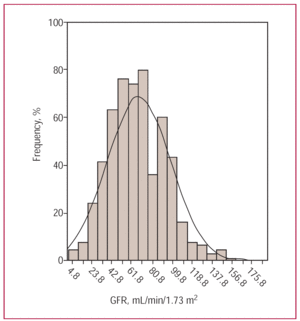
Figura 1. Istogramma di frequenza che mostra i diversi tassi di filtrazione glomerulare (GFR) nella popolazione in studio.
Al momento della dimissione, al 63% dei pazienti sono stati prescritti inibitori dell’enzima di conversione dell’angiotensina (ACE), al 42% beta-bloccanti e al 16% spironolattone. La tabella 1 mostra tutte le variabili analizzate.

Caratteristiche cliniche distintive dei pazienti con diversi gradi di insufficienza renale insufficienza renale
I pazienti con insufficienza renale grave (GFR
Sopravvivenza
Impatto dell’insufficienza renale sulla prognosi dei pazienti nel loro complesso
Il tempo medio di follow-tempo di follow-up era di 1.4±0,9 anni, ed era possibile per 526 pazienti (95,3%). Ventitre pazienti (53,5%) con insufficienza renale grave (GFR60 mL/min/1,73 m²). Dodici pazienti (in totale) sono deceduti durante l’ospedalizzazione; questo tasso di decesso era 5 volte superiore tra i pazienti con insufficienza renale grave rispetto a quelli con insufficienza renale nulla/moderata (41,7% rispetto al 50,0% nel gruppo di gravità moderata) e 8,3% tra quelli con insufficienza renale nulla/moderata). L’analisi Kaplan-Meier ha mostrato una mortalità notevolmente più elevata tra i pazienti con insufficienza renale grave (sopravvivenza media, 1,34 anni; intervallo di confidenza al 95%, 0,99-1,68 anni) (Figura 2). Sebbene la prognosi per i pazienti con insufficienza renale moderata fosse più sfavorevole rispetto a quelli con insufficienza renale nulla/moderata (sopravvivenza media, 2,45 anni; 95% CI, 2,26-2,63 anni, rispetto a 2,76 anni; 95% CI, 2,64-2,89 anni), la differenza era molto meno marcata che tra i pazienti con insufficienza renale grave e quelli senza insufficienza renale lieve. A un anno di follow-up, la sopravvivenza è aumentata progressivamente nei primi 3 quartili di GFR (72,2%, 82,4% e 90,8% rispettivamente). Una leggera diminuzione è stata osservata, tuttavia, per il quartile più alto (86,3%) (Figura 3).
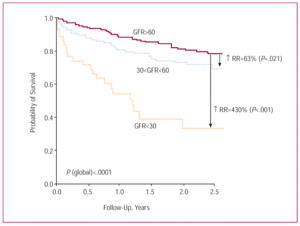
Figura 2. Curve di sopravvivenza Kaplan-Meier per i pazienti con insufficienza renale grave, moderata e nulla/moderata. GFR indica la velocità di filtrazione glomerulare; RR, rischio relativo.
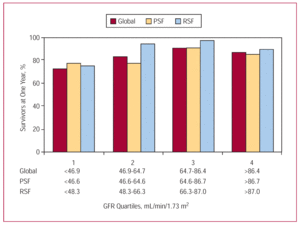
Figura 3. Sopravvivenza annuale dei pazienti totali, di quelli con funzione sistolica ventricolare sinistra conservata (PSF) e funzione sistolica ventricolare sinistra ridotta (RSF) rispetto ai quartili della velocità di filtrazione glomerulare.
Indipendentemente da altre variabili significativamente correlate alla sopravvivenza a lungo termine nell’analisi univariata, l’influenza dell’insufficienza renale grave è stata confermata dal modello di Cox multivariato; il rischio relativo massimo (RR) era 2,36 (95% CI, 1,26-4,42). Al contrario, l’insufficienza renale moderata non era significativamente associata alla sopravvivenza a lungo termine. Altre variabili indipendenti legate a una maggiore mortalità erano l’età e l’anemia. Il trattamento con ACE-inibitori era protettivo (tabella 2).

Il ruolo degli ACE-inibitori nell’influenza dell’insufficienza renale sulla prognosi
Sono state osservate differenze nell’influenza dell’insufficienza renale grave sulla sopravvivenza tra i pazienti a cui sono stati prescritti e non prescritti ACE-inibitori alla dimissione. Questi agenti hanno chiaramente attenuato l’effetto negativo di questa condizione sulla prognosi; infatti, la relazione significativa tra insufficienza renale e sopravvivenza è scomparsa nei pazienti a cui erano stati prescritti questi farmaci (P=.309). Al contrario, l’influenza negativa dell’insufficienza renale grave sulla sopravvivenza era molto significativa in coloro a cui non erano stati prescritti ACE inibitori (P

Influenza dell’insufficienza renale sulla prognosi dei pazienti con funzione sistolica conservata e ridotta
L’insufficienza renale era nighy prevalente in entrambi i sottogruppi di pazienti (quelli con funzione sistolica ventricolare sinistra conservata e quelli con ridotta) (Figura 4), colpendo circa la metà dei membri di ciascuno. Anche se l’insufficienza renale grave ha colpito una percentuale relativamente piccola di pazienti (10% dei pazienti con funzione sistolica conservata e 6% di quelli con funzione ridotta), è stata la variabile con la più forte influenza negativa sulla sopravvivenza, soprattutto tra quelli con funzione sistolica ridotta (Figura 5). Nel sottogruppo “conservato”, la sopravvivenza è stata ridotta da 2,75 anni (95% CI, 2,56-2,95 anni) nei pazienti con insufficienza renale nulla/moderata a 1,66 anni (95% CI, 1,16-2,17 anni) in quelli con insufficienza renale grave. Nel sottogruppo “ridotto” la sopravvivenza è stata ridotta da 2,83 anni (95% CI, 2,66-3,00 anni) in quelli con funzione renale normale a 1,17 anni (95% CI, 0,66-1,67 anni) in quelli con insufficienza renale grave. Per quanto riguarda i quartili di GFR e la sopravvivenza, le tendenze dei risultati per l’intero gruppo di pazienti e i 2 sottogruppi (quelli con funzione sistolica ventricolare sinistra conservata e quelli con funzione ventricolare sinistra ridotta) erano simili: un miglioramento nei primi tre quartili e un leggero peggioramento quando i valori di GFR erano >87 mL/min/1.73 m² (Figura 3).
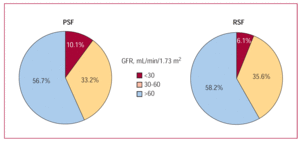
Figura 4. Proporzione di pazienti con diversi gradi di insufficienza renale nei sottogruppi conservati (PSF) e ridotta funzione ventricolare sinistra (RSF).
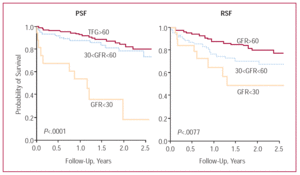
Figura5. Curve di sopravvivenza Kaplan-Meier per i pazienti con insufficienza cardiaca congestizia con insufficienza renale grave, moderata e nulla/moderata nei sottogruppi di funzione sistolica ventricolare sinistra conservata (PSF) e ridotta (RSF). GFR indica la velocità di filtrazione glomerulare.
L’influenza dell’insufficienza renale grave sulla prognosi era potente e indipendente da altre variabili significativamente associata alla sopravvivenza in entrambi i sottogruppi di funzione sistolica conservata e ridotta (tabella 4).

DISCUSSIONE
I risultati mostrano che l’insufficienza renale è indipendentemente associata alla mortalità tra i pazienti ospedalizzati per CHF. Questa associazione è stata vista sia nei pazienti con funzione sistolica ventricolare sinistra conservata che ridotta. Questa associazione era indipendente dall’età, dalla presenza di diabete mellito, dalla pressione sanguigna o da qualsiasi altro fattore di rischio per la mortalità. Di tutti i fattori trovati indipendentemente associati alla mortalità, l’insufficienza renale è stata la più importante, soprattutto tra i pazienti appartenenti al sottogruppo di funzione sistolica ridotta. I pazienti con insufficienza renale più grave hanno mostrato un profilo di rischio cardiovascolare peggiore; ciò dimostra che, nei pazienti con CHF, la malattia cardiovascolare e quella renale si sviluppano in modo parallelo. Ezekowitz et al22 hanno recentemente descritto che l’insufficienza renale è molto diffusa tra i pazienti con CHF e cardiopatia ischemica e che questa coesistenza è associata a un’aterosclerosi coronarica più avanzata. Analogamente, nei nostri pazienti, è stata osservata una relazione inversa tra i valori di GFR e la prevalenza della cardiopatia ischemica.
I presenti risultati sottolineano l’importanza dell’insufficienza renale come potente fattore di rischio per la mortalità nei pazienti ricoverati per CHF, sia che la loro funzione sistolica ventricolare sinistra sia conservata o meno. Dimostrano anche che i pazienti con insufficienza renale moderata possono avere livelli di creatinina sierica apparentemente normali, cosa che si vede spesso nella popolazione anziana.
Diversi articoli hanno riportato un’associazione tra il deterioramento della funzione renale e la prognosi dei pazienti con diversi tipi di malattia cardiovascolare clinica.13-17,23-25 Tale deterioramento è associato a un maggior rischio di complicazioni cardiovascolari e di morte nei pazienti con ipertensione, diabete mellito, cardiopatia ischemica (soprattutto) e CHF.26-33 Nello studio VALIANT (pazienti con disfunzione ventricolare e CHF dopo un infarto miocardico), il deterioramento della funzione renale è risultato associato a un aumento significativo della mortalità e delle complicazioni cardiovascolari. Questo aumento del rischio era indipendente da altre variabili che influiscono sulla prognosi del paziente.26 Una recente analisi dei risultati dello studio SAVE (pazienti con disfunzione ventricolare dopo un infarto del miocardio) ha rivelato un quadro simile e ha indicato che il trattamento con captopril era particolarmente importante nei pazienti che soffrivano anche di insufficienza renale.27
L’aumento del rischio di morte nei pazienti ambulatoriali con insufficienza renale moderata e CHF è ben noto, soprattutto in quelli con ridotta disfunzione sistolica ventricolare sinistra.14-17 Sono stati proposti diversi meccanismi per spiegare questo. L’insufficienza renale potrebbe essere un marcatore di CHF più avanzato, è associata a una maggiore prevalenza di altri fattori di rischio cardiovascolare e potrebbe limitare l’uso di farmaci noti per avere un impatto positivo sulla prognosi (come gli ACE-inibitori).34,35 Nel presente studio, l’insufficienza renale è risultata anche un predittore indipendente di mortalità dopo aver aggiustato i marcatori di gravità dell’CHF e altri fattori di rischio, sia nei sottogruppi con funzione sistolica conservata che ridotta. È possibile che la relazione tra insufficienza renale e CHF sia bidirezionale: la prima potrebbe accelerare la progressione della seconda, e la seconda influenzare la comparsa della prima.36
In qualche misura i risultati attuali suggeriscono tali relazioni, poiché i pazienti con insufficienza renale più avanzata avevano un profilo di rischio cardiovascolare peggiore. Tuttavia, sono necessarie ulteriori ricerche per determinare l’esatta natura della relazione tra insufficienza renale e CHF, in particolare per stabilire se la stabilizzazione dell’insufficienza renale è associata a una migliore sopravvivenza.
Come menzionato sopra, l’associazione tra mortalità e insufficienza renale è stata notata in entrambi i sottogruppi di pazienti con funzione sistolica conservata e ridotta. Tenendo presente la fisiopatologia dell’CHF con funzione sistolica ventricolare sinistra conservata, è possibile che la patogenesi dell’CHF e dell’insufficienza renale sia la stessa e che rifletta una progressione parallela della malattia cardiovascolare e renale. Diversi studi clinici sono attualmente in corso per determinare il trattamento più adeguato per l’insufficienza cardiaca con disfunzione sistolica ventricolare sinistra conservata. Data l’alta prevalenza di insufficienza renale associata a questa forma clinica di CHF e la sua associazione con la mortalità, è in questi pazienti che l’efficacia delle strategie terapeutiche rispetto al grado di insufficienza renale dovrebbe essere studiata.
Data l’importante relazione tra l’insufficienza renale e la prognosi dei pazienti con CHF, crediamo sia saggio valutare la funzione renale – almeno in termini di GFR – come parte della valutazione clinica e delle strategie di follow-up. La presenza di insufficienza renale dovrebbe obbligare a cercare cause potenzialmente trattabili, e richiede l’uso di farmaci noti per essere benefici – inibitori dell’ACE e beta-bloccanti. I risultati di studi recenti evidenziano i benefici prognostici del trattamento con questi agenti in pazienti con CHF e insufficienza renale.14,15,22,27 In uno studio14 è stato osservato che gli ACE inibitori hanno ridotto significativamente la mortalità in un gruppo di pazienti donne. Allo stesso modo, in uno studio che ha coinvolto 6427 pazienti,22 gli ACE inibitori e i beta-bloccanti hanno migliorato significativamente la prognosi dei pazienti con CHF e insufficienza renale.
Il presente lavoro ha anche identificato altri fattori che hanno influenzato indipendentemente la prognosi dei pazienti. È stata osservata un’associazione molto forte tra la presenza di anemia e l’CHF; l’anemia sembrerebbe influenzare negativamente (e significativamente) la prognosi dei pazienti.37 Da un punto di vista fisiopatologico ci sono diversi meccanismi che potrebbero spiegare l’associazione tra anemia e insufficienza renale nei pazienti con CHF; infatti, l’insufficienza renale potrebbe essere un fattore nello sviluppo dell’anemia.34 I presenti risultati hanno mostrato una correlazione significativa tra anemia e funzione renale. Tuttavia, sono necessari ulteriori lavori per determinare se la stabilizzazione dell’insufficienza renale nei pazienti con CHF ha un effetto favorevole sulla presenza di anemia, per stabilire se la correzione dell’anemia ha un effetto sulla sopravvivenza di tali pazienti e per valutare se tale correzione impedisce un ulteriore deterioramento della funzione renale.
CONCLUSIONI
L’insufficienza renale è un potente predittore di mortalità nei pazienti ospedalizzati per CHF, indipendentemente dal fatto che la funzione sistolica ventricolare sinistra sia conservata o ridotta. Nei pazienti presenti, l’insufficienza renale è stata associata a un profilo di rischio cardiovascolare peggiore, suggerendo che la malattia cardiovascolare e renale progrediscono insieme nell’CHF. Il trattamento con ACE-inibitori può attenuare l’aumento del rischio di morte dovuto all’insufficienza renale.
Si raccomanda di includere la valutazione della funzione renale negli esami clinici dei pazienti con CHF. Sono necessarie ulteriori ricerche sperimentali e cliniche per chiarire i meccanismi che giustificano l’associazione tra CHF e insufficienza renale, e per determinare le migliori strategie terapeutiche da seguire, sia nei pazienti con ridotta ma soprattutto con funzione sistolica ventricolare sinistra conservata.
Vedi editoriale alle pagine 87-90