Serous PED in AMD
Il distacco epiteliale del pigmento retinico (PED) fa parte dello spettro clinico della degenerazione maculare legata all’età (AMD).
Tuttavia, diversi tipi di PED sono stati riportati in letteratura e sono stati correlati o meno con la AMD.
Il PED sieroso è definito come un’area di rialzo sieroso nettamente delimitata e a forma di cupola dell’epitelio pigmentato retinico (RPE). L’istopatologia del PED sieroso è coerente con il distacco della membrana basale dell’RPE, insieme all’RPE sovrastante dalla restante membrana di Bruch a causa dell’accumulo di liquido(1).
La presenza di questa lesione è un fattore prognostico negativo per l’AMD in termini di risultato di acuità visiva.
Sebbene finora non siano state stabilite indicazioni terapeutiche definitive, la diagnosi precoce della PED sierosa è importante per la prognosi e la gestione dei pazienti con AMD.
Nella AMD, la PED sierosa può essere associata o meno a nuovi vasi coroideali (neovascolarizzazione coroideale – CNV). Tuttavia, il tipo vascolarizzato è di gran lunga il più osservato.
Sono state proposte diverse teorie sulla relazione tra PED sierosa e CNV.
Per spiegare la sua patogenesi, Gass ha teorizzato la crescita di nuovi vasi dalla coroide (neovascolarizzazione di tipo 1 (NV)) all’interno dello spessore della membrana di Bruch, che perdono attivamente, aumentando la pressione idrostatica e causando il distacco di RPE tra gli strati meno aderenti(2).
Questo concetto è stato successivamente supportato dall’evidenza che lo sviluppo della CNV è accompagnato da meccanismi infiammatori che aggiungono ulteriori danni alla membrana di Bruch, sostenendo il distacco del RPE dallo strato collagenoso interno(3-5).
Quando la crescita di nuovi vasi inizia dalla retina interna, più recentemente descritta come NV di tipo 3 e conosciuta anche come proliferazione angiomatosa retinica (RAP), è stato ipotizzato che la formazione di PED sieroso, che è molto frequentemente associata, può essere collegata all’invasione della RPE da parte del complesso neovascolare6-8).
Al contrario, altri autori hanno osservato che la presenza di PED può rappresentare una condizione preesistente che può promuovere la crescita di CNV attraverso un ulteriore danno alla membrana di Bruch, espressione della stessa malattia in corso(9,10).
Anche se la patogenesi della PED non è completamente compresa, da questi studi la formazione della CNV sembra essere un momento cruciale.
All’esame del fundus, la PED sierosa appare come un’area rotonda o ovale, distinta a forma di cupola, di distacco regolare della RPE e della sovrastante retina neurosensoriale, con colore da giallo ad arancio e superficie liscia. I margini sono tipicamente nettamente delimitati e si osservano frequentemente atrofia focale della RPE e figure di pigmento(9,11).
Tuttavia, la presenza concomitante di NV può generare una varietà di aspetti oftalmoscopici associati, come componenti emorragiche ed essudative, aree di rialzo irregolare della RPE e distacco sieroso della neuroretina circostante.
La presentazione della NV di tipo 1 situata al margine del PED può variare, risultando di solito in un aspetto reniforme o dentellato, o in un distacco di RPE dal lato piatto(12).
Il PED sieroso può essere visualizzato mediante angiografia con fluoresceina (FA), angiografia con verde indocianina (ICGA) e tomografia a coerenza ottica (OCT).
La FA rappresenta, tuttavia, il gold standard per la diagnosi di PED sieroso.
Esaminata con la FA, la PED sierosa mostra classicamente un’iperfluorescenza uniforme iniziale dell’intera lesione, leggermente ritardata rispetto alla fluorescenza di fondo, che aumenta progressivamente di luminosità con il progredire dell’esame (pooling).
L’iperfluorescenza della PED sierosa non cambia tipicamente in dimensione o forma durante le fasi angiografiche.
FA può anche dimostrare la presenza di NV, di solito associata al PED sieroso come NV di tipo 1, come aree di colorazione tardiva sottoretinica indistinta, più evidente quando si trova al margine del distacco di RPE o corrispondente al “notch”(11).
La presenza di NV può essere dedotta anche dalla presenza di una componente emorragica del PED, il menisco scuro descritto da Gass(12).
Tuttavia, una localizzazione più precisa della componente neovascolare può essere ottenuta con la ICGA digitale. La molecola verde indocianina ha proprietà biofisiche che, a differenza della fluoresceina, la rendono utile per valorizzare l’anatomia dei vasi attraverso il RPE, il sangue e l’essudazione torbida.
In dettaglio, l’ICGA permette di delineare meglio la presenza e il tipo di nuovi vasi associati a un PED sieroso, e per questo è considerato uno strumento fondamentale nella gestione di questa malattia(13-15).
In ICGA, il PED sieroso appare come una lesione ipofluorescente, con margini ben delineati, che rimane costantemente ipofluorescente durante tutte le fasi dell’esame(16).
Quando i nuovi vasi non sono presenti, non sono rilevabili segni di aree iperfluorescenti localizzate; il contorno del PED è nettamente arrotondato ed è quindi considerato un PED sieroso puro.
In pazienti AMD, Yannuzzi ha trovato un’incidenza del 4% di PED non vascolarizzati tra i PED sierosi(15).
Quando la componente neovascolare è presente, è stato suggerito il termine PED vascolarizzato(15),.che rappresenta circa il 24% delle nuove diagnosi di AMD essudativa(17).
I nuovi vasi associati alla PED sierosa sono rappresentati in diversi sottotipi.
La videoangiografia ad alta velocità con oftalmoscopio laser a scansione appare come uno strumento prezioso che permette all’oftalmologo di identificare il modello dei nuovi vasi e il loro comportamento angiografico(18).
Riconoscere i diversi tipi di NV, distinguendo i risultati angiografici, è obbligatorio per il distinto decorso naturale, la prognosi visiva e la diversa risposta al trattamento dei tre principali tipi di nuovi vasi associati alla PED sierosa nella AMD.
Il tipo più comune di nuovi vasi associati alla PED sierosa sono quelli che si verificano dalla coroide sotto il monostrato RPE(15-,17).
Questi nuovi vasi sono stati recentemente classificati come Tipo 1 NV e sono di gran lunga il tipo più comune di NV in AMD(19)(Figura 1).

Figura 1 – PED vascolarizzato con Tipo 1 NV. (A) FA, (B)ICGA e (C) OCT.
Nelle fasi iniziali, l’ICGA mostra l’arteria di alimentazione della NV che nasce dalla circolazione coroideale, e successivamente la venula drenante.
Al tempo stesso si può rilevare la rete capillare della membrana neovascolare.
A differenza della fluoresceina, il verde indocianina perde leggermente e l’iperfluorescenza NV è di solito minima, ad eccezione di alcuni casi che mostrano una perdita intensa, considerata come nuovi vasi molto attivi.
Frequentemente, nelle fasi tardive, può essere apprezzabile un’area ben definita di lieve iperfluorescenza corrispondente alla rete NV.
Il secondo tipo di nuovi vasi che complicano la PED sierosa sono i RAP(7,20-22), chiamati anche NV di tipo 3(19).
Queste lesioni vascolari, come riportato da vari autori, possono coinvolgere la retina esterna e l’RPE, attraverso una progressione che è stata ipotizzata avere origine dalla circolazione retinica e/o dalla coroide.
L’ICGA mostra tipicamente la presenza di un “hot-spot”, dovuto all’iperfluorescenza iniziale del complesso neovascolare intraretinico, che aumenta durante l’angiografia, con un intenso leakage nelle fasi tardive.
La sua luminosità è esaltata dall’ipofluorescenza circostante del PED sottostante (Figura 2).
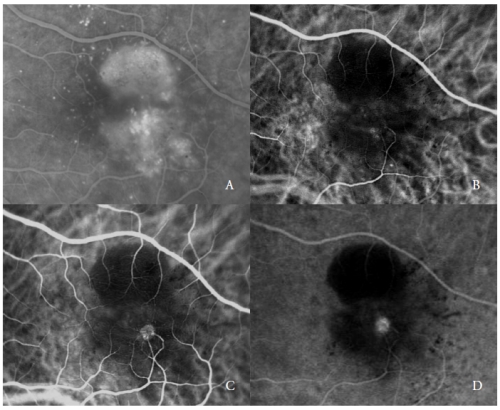
Figura 2 – PED vascolarizzato con NV di tipo 3 (RAP). FA (A) e ICGA fasi iniziali (B) e tardive (C e D).
Nelle fasi tardive della malattia, il complesso neovascolare coroideale è tipicamente connesso con uno o più vasi retinici che appaiono tortuosi e dilatati(7,22,23).
Il tipo 3 NV può essere singolo o multiplo, la sua origine è tipicamente extrafoveale, e si osserva frequentemente un’emorragia intraretinica in corrispondenza della lesione neovascolare(20).
Il terzo tipo di nuovi vasi associati alla PED sierosa nella AMD è coerente con la vasculopatia coroideale polipoide (PCV)(24).
La PCV è una forma particolare di CNV, caratterizzata dalla presenza di dilatazioni rotonde arancioni, aneurismali, simili a polipi, al confine di una rete vascolare ramificata di origine coroideale.
Anche se la PCV colpisce più frequentemente le popolazioni nere e asiatiche di mezza età, il suo spettro clinico è esteso ai bianchi, dove è stata riscontrata la sua presenza nell’8-13% dei pazienti con concomitanti lesioni AMD.
In questi casi, quando sono presenti le manifestazioni attribuibili sia alla PCV che alla AMD, alcuni autori considerano la PCV un sottotipo di CNV nella AMD(24,25).
La manifestazione emorragica è comune nei pazienti con PCV.
La PED sierosa associata alla PCV mostra frequentemente un livello di sangue nella porzione inferiore del distacco.
L’ICGA è l’esame più avanzato per distinguere le caratteristiche tipiche delle due componenti vascolari.
La rete vascolare è caratterizzata dalla presenza di una o più lesioni aneurismiche che mostrano una fluorescenza brillante fin dalle fasi iniziali, seguita nelle fasi tardive da un clearing del colorante, chiamato “wash-out”, tipico di questa malattia (Figura 3).
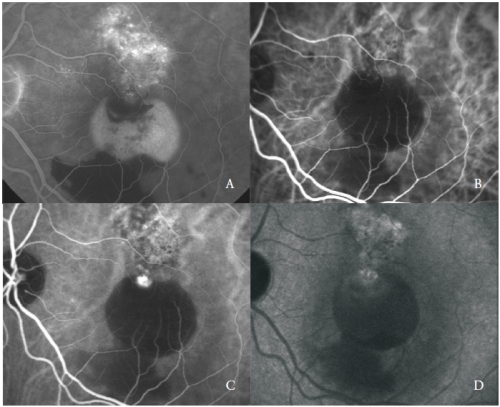
Figura 3 – PED vascolarizzato con PCV: FA (A) e fasi iniziali (B), medie (C) e tardive (D) di ICGA.
Nondimeno, alcune strutture simili a polipi possono attivamente perdere mostrando una colorazione tardiva delle loro pareti e dell’essudazione circostante.
Le lesioni polipoidali sono di solito situate al margine del PED sieroso(26).
Il riconoscimento di queste lesioni è fondamentale a causa del loro diverso decorso clinico, della prognosi e della risposta al trattamento rispetto agli altri sottotipi neovascolari di AMD.
L’OCT fornisce immagini che permettono un’esatta correlazione con i risultati angiografici.
Nelle scansioni OCT trasversali, la PED sierosa appare come un’elevazione a forma di cupola otticamente vuota della banda esterna ad alta riflessione – la RPE, che si stacca bruscamente dalla membrana di Bruch(26).
La retina sovrastante, di solito aderente al PED bolloso, ai margini della lesione, può essere leggermente staccata dal RPE sottostante.
Informazioni supplementari possono essere fornite dall’OCT nel PED vascolarizzato(28).
Le sezioni tomografiche, guidate da FA e ICGA nell’area corrispondente alla CNV, mostrano un rialzo più liscio del RPE, continuo con il distacco sieroso, con un backscattering più profondo, dovuto alla presenza del tessuto fibrovascolare.
Aree iporeflettenti di spazi omogenei otticamente vuoti riferibili all’accumulo di fluido sono frequentemente presenti negli spazi intraretinici e subretinici(29).
Gli spazi otticamente vuoti intraretinici sono più pronunciati quando il PED sieroso è associato ad un NV di tipo 3, specialmente con forma cistica (Figura 4).
Posizionando la linea di scansione corrispondente al “punto caldo”, l’anomalia neovascolare viene rappresentata come una zona pre-epiteliale densa o iperriflettente negli strati retinici interni, dove gli strati iperriflettenti esterni non sono più rilevabili(30).
La RPE vicino a quella lesione mostra spesso effrazioni o interruzioni nel suo strato iperriflettente(31).
La misurazione topografica retinica sostiene un aumento dello spessore retinico.
Negli occhi con PED sieroso e PCV, le lesioni polipoidali mostrano una netta sporgenza di RPE, simile al PED ma ripidamente inclinata.
La cavità polipoidale, di solito otticamente vuota, è contigua ad un rialzo irregolare di RPE, espressione della componente neovascolare occulta della lesione(32,33).
Il fluido sottoretinico e intraretinico, osservato come aree vuote otticamente ipofluorescenti, sono correlate all’attività PCV (Figura 4-B).
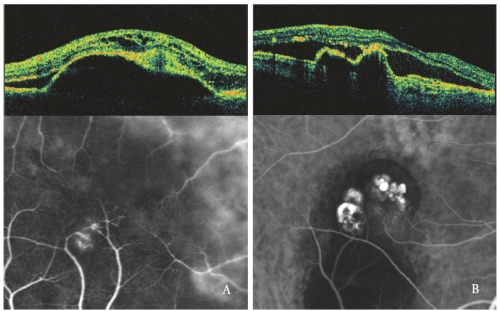
Figura 4 – NV di tipo 3 (RAP) (sinistra) e PCV (destra): Modelli OCT e ICGA.
La recente introduzione dell’angiografia OCT (OCT-A) ha reso possibile l’immagine della perfusione dei diversi strati retinici, senza iniezione del colorante e utilizzando il flusso endoluminale come contrasto intrinseco.
La figura 5 fornisce un esempio di come l’OCT-A immagini la rete coroideale in un caso di PCV.
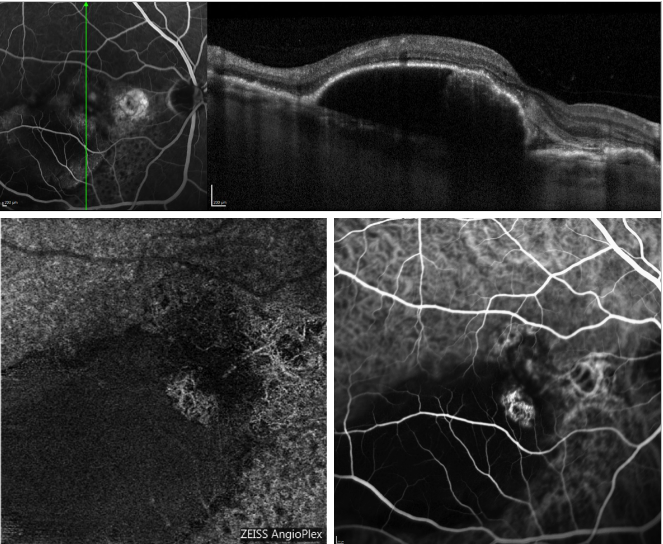
Figura 5 – PED sieroso e PCV ricorrente (FA, OCT, ICGA e OCT-A). In alto, scansione OCT acquisita simultaneamente alla FA; in basso, aspetto del profilo dei polipi su OCT-A (a sinistra) e ICGA (a destra).
Tuttavia, la natura statica di questo esame e la presenza di possibili artefatti sono limiti importanti che devono essere riconosciuti.
Per quanto riguarda il PED sieroso, l’ombreggiamento dovuto alla perdita di trasmissione del segnale in corrispondenza del PED può rendere difficile rilevare il complesso CNV su OCT-A (Figura 6).
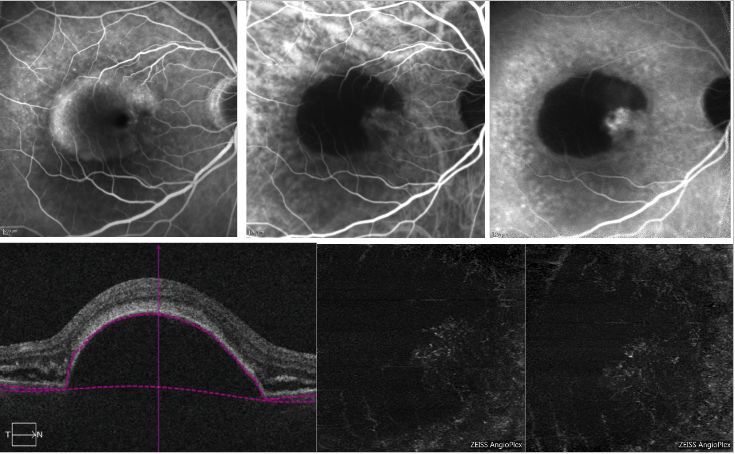
Figura 6 – PED vascolarizzato e PED sieroso con NV tipo 1 (FA, ICGA e OCT-A) . In alto, la FA (a sinistra) mostra un pooling di colorante dovuto alla presenza di un PED sieroso; l’ICGA (in alto al centro e a destra) mostra una rete neovascolare sul bordo del PED (tacca); in basso, l’OCT-A non fornisce un’immagine definita della rete neovascolare.
Il corso naturale del PED sieroso dipende dalla presenza o meno della componente neovascolare(34).
Nella PED sierosa pura c’è generalmente un lento ingrandimento della lesione, con una progressione minima della perdita visiva per un lungo periodo (mesi o anni).
Tuttavia, molti possono sviluppare successivamente una neovascolarizzazione, che peggiora la situazione(35).
Il decorso naturale nella PED vascolarizzata può variare, ed è legato al tipo di nuovi vasi associati.
La complicazione acuta più comune della PED è la lacerazione del RPE(36-39).
Si verifica di solito sul bordo del PED, all’intersezione dell’RPE staccato e attaccato.
Clinicamente, lo strappo dell’RPE appare come un’area ben definita di coroide nuda, contigua ad un’area rugosa iperpigmentata più scura, che corrisponde al tumulo dell’RPE che si è strappato(40,41).
Il RPE strappato di solito rotola verso la CNV, e la sua propensione allo strappo può essere prevista dall’osservazione delle caratteristiche pre-strappo, come un aumento delle dimensioni e una modifica della forma, la presenza di piccoli fori ai margini del PED, la presenza di emorragie o liquido sottoretinico, ma gli aspetti più degni di nota sono il riempimento irregolare del PED visibile alla FA, altezza del PED > 580 nm, durata > 4.5 mesi, linee radiali iperriflettenti sull’imaging di riflettanza vicina, minore rapporto di PED vascolarizzato e terapia con fattore di crescita endoteliale anti-vascolare (anti-VEGF)(42-46).
Le lacerazioni del PED si verificano spontaneamente o dopo un trattamento, formalmente fotocoagulazione laser, terapia fotodinamica e iniezione intravitreale di steroidi o agenti anti-VEGF(47- 58).
L’esatta patogenesi delle lacerazioni del RPE è poco compresa.
Per quanto riguarda il decorso naturale dei PED, è stato ipotizzato che le forze di taglio tangenziali nel PED possano causare la rottura della membrana basale del RPE al bordo del distacco; tuttavia, è più probabile che sia il risultato di diverse variabili, dove la presenza di una CNV gioca un ruolo importante.
Sono state riportate diverse relazioni causali per le lacerazioni dell’RPE che si verificano dopo il trattamento, tra cui il calore generato dalla fotocoagulazione, il brusco aumento del liquido intra-PED, una contrazione della CNV associata e la concomitante risoluzione improvvisa del liquido sub RPE.
Anche la presenza combinata della trazione vitreomaculare e la deformazione del globo dovuta al trauma meccanico dell’ago sono state riportate come agenti causali(59).
Dopo lo strappo dell’RPE, la maggior parte dei pazienti lamenta un improvviso e grave calo visivo.
In una piccola percentuale di occhi, dove la lacerazione risparmia la fovea, i pazienti possono sperimentare una temporanea conservazione di una buona funzione visiva(60).
Tuttavia, a lungo termine, la progressione di una cicatrice sottoretinica porta a un grave calo visivo. Nella prognosi della PED sierosa, si deve anche considerare l’alto rischio di coinvolgimento bilaterale(61).
Il trattamento della PED sierosa, associata o meno a CNV, è sempre stata una sfida e finora non ci sono linee guida raccomandate per la loro gestione.
I PED sierosi puri sono stati trattati in passato con griglia laser o fotocoagulazione diffusa, tuttavia con risultati deludenti(61).
Il trattamento dei PED sierosi, associati o meno a CNV, è sempre stato impegnativo e finora non esistono linee guida raccomandate per la loro gestione. I PED sierosi puri sono stati trattati in passato con griglia laser o fotocoagulazione diffusa, con risultati deludenti(62).
Nessun altro approccio è stato tentato per trattare queste lesioni.
Quando è presente una rete neovascolare, il trattamento dei PED sierosi si è concentrato sulla gestione della CNV. Tuttavia, dato che i PED vascolarizzati non sono mai stati inclusi nei principali studi randomizzati controllati, dobbiamo prendere la decisione del trattamento sulla base delle piccole serie pubblicate, che sono spesso retrospettive e coinvolgono diversi approcci terapeutici.
Ora, nell’era della terapia anti-VEGF, tutti i trattamenti precedentemente impiegati sembrano insoddisfacenti.
La fotocoagulazione laser è stata ampiamente impiegata e potrebbe avere ancora un’indicazione limitata quando una CNV ben definita da ICGA si trova a distanza dal RPE distaccato(63).
La sola terapia fotodinamica (PDT) con Verteporfina si è dimostrata dannosa, aumentando il rischio di lacerazione dell’RPE, emorragie e diminuzione improvvisa dell’acuità visiva(39,48,49,64) (Figura 7).
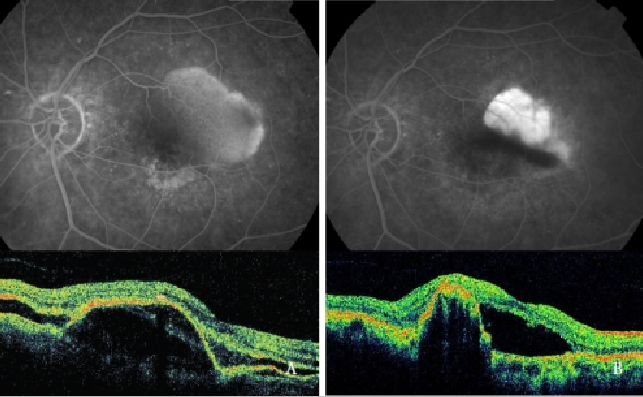
Figura 7 – PED vascolarizzato con CNV (tipo 1 NV) prima (sinistra) e dopo (destra) PDT: Lacerazione del RPE (FA e OCT).
Tuttavia, la PDT combinata con l’iniezione intravitreale di triamcinolone acetonide (IVTA) è stata dimostrata come potenzialmente capace di stabilizzare l’acuità visiva e ridurre le recidive(65).
Nonostante, l’alto tasso di complicazioni (cataratta e glaucoma) ha ridotto l’uso del triamcinolone intravitreale.
Dopo i risultati incoraggianti ottenuti con la terapia intravitreale anti-VEGF nel trattamento della CNV occulta, l’uso del trattamento anti-VEGF è stato esteso ai PED vascolarizzati con risultati deludenti(66-69).
Sia le complicazioni acute che la scarsa risposta anatomica al trattamento invalidano spesso i nostri tentativi di guarire la lesione. Sono state riportate lacerazioni dell’RPE ed emorragie sottoretiniche che complicano i trattamenti intravitreali con ranibizumab e bevacizumab(51-57).
Inoltre, il fluido sub-RPE difficilmente risponde alla terapia anti-VEGF, probabilmente a causa dei cambiamenti di idroconduttività della membrana di Bruch(69).
In una casistica retrospettiva di 328 pazienti trattati rispettivamente con bevacizumab, ranibizumab, pegaptanib e PDT+IVTA, dopo un follow-up medio di 42,4 settimane, gli autori hanno riportato una significativa stabilizzazione dell’acuità visiva in ogni gruppo, migliore in quelli con bevacizumab e ranibizumab rispetto agli altri due, e una frequenza complessiva delle lacerazioni RPE del 12.5%.
Tuttavia, concludono che con questi trattamenti, si può ottenere solo una regressione parziale delle lesioni, e il rischio di lacerazioni del RPE non è evitato(69).
Un altro studio retrospettivo(58). ha esaminato l’esito dei pazienti di PED vascolarizzati trattati con PDT da sola, PDT combinata con IVTA o iniezioni intravitreali anti-VEGF da sole (bevacizumab o ranibizumab) e ha mostrato migliori risultati funzionali per il gruppo di trattamento anti-VEGF.
Inoltre, in questa serie, la NV di tipo 1 con PED vascolarizzata rispetto alla NV di tipo 3, insieme a una migliore acuità visiva al basale, ha mostrato un maggior rischio di lacerazione acuta del RPE dopo il trattamento(58).
In un recente studio prospettico(19), il trattamento della PED associata alla NV subfoveale di tipo 1 con iniezione intravitreale di ranibizumab e con una fase di carico trimestrale e una strategia pro re nata ha portato a risultati solo parziali su un follow-up di 24 mesi.
Di recente diversi studi hanno indagato l’efficacia della terapia con aflibercept intravitreale della PED in AMD, mostrando una buona risposta anatomica con miglioramento o nessun cambiamento significativo dell’acuità visiva(70-73).
Inoltre, aflibercept intravitreale si è dimostrato un trattamento promettente nella PED resistente al trattamento con ranibizumab intravitreale(72-74).
Diversi studi hanno identificato i fattori che potrebbero influenzare la risposta della PED al trattamento anti-VEGF(75-78).
Dirani et al.(75) hanno dimostrato che un migliore miglioramento visivo era associato a una minore acuità visiva di base, alla presenza di liquido sottoretinico e al RAP. Inoltre, nella loro serie, la riduzione dei PED era associata a PED più alti al basale, a PED prevalentemente sierosi e all’uso di aflibercept.
Cho et al.(76), in una recente serie di casi, hanno trovato che un’altezza di PED più bassa al basale, PCV o RAP rispetto alla tipica AMD neovascolare, PED sieroso rispetto a PED fibrovascolare, e aflibercept rispetto a ranibizumab, hanno una maggiore possibilità di risoluzione dei PED durante il trattamento anti-VEGF dei PED.
Tuttavia, in una recente analisi post hoc di uno studio controllato randomizzato di fase III(77), è stato dimostrato che, a 24 mesi dall’inizio del trattamento anti-VEGF, circa la metà dei pazienti che presentavano PED al basale ha mostrato una risoluzione completa della PED indipendentemente dallo stato della PED e dall’altezza al basale.
Recentemente Chen et al.(78) hanno sottolineato l’importanza di differenziare gli occhi che presentano RAP in quanto hanno migliori risultati anatomici e funzionali con meno iniezioni rispetto ai PED con NV di tipo 1.
In futuro, nuove terapie combinate e nuove strategie terapeutiche, insieme all’identificazione di nuovi biomarcatori clinici di risposta al trattamento, contribuiranno a migliorare la prognosi dei pazienti affetti da PED vascolarizzata.