I legami a idrogeno possono formarsi tra la coppia solitaria sull’atomo di azoto molto elettronegativo e l’atomo di idrogeno leggermente positivo di un’altra molecola.
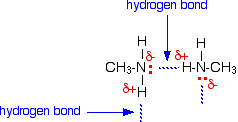
Il legame a idrogeno non è così efficiente come nell’acqua, per esempio, perché c’è una carenza di coppie solitarie. Alcuni atomi di idrogeno leggermente positivi non saranno in grado di trovare una coppia solitaria con cui legarsi a idrogeno. Ci sono il doppio degli idrogeni adatti rispetto alle coppie solitarie.
I punti di ebollizione delle ammine primarie aumentano all’aumentare della lunghezza della catena a causa della maggiore quantità di forze di dispersione di van der Waals tra le molecole più grandi.
Le ammine secondarie
Per un confronto corretto si dovrebbe confrontare il punto di ebollizione della dimetilamina con quello dell’etilammina. Sono isomeri l’uno dell’altro – ognuno contiene esattamente lo stesso numero degli stessi atomi.
Il punto di ebollizione dell’ammina secondaria è un po’ più basso della corrispondente ammina primaria con lo stesso numero di atomi di carbonio.
Le ammine secondarie formano ancora legami idrogeno, ma avere l’atomo di azoto al centro della catena piuttosto che alla fine rende il dipolo permanente sulla molecola leggermente inferiore.
Il punto di ebollizione più basso è dovuto alle attrazioni dipolo-dipolo più basse nella dimetilammina rispetto all’etilammina.
Le ammine terziarie
Questa volta per fare un confronto equo si dovrebbe confrontare la trimetilammina con il suo isomero 1-amminopropano.
Se guardi la tabella più in alto nella pagina, vedrai che la trimetilammina ha un punto di ebollizione molto più basso (3,5°C) rispetto all’1-amminopropano (48,6°C).
In una ammina terziaria non ci sono atomi di idrogeno attaccati direttamente all’azoto. Ciò significa che il legame a idrogeno tra le molecole di ammina terziaria è impossibile. Ecco perché il punto di ebollizione è molto più basso.
Solubilità in acqua
Le piccole ammine di tutti i tipi sono molto solubili in acqua. Infatti, quelle che normalmente si trovano come gas a temperatura ambiente sono normalmente vendute come soluzioni in acqua – più o meno nello stesso modo in cui l’ammoniaca è normalmente fornita come soluzione di ammoniaca.
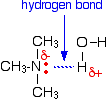
Tutte le ammine possono formare legami idrogeno con l’acqua – anche quelle terziarie.
Anche se le ammine terziarie non hanno un atomo di idrogeno attaccato all’azoto e quindi non possono formare legami a idrogeno con se stesse, possono formare legami a idrogeno con le molecole d’acqua semplicemente usando la coppia solitaria sull’azoto.
La solubilità cade man mano che le catene di idrocarburi diventano più lunghe – notevolmente dopo circa 6 carboni. Le catene di idrocarburi devono farsi strada a forza tra le molecole d’acqua, rompendo i legami idrogeno tra le molecole d’acqua.
Tuttavia, non li sostituiscono con qualcosa di altrettanto forte, e quindi il processo di formazione di una soluzione diventa sempre meno fattibile dal punto di vista energetico al crescere della lunghezza della catena.
L’odore
Le ammine molto piccole come la metilammina e l’etilammina hanno un odore molto simile a quello dell’ammoniaca – anche se se le confrontiamo una accanto all’altra, l’odore delle ammine è leggermente più complesso.
Come le ammine diventano più grandi, tendono ad avere un odore più “di pesce”, o odorano di decomposizione.
Se avete familiarità con l’odore dei fiori di biancospino (e cose dall’odore simile come i fiori di cotoneaster), questo è l’odore della trimetilammina – un odore dolce e piuttosto nauseabondo come le prime fasi della carne in decomposizione.
Domande per testare la tua comprensione
Se questa è la prima serie di domande che fai, leggi la pagina introduttiva prima di iniziare. Dovrai usare il PULSANTE INDIETRO del tuo browser per tornare qui dopo.
domande sull’introduzione alle ammine
risposte
Dove vorresti andare ora?
Al menu delle ammine . .
Al menu degli altri composti organici . . .
Al menu principale . . .