カポジ肉腫
カポジ肉腫(KS)はヒトヘルペスウイルス8型ウイルス(HHV-8)に関連する血管増殖性腫瘍である。1,2 4つの変種が報告されています(表1)。
異なるタイプのカポジ肉腫の疫学と臨床的特徴。
| div | クラシックKS | エンデミックKS | HIV-関連カポジサルコーマ | th |
|---|---|---|---|---|
| 年齢 | > 60歳 | 30-45歳 | 20-50歳td50歳 | 60歳 |
| リスク・グループ | 地中海・ユダヤ系 | アフリカ系 | HIV感染者・MSM | 移植を受けた人。 |
| 部位 | 脚部 | 頭、口腔。 内臓 | 手足 | |
| まれ | しばしばリンパ節腫脹性 | Frequent | Possible | |
| Outcome | Indolent Course | Progressive | Aggressive, 抗レトロウイルス療法で遅らせることができる | 可変性、免疫抑制の低下で退行することができる |
略語。
古典的なカポジ肉腫。 この腫瘍は、地中海または中央ヨーロッパ地域の男性1,3に発症しやすい珍しい腫瘍で、発症率は0.18~13.2例/百万人です4。慢性下肢浮腫、糖尿病、副腎皮質ステロイド使用者の男性に多く発症します。 病変は、単数または複数の緩徐に増殖する紅斑性-絨毛性のプラークまたは結節として現れ、まれに四肢のリンパ浮腫、消化管やリンパ節の病変を伴うことがあります。
風土病のカポジ肉腫です。
内出血性カポジ肉腫は、赤道直下のアフリカで報告されており、若年成人や思春期前の人が罹患します。
免疫抑制関連カポジ肉腫(iatrogenic variant)
免疫抑制関連カポジ肉腫(iatrogenic variant)。 この変異型は、免疫抑制剤による治療を受けている患者、特に移植患者で報告されています。 KSの発症リスクは一般人口の150~200倍と推定され、発症までの平均期間は18カ月である6
HIV関連カポジ肉腫(epidemic variant)。 この亜種は、男性と性交渉を持つHIV感染者(MSM-HIV+)で報告されています。 高活性抗レトロウイルス療法(HAART)の時代以前は、MSM-HIV+の25%がKSを発症すると計算されていましたが、この割合は徐々に減少しています2,7(図1および2)。 これらの患者は、皮膚や粘膜、リンパ節、消化管、肺、脾臓、肝臓に浸潤する可能性がある。7 MSM-HIV-のKSも報告されているが、この場合は経過が緩慢である8
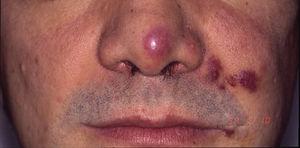
後天性免疫不全症候群の患者に発生したカポジ肉腫。 鼻先,口角,左頬に紅斑性-黄斑性のプラークが見られる。
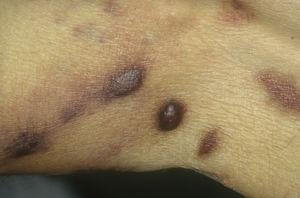
脚部に発生した古典的なカポジ肉腫。
診断
診断は臨床的に行いますが、生検による確認を得ることが推奨されます。 組織学的には,紡錘細胞,スリット状の不規則な血管の増殖,赤血球の滲出,形質細胞や細胞内外のヒアリン球を伴う白血球の浸潤が真皮の厚さ全体に認められ,いわゆるpromontory signも認められる(図3)。 ポリメラーゼ連鎖反応やHHV-8ウイルスの潜伏関連核抗原(LANA-1)の免疫組織化学的染色は陽性である1
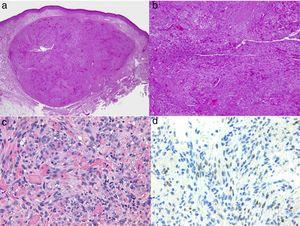
カポジ肉腫の組織学的特徴
A, 結節期のカポジ肉腫の低倍率像。 明確な皮膚結節。
B, 亀裂の形でいくつかの隙間がある細胞性の高い病変。
C, 小血管内の紡錘細胞と赤血球の詳細。
D, カポジ肉腫に特異的なHHV-8の免疫組織化学的核陽性。
病期分類と補完的検査
古典的なカポジ肉腫です。 臨床症状(年齢、局所浸潤、内臓への浸潤が少ない、経過が緩慢)を考慮すると、皮膚やリンパ節の検査で十分である。 患者が内臓障害の症状を呈している場合は補完的な検査を行う。 後述するHIV関連のKSと同様に、免疫抑制関連のKSについてもコンセンサスとなる病期分類は存在しない。
HIV関連カポジ肉腫 この病型には受け入れられた病期分類がない。 胸部X線検査が推奨され、呼吸器系の障害を示唆する異常がある場合には、気管支鏡検査や胸部CT検査を行うべきである。
1989年、AIDS臨床試験グループの腫瘍学委員会は、病勢の拡大、CD4T細胞数、全身性障害(日和見感染症、発熱、体重減少、持続的な下痢などのB症状、カルノフスキー成績が70点以下)に基づいた病期分類(表2)を提案しました。 前向きな分析では、これらの変数が患者の生存率に関係しており、良好な予後に関連する要因は、病状が限られていること、CD4リンパ球数が150cells/mm3以上であること、全身性の障害がないことであることが示されました9。
AIDS Clinical Trials Groups Oncology Committeeが提案した病期分類。
| 良好な予後(0) | 予後不良(1) | |
|---|---|---|
| 腫瘍 | 腫瘍が皮膚やリンパ節にしか見られないもの。 または口腔内に軽微な病変がある場合 | 腫瘍が原因となっているか潰瘍がある場合 口腔内に重度の病変がある場合 消化管にKS病変がある場合 リンパ節以外の内臓にKS病変がある場合 |
| 免疫力 | CD4≧200/μL | CD4 200/μL |
| 全身性疾患 | 日和見感染症や鵞足炎がない B症状がない Karnofsky performance status ≥ 70 |
日和見感染症や鵞足炎がある B症状がある Karnofsky performance status 70 その他のHIV-関連疾患(例えば |
略語。 KS、カポジサルコーマ(Kaposi sarcoma)。
長引く発熱、寝汗、10%以上の体重減少、または15日以上続く下痢。
これらの病期分類の提案は、HAARTが利用可能になる前に出されたもので、ウイルス量を含んでいないため、この病期分類の適用は臨床試験に限られています。
治療古典的なカポジ肉腫
古典的なKSに対するさまざまな治療法の比較臨床試験はほとんどありません。
-
孤立性病変
- –
臨床的観察。 患者の年齢や死亡率の低さを考えると、治療をせずに経過観察することも選択肢の一つである。 10
- –
局所放射線治療。 低エネルギー放射線治療(100kV:8Gyを単回照射、または20~30Gyを分割照射)は、孤立した病変に有効である。10 放射線治療を受けた68人の患者のレトロスペクティブな分析では、85%の患者に良好な反応が見られ、58%に完全な反応、95%に症状の改善が見られた。 腋窩など違和感のある病変の場合は、手術が推奨されます。 外科的に切除された病変を対象とした研究では、患者は治療後平均15ヵ月間、再発しないことが確認されています3
- –
凍結療法。 凍結療法は1cm以下の孤立した病変、特に腋窩部に使用でき、30秒から60秒の使用が可能です。
- –
局所療法。 ビンブラスチン(0.2mg/mL、2週間毎)、ビンクリスチン(0.03-0.08mg)、インターフェロンアルファ(3-5MIU/3回、4-5週間)を用いた局所治療10、アリトレチノイン0.1%ゲル(黄斑部)やイミキモド5%クリーム(週3回、24週間)の局所塗布10などが文献で推奨されている治療法ですが、これらのレジメンの使用経験は限られています5。
-
離断性疾患
- –
Pegylated liposomal doxorubicin(PLD)(20mg/m2を3週間ごとに投与)。 PLDは心臓病のある患者を除いて選択される治療法です。 11 化学療法の期間は十分に確立されていませんが、臨床効果が得られた後も1~2サイクルは治療を継続することが推奨されています。 PLDによる治療は、一般的に忍容性が高く、副作用も少なく、従来の化合物による治療に比べて心毒性も低い。 そのため、より高い累積投与量と長期の治療が可能です。 最も重篤な毒性(グレード3および4)は頻度が低く、好中球減少症や貧血などがあります12
- –
ビンブラスチン(3mg/m2/週/静注または6mg/m2/週/静注)。 ビンブラスチンは、白血球減少が生じることがありますが、奏効率は50%から90%と良好な結果が得られます3,13。
- –
高い奏効率を示しながらも副作用を伴うその他の化学療法としては、パクリタキセル(100mg/週)、ブレオマイシン(15U/週、3週間、その後3週間ごとに筋肉内投与)、エトポシド(100mg/日、週3~5日)の経口投与などがあります。10 ビンブラスチンの静脈内投与とエトポシドの経口投与を比較した無作為化臨床試験は1件のみで、奏効率や生存率に有意な差は認められませんでしたが、エトポシド投与の方が副作用の割合が高いことが報告されています13。
カポジ肉腫の治療のアルゴリズム。
| Variant | Treatment | ||
|---|---|---|---|
| Classic KS | Treatment of Choice | Other Alternatives | |
| I. 単発または孤立した病変 | a. 臨床的観察のみを考慮する。 b. 局所的な放射線治療または外科的切除 |
イントラレメンタル治療 | |
| II. 播種性疾患 | リポソーマルドキソルビシン | ビンブラスチン、パクリタキセル、エトポシド | |
| HIV関連カポジサルコーマ | I. 単発または孤立した病変 | 局所療法(放射線療法、外科的切除、または凍結療法)の有無にかかわらず、HAARTを開始する | HAARTと局所療法 |
| II. 播種性疾患 | HAARTとリポソームドキソルビシン | HAARTとパクリタキセル | |
| Iatrogenic KS(免疫抑制に伴うもの) | 免疫抑制剤の投与を中止または減量する | HIV関連のKS治療のレジメンに従う。associated KS | |
略語です。 HAART, highly active antiretroviral therapy; KS, Kaposi sarcoma
HIV関連カポジ肉腫
-
孤立性または限定的な病変
- –
HAARTの単剤投与または局所療法との併用(図4)。 HAARTは、免疫機能を回復させ、肉腫の発生率と重症度を低下させ、病変を縮小または消失させることが示されていることから、初期治療として投与される2,7。 症状のある病変や抗がん作用のある病変では、手術、14 電気凝固療法、または凍結療法が選択肢となります。 局所ビンブラスチン15(0.2~0.3mg/mL、0.5cm2の病変ごとに0.1mLを投与)または低エネルギー放射線治療(100kV、8Gy/1フラクションまたは30Gy/10フラクション、95%以上の完全な臨床効果)を検討することができます16。 局所療法の有無にかかわらず、HAART治療後5年目の無病変生存率は、400例以上のシリーズで92%でした14。
 HIV関連カポジ肉腫の治療アルゴリズム。 略語の説明 HAART,highly active antiretroviral therapy(高活性抗レトロウイルス療法);IRS,immune reconstitution syndrome(免疫再構築症候群)。 Consensus Group for treatment of HIV-associated Kaposi sarcoma(HIV関連カポジ肉腫の治療に関するコンセンサスグループ)より引用。 コンセンサス会議。 バルセロナ。 Saned; 1998.図4.
HIV関連カポジ肉腫の治療アルゴリズム。 略語の説明 HAART,highly active antiretroviral therapy(高活性抗レトロウイルス療法);IRS,immune reconstitution syndrome(免疫再構築症候群)。 Consensus Group for treatment of HIV-associated Kaposi sarcoma(HIV関連カポジ肉腫の治療に関するコンセンサスグループ)より引用。 コンセンサス会議。 バルセロナ。 Saned; 1998.図4.HIV関連のカポジ肉腫の治療アルゴリズム
略語。 HAART, highly active antiretroviral therapy; IRS, immune reconstitution syndrome.
Consensus Group for treatment of HIV-associated Kaposi sarcomaからの引用です。 Consensus meeting. Barcelona: Saned; 1998.
(0.12MB)。 -
離脱性疾患
HAART治療を受けている患者で、広範囲の皮膚病変(15~25病変以上)がある場合は、全身治療が推奨されます。 強烈な腫れ、局所療法に反応しない、または急速に進行している皮膚KS、免疫再構成症候群に伴うKS、または内臓に症状のある病変を有する患者。
- –
PLD(20mg/m2を3週間ごとに投与)。 HAARTとPLDの併用は、HAART単独よりも効果が高いため、同時に開始する必要があります17。 併用療法では、80%が完全/部分寛解し19、5年生存率は85%以上となっています。 20 PLDは、ブレオマイシン、ビンクリスチン、ビンブラスチンと非リポソーム型ドキソルビシンの併用療法21やリポソーム型ダウノルビシンの併用療法22よりも奏効率が高い。 パクリタキセルは第二選択薬であり、71%の患者で良好な反応が得られている23が、PLDよりも生存率が低く、グレード3-5の毒性が高い14,24。デキサメタゾンの前投薬が必要であり、抗レトロウイルス剤との間に重篤な薬物-薬物相互作用が生じる可能性がある。
- –
その他の治療法。 エトポシド、ビノレルビン、インターロイキン12、ベバシズマブ、イマチニブなどの他の薬剤も使用されていますが、経験は限られています5
Immunosuppression-Associated Kaposi Sarcoma
- –
免疫抑制剤を中断するか、用量を減らす。 免疫抑制剤の投与を中止または減量することで、自然寛解が得られる可能性がある。
結論
KSは血管増殖性の腫瘍であり、高齢者、特定のアフリカ系住民、異所性の免疫抑制、またはHIV感染に関連するさまざまなサブタイプがある。
Cutaneous Angiosarcoma
血管肉腫は肉腫全体の1〜2%を占めるが、少なくとも半分は皮膚に発生する。25,26 皮膚肉腫の中で、血管肉腫はKS、皮膚線維肉腫、平滑筋肉腫に次いで4番目に多い。 皮膚血管肉腫は、最も予後の悪い皮膚新生物の一つであり、5年生存率は、最も古いシリーズ27では10%、最も新しいシリーズでは30~50%である25,28,29。 皮膚血管肉腫には、3つの主要な病型があります。 1つは高齢者の顔面や頭皮に発生する特発性病変(Wilson-Jones血管肉腫)で、これは皮膚血管肉腫の約50%を占めています。また、2つの形態の二次性血管肉腫があり、1つは慢性リンパ浮腫の部位、特に根治的乳房切除術を受けた女性の腕に限局するもの(Stewart-Treves症候群)、もう1つは放射線照射を受けた皮膚の部位、特に乳癌後に放射線治療を受けた女性の胸部に発生するものです(図5)。 5).
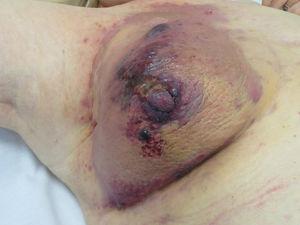 Angiosarcoma。 癌のために放射線を照射されたことのある乳房上の発赤した絨毛状のプラークに、赤みを帯びた絨毛状の丘疹と結節が見られる。
Angiosarcoma。 癌のために放射線を照射されたことのある乳房上の発赤した絨毛状のプラークに、赤みを帯びた絨毛状の丘疹と結節が見られる。疫学・臨床診断
皮膚血管肉腫の発生率を算出することは困難ですが、血管肉腫を合わせると、米国では人口100万人当たり0.4例の割合で報告されています31。 皮膚血管肉腫は、全血管肉腫の35%から60%を占め、その発生率はおよそ人口100万人あたり0.2例です。 皮膚血管肉腫は、平均年齢73歳の高齢の患者に多く見られます。 これらの病変は、小児または若年者では非常に稀である。 特発性血管肉腫の大部分は頭頸部に発生し(62%)、放射線照射後の病変は体幹(24%)、特に胸部(乳房の放射線照射後)、リンパ浮腫後の四肢(11%)に多く発生する。 放射線後の血管肉腫の多くは、乳癌による放射線治療後に出現するが32、他の照射部位にも症例があり、悪性の経過だけが原因ではない。 放射線治療から血管肉腫発症までの潜伏期間は様々であり、乳房部位では平均5年、その他の部位では平均10年である。 リンパ浮腫による血管肉腫は、主に根治的乳房切除術を受けた女性の腕の慢性リンパ浮腫部位(Stewart-Treves症候群)に発生しますが33、あらゆる原因のリンパ浮腫上の病変の症例が報告されています。
最も特徴的な初期の形態は、あざのような病変で、時に浮腫んでいて、定義された頻度は低く、特に髪の毛のある患者の頭皮では、最初は気づかれない傾向がある34。頭頸部の血管肉腫の場合、患者が頭を心臓の高さよりも低くして数秒間保持すると、病変の本当の範囲がよくわかる。 35 臨床経過の後半では、丘疹や結節が現れ、進行した段階では潰瘍化や出血を伴うこともある。 中には直接、丘疹や結節が出現し、その前にあざのような局面がほとんどない症例もある。 28,29 血管肉腫は、孤立性または多房性の腫瘍として現れ、病変はしばしば臨床的に評価可能な範囲を超えて拡張する。
組織学的診断
3つのタイプの皮膚血管肉腫は、組織学的特徴が重なっています。 よく分化した血管肉腫は、扁平な内皮細胞が並ぶ血管腔、コラーゲン束の解離、限られた細胞の異型性を示す。 組織診断はこれらの段階では複雑であり、血管内腔に数層の内皮細胞層が存在し、突出していくつかの乳頭を形成する傾向のある高色素性核を有する突出した多形細胞を有するいくつかの内皮を認識することが有用である36,37。 分化度の低い症例では、腫瘍細胞は上皮状または房状で、著しい異型性と豊富な有糸分裂を示し、血管腔が少なく、より堅固な成長パターンを示すため、癌、あるいはメラノーマや線維肉腫と混同されることがあるほどである。 原始的な血管分化の表現としての細胞質内空胞の存在は、これらの症例の正しい診断を疑う上で非常に有用である。 未分化な血管肉腫の場合、浸潤は非常に破壊的であり、真皮および皮膚付属物の正常な構成要素は消失する。 パッチ状の炎症性浸潤を伴うことが多く、この浸潤は時にリンパ腫に似たほど高密度になることがある。38 赤血球やヘモシデリンの付随の程度は非常に多様である。 同一の血管肉腫に異なる分化度がしばしば認められることがある。 表皮は正常、萎縮、または潰瘍化していることがある。 皮膚血管肉腫の分化の程度は、伝統的に予後に影響を与えるとは考えられていないので、他の肉腫とは異なり、組織学的グレードは病期分類に考慮されていない39。 現在までに発表された皮膚血管肉腫と軟部組織血管肉腫の最大のシリーズである821人の患者を対象とした最近の研究では、組織学的グレードを含んだsurvialの予後モデルが開発されたので、このアプローチは将来的に変わるかもしれません25
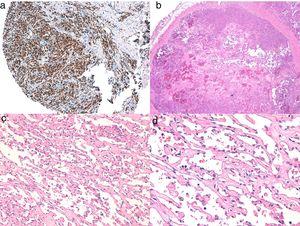 A, ERGに陽性の皮膚血管肉腫の免疫組織化学(典型的には核パターン)。 B, 血管形成パターンを有する部位が優位に存在する血管肉腫。 C, D, 新生児内皮細胞の詳細な画像で、この症例では突出しているが特筆すべき異型性はない。
A, ERGに陽性の皮膚血管肉腫の免疫組織化学(典型的には核パターン)。 B, 血管形成パターンを有する部位が優位に存在する血管肉腫。 C, D, 新生児内皮細胞の詳細な画像で、この症例では突出しているが特筆すべき異型性はない。
A, ERGが陽性(典型的には核パターン)である皮膚血管肉腫の免疫組織化学。 B, 血管形成パターンを有する部位が優位にある血管肉腫。 C, D, 腫瘍性内皮細胞の詳細な画像で、この症例では突出しているが、特筆すべき異型性はない。
血管肉腫の研究は、紡錘細胞腫瘍の基本パネル(CD31、パンシトケラチン、S110、アクチン)と追加の血管マーカー(CD34、赤芽球形質転換特異的関連遺伝子 、ポドプラニン)を含む免疫組織化学パネルで完成させる必要があります。 上皮性細胞が優勢な血管肉腫の中には、サイトケラチンが陽性となる症例もあるが、CD31、ERG、ポドプラニンなどの血管マーカーが陽性であれば、未分化癌を除外することができる。 近年、多くの血管肉腫がMYCの増幅・過剰発現を有することが明らかになってきた。 ほとんどの研究では、MYC増幅は、二次性血管肉腫の50%から100%に認められるが、特発性のものには一般的に認められない40-42。しかし、MYC増幅または過剰発現は、いくつかの特発性血管肉腫でも検出されている43,44。
血管やリンパ管に発生する血管肉腫の起源については、議論の余地がある。 ポドプラニン、D2-40、LYVE-1、PROX-1などのリンパ管に比較的特異的な免疫組織化学的マーカーは、皮膚の血管肉腫では通常陽性であり、しばしば内皮性血管と内皮性リンパ管の混合した免疫組織化学的パターンで発現する38,46,47。 例外的ではあるが、S-100タンパク質48や神経内分泌マーカーを発現する皮膚血管肉腫の症例が報告されている49。
病期分類
皮膚血管肉腫の管理に関するガイドラインはないが、最も頻度の高い転移部位が肺50であり、次いでリンパ節であることを考えると、病理診断後には通常、胸腹部CT検査が推奨される。 この画像診断には、頭頸部の血管肉腫の場合には頸部を、腹骨部の放射線後血管肉腫の場合には骨盤を含めるべきである。 29
血管肉腫に特異的なTNM病期分類はないので、米国がん合同委員会分類の軟部肉腫のTNM病期分類を血管肉腫に適応させたものが用いられる。
治療
皮膚の血管肉腫で治癒の可能性があるとされている唯一の治療法は手術であるが、治癒はごくまれにしか起こらない。 しかし、手術不能または転移性の症例では、放射線療法や化学療法が緩和的な役割を果たすことが認められている。 さらに、いくつかの最近の研究では、血管肉腫の限局した症例では、手術の補助として放射線治療も含まれており50,51、一部の著者は局所リンパ節への放射線照射を推奨している52が、これは一般的ではない。 皮膚血管肉腫における手術の問題点は、ある時は多施設であること、またある時は臨床的な区切りが悪いこと、さらには病変が5cmを超えた時点で診断されることが多いことである。 これらの要因に加えて、患者は高齢者であることが多く、適切な手術断端を得ることがより困難になります。 一般に、皮膚血管肉腫の治療は、腫瘍の特徴と患者の全身状態が許せば、十分な切除断端を有する外科的切除が行われる。 最も受け入れられているのは、臨床的に評価可能な限界に対して3cmのマージンをとった手術である53。この腫瘍が皮膚肉腫であることを考えると、マージンの深さは十分に確立されていないが、筋膜を切除せずに到達することは妥当であると思われる。 しかし、最も浸潤している症例では、明確なマージンを得るために筋を含めるべきである。 血管肉腫が浸潤しているマージンは、いくつかの研究で予後不良の要因であることが示されている。乳房に浸潤している場合、ほとんどの研究では、乳房全摘術または照射皮膚の多かれ少なかれ広範囲の切除が提案されている。 複雑な症例では、事前にバイオプシーマッピングを行うことで、術前計画の助けとなる。 皮膚腫瘍では、可能な限り、フォローアップを容易にし、外科的再建で局所再発の可能性を隠さないために、直接閉鎖、グラフト、またはセカンドインテント閉鎖が好ましいが、皮膚全体への照射を伴う乳房全摘を必要とする乳房血管肉腫のより根本的な切除の後では、これは困難または不可能かもしれない。 リンパ浮腫を原因とする血管肉腫の場合、Stewart-Treves症候群の患者160名の報告を検討した結果、これらの症例では根治的手術(マージン2~3cm)と比較して切断の有益性が認められなかったことから、このような血管肉腫では四肢の切断は正当化されないようです54。
手術が不可能な場合、つまり多中心性や広範囲の病変、あるいは手術が困難な部位にある場合には、放射線治療が選択されます55。
血管肉腫における化学療法の唯一の役割は、緩和的な治療であり、手術ができない再発性または転移性の病変に適用される。 しかし、現在のNCCNガイドラインでは、ビノレルビン、ソラフェニブ、スニチニブ、ベバシズマブも含まれているが、後者の3つの血管新生阻害剤の結果は残念なものであった。 61,62
フォローアップ
皮膚血管肉腫のフォローアップに関する標準的なガイドラインはありません。 私たちのグループでは、最初の数年間は3〜6カ月ごとに検診を行い、その後10年間は1年ごとに検診を行い、緊密な臨床経過観察を行っています。 これらの診察では、皮膚全体を検査し、対応する領域のリンパ節を触診します。
Conflicts of Interest
著者は、利益相反がないことを表明しています。