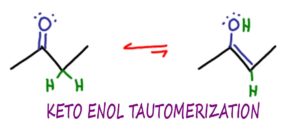
 ケト・エノール互変異性化(KET)とは、ケトン分子とエノール分子が異性化または相互変換する有機化学反応であり、通常は酸または塩基を触媒とした反応である。
ケト・エノール互変異性化(KET)とは、ケトン分子とエノール分子が異性化または相互変換する有機化学反応であり、通常は酸または塩基を触媒とした反応である。
ケト・エノール互変異性化は、有機化学のコースでは、アルキンの水和反応から始まり、上級(orgo 2)のエノラート反応や縮合反応で再び現れます。
互変異性化は、非常に特殊なタイプの異性化で、
この場合は、分子のケトとエノールの形態の間の相互変換です。

ケトはケトン官能基を指しますが、KETはJUSTケトンに限定されるものではありません。
末端の水素を除いてケトンと非常に似ているアルデヒドも互変異性化を起こします。
 エノールは、炭素と炭素の二重結合であるアルケンの「Ene」と、アルコールのOH基である「ol」から来ています。
エノールは、炭素と炭素の二重結合であるアルケンの「Ene」と、アルコールのOH基である「ol」から来ています。
Feeling rusty?
「有機化学の官能基」を復習しましょう
「互変異性」が「異性化」に似ているとすれば、「互変異性体」は「異性体」、具体的には「体質異性体」と考えてください。
「互変異性体」とは、平衡状態で相互変換できる分子の2つの特定の形態を指します。

Which is More Stable, Keto Or Enol?
可逆的な反応であるにもかかわらず、ケト体の方が安定しているため、平衡状態では有利になります。
これは、酸素と結合した炭素の二重結合の方が、酸素と結合した炭素の一重結合や水素と結合した炭素の一重結合よりも安定しているからです。
幸いなことに、この計算は一般化学で習う熱力学からのもので、有機化学のレベルでは計算する必要はありません(一部の教授はまだ必要としています)。

ケト体はより安定したカルボニルを持っていますが、エノール体はπ結合をより安定した芳香族系の一部にすることができます(芳香族性についてはこちら)。
ケト・エノール互変異性は、アルキンのヒドロホウ素化やオキシメルカ化をはじめとするさまざまな有機反応で登場します。
アルキンのオキシマーキュレーションにおけるKET
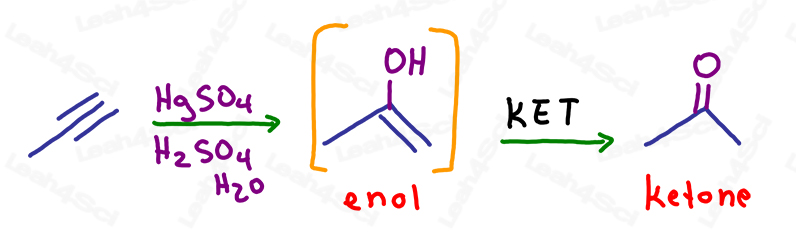
オキシマーキュレーション反応は、アルケンと同様に、マルコフニコフの法則に従って、1つのπ結合を切断して、より置換度の高い炭素にアルコールを加えるだけです。
結果として得られる分子には、アルコールと同じ炭素上にアルケンという1つのπ結合が残っています。
これは不安定なエノールであり、自動的にケトエノール互変異性化を経て、より安定したケトンの最終生成物を形成します。
アルキンのヒドロホウ化におけるKET
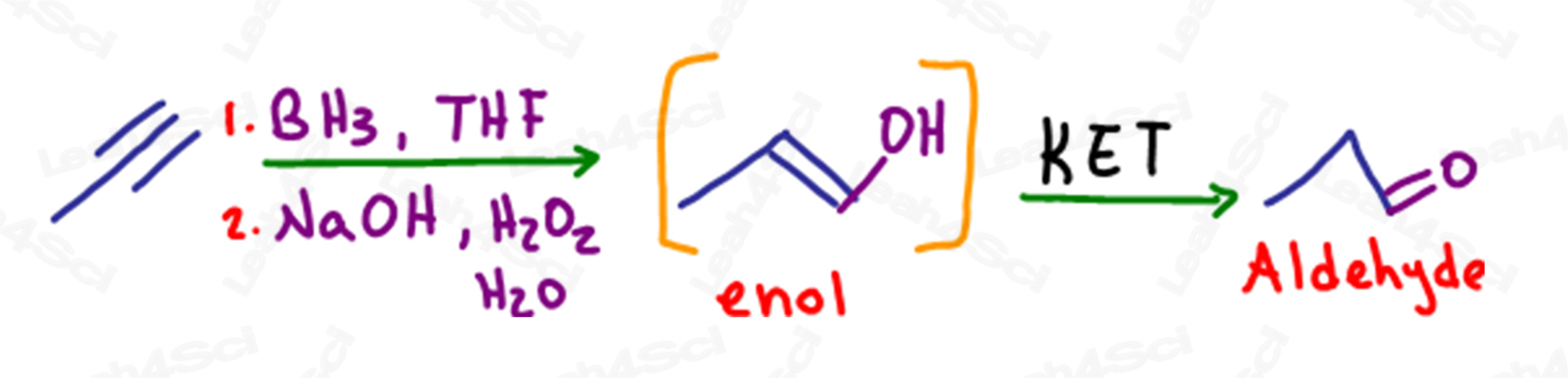
アルケンと同様に、ヒドロホウ化はπ結合が切断され、置換度の低い炭素にアルコールが付加される反マルコフニコフ反応です。
末端アルキンの場合、1つのπ結合がアルコールになっても、末端の炭素にはπ結合やアルケンが残っているため、エノールになります。
この分子も互変異性化して、より安定なアルデヒドの生成物を形成します。
アルデヒドを形成するにもかかわらず、この反応はケトエノールの互変異性化とみなされます。
この2つの反応では、生成するケトンやアルデヒドは、エノールの位置によって決まります。
エノールが内部(非末端)の炭素にある場合、生成物はケトンを形成します。
互変異性化は、酸触媒と塩基触媒の両方の条件で起こる可能性があります。
上記の反応で、書かれているように水和を受けた後の条件を考えてみましょう。
以下のビデオでは、順を追って説明しています
- 酸触媒による互変異性化反応とそのメカニズム
- 塩基触媒による互変異性化反応とそのメカニズム
- 両反応の逆反応(ケト体→エノール体)
酸触媒による互変異性化反応のメカニズムh2Catalyzed Tautomerization Mechanism Overview
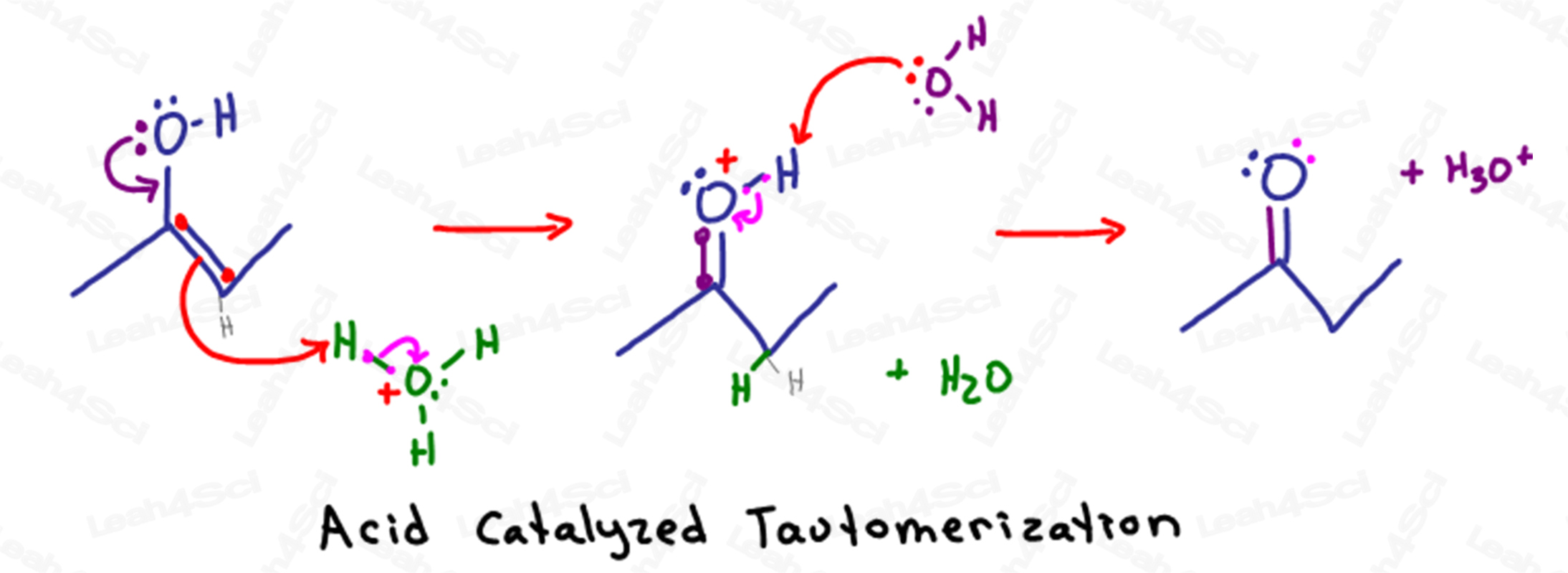
酸性水溶液では、溶液中に水とヒドロニウム(H3O+)がたくさんあることを覚えておいてください。
アルコール酸素の部分的にマイナスの電子が、sp2の炭素原子(π結合を持つ原子)を攻撃することで、互変異性化が始まります。
炭素と酸素の間に2つ目の結合を形成することで、炭素は合計5つの結合を持つことになります。
オクテットに違反しないように、炭素は自分ともう1つのsp2炭素原子との間のπ結合を追い出し、電子をもう1つの炭素に押し付けます。
負の電子は、炭素上のローンペアとしてではなく、近くのヒドロニウム分子上の部分的に正のH+原子に引き付けられます。
そのH+原子は1つの結合しか持てないので、酸素に結合していた電子を手放し、水が溶液中に浮かんできます。
結果として得られた分子は、不安定な酸素原子を除いてケトンのように見えます。
炭素に2つ、水素に1つの結合、そして1つのローンペアを持つ酸素は、不安定な正電荷を持っています。
溶液中のもう1つの水分子は、その部分的に負の電子を使って酸素を脱プロトン化し、電子を返して中性の安定したケトンを形成します。
簡単な会計処理をしてみましょう。
この反応は、エノールが酸触媒であるヒドロニウムを攻撃したときに始まりました。
この反応は、エノールが酸触媒であるヒドロニウムを攻撃することから始まりました。
最終段階では、水がケトンを脱プロトン化し、酸触媒であるヒドロニウムを改質します。
備考:エノールが末端にある場合、得られる生成物はケトンではなくアルデヒドです
塩基触媒による互変異性化のメカニズムの概要
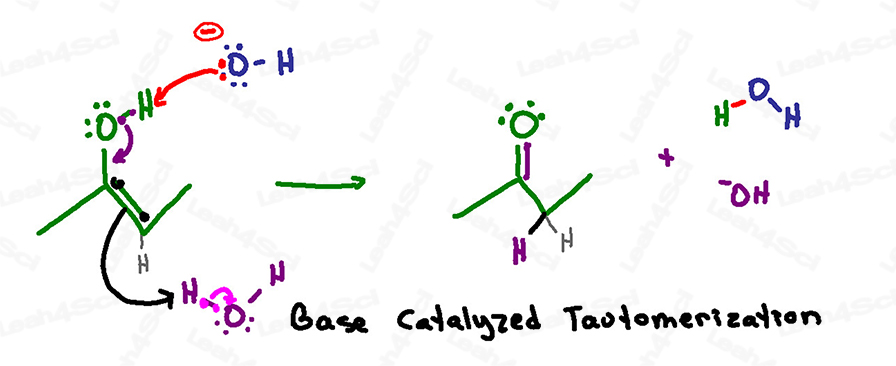
備考:塩基性の水溶液では、水酸化物と水の両方が浮遊しています。
この反応は、脱プロトン化が最終段階ではなく最初の段階であることを除けば、酸触媒によるメカニズムと非常によく似ています。
これは、塩基性溶液は負の酸素を扱うことができますが、酸性溶液では負の酸素を形成することができないためです。
この反応は、溶液中の塩基性の水酸化物がエノールの酸性の水素に到達したときに始まります。
電子は酸素に折り返されて負の酸化物を形成するのではなく、すぐに下方に折り返されて炭素と酸素の間にカルボニルπ結合を形成します。
酸触媒によるメカニズムと同様に、炭素は5つの結合を持ち、オクテットに違反することを避けるために、現在の二重結合を追い出さなければなりません。
一連の攻撃(ワンステップ)で、最終的にはケトンが生成されます。
この反応で何が使われ、何が改質されたかに注目してください。
水酸化物がプロトンを掴んで水を形成しますが、エノールが水からプロトンを掴んで水酸化物を形成し、この反応を開始した基本的な触媒を改質します。