これまでの章で述べてきたように、極性のある水分子は、水分子同士が結合を作ることができます。 この結合は水素結合と呼ばれています。 イオン結合を持つ化合物である塩化ナトリウム(食塩)を考えてみると、例えば、水の中に食卓塩を入れるだけで、ナトリウムイオンと塩化物イオンの間の静電引力が80倍になることがわかります。 ナトリウムイオンと塩素イオンの静電引力が弱まって自由になるイオンが増えると、それらは水の極性分子に取り囲まれることになり、これを「水和」といいます。”

水は、「塩」を構成する「イオン」に分解し(例:NaClをNa+とCl-に分解)、それらのイオンが相互に作用しないように水和させることで、他のどの一般的な液体よりも多くの物質を溶かします。 このように、極性のある水分子はイオン(電荷を持つ原子や原子団)に引き寄せられる性質があり、「陽イオン」は正の電荷を持つイオン、「陰イオン」は負の電荷を持つイオンである。 ほとんどの元素は水への溶解度が高く、水分子がイオンを分離する能力を超える前に、その元素が大量に蓄積されてしまう。 例えば、NaやClが海水中で塩を析出し始める点を「飽和」と呼ぶ。
海水は基本的にNaCl水溶液であり、平均濃度は35g NaCl/kg water(塩分3.5%)である。
海水は基本的にNaCl水溶液で、平均35g/kg(3.5%)の塩分を含んでいます。 海水に含まれるイオンの相対的な存在度は、以下の順になっている。 これらのイオンを合わせると>海水中の溶存固形物の99%を占めます。 その他、HCO3(重炭酸)、Br、Sr、B、Fの4つの元素だけで、溶存する固形物の99.99%を占めています。 電荷は釣り合わなければならないので、Na+、Mg+2、Ca+2、K+の正電荷と、Cl-、SO4-2(およびHCO3-)の負電荷は等しくなります。 これ以外の方法は考えられないでしょう。
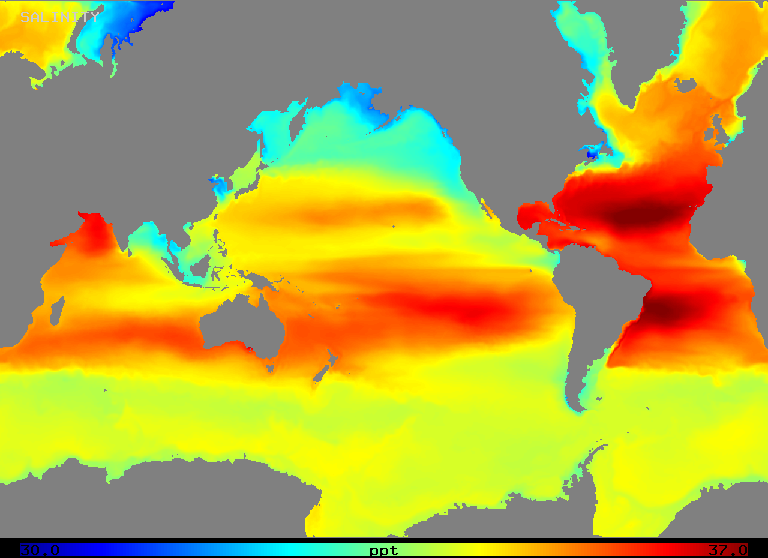
塩分濃度は、図2に示すように、外洋では約32〜37o/ooの範囲で変化します。
海水中の他のすべての溶存物質は、非常に低い濃度(百万分の一または十億分の一)(ppmまたはppb; 10-6~10-9)です。 この中には、リン酸塩や硝酸塩など、生物が循環する重要な栄養素(「生物限界」と呼ばれる元素)や、生命維持に不可欠な元素が含まれています。 多くの金属は微量な濃度である(金持ちになりたい?
先に示したように、海水を蒸発させると、予測可能な順序でミネラル塩が生成されます(ミネラルはある時点で飽和します)。 水量の数%を蒸発させるとCaCO3(方解石)が析出し、81%を蒸発させるとCaSO4(石膏)が完全に析出し、約90.5%を蒸発させるとNaCl(ハライト)が完全に析出し、96%を蒸発させるとK塩とMg塩(w/SO4とCl)が脱落します。 海中には、陸地を170mの厚さで覆うほどの塩分が存在する。 このような太古の海の自然堆積物を「エバポライト」と呼びます。