AMDにおける漿液性PED
網膜色素上皮剥離(PED)は、加齢黄斑変性症(AMD)の臨床スペクトラムの一部です。
しかしながら、さまざまなタイプのPEDが報告されており、それらはAMDと関連していたり、関連していなかったりします。
漿液性PEDは、網膜色素上皮(RPE)のドーム状の漿液性の隆起が明確に区分されている領域と定義されています。
この病変の存在は、視力の面でAMDの予後を悪くする要因となります。
今のところ明確な治療法は決まっていませんが、漿液性PEDを早期に発見することは、AMD患者の予後や管理に重要です。
AMDでは、漿液性PEDは、脈絡膜新生血管(choroidal neovascularization – CNV)を伴うものと伴わないものがあります。
漿液性PEDとCNVの関係については、いくつかの説が提唱されている。
Gassは、その病態を説明するために、ブルッフ膜の厚さの内側に脈絡膜からの新生血管(Type 1 neovascularization (NV))が成長し、それが活発に漏出して静水圧を高め、接着性の低い層の間でRPEの剥離を引き起こすと考えた(2)。
この概念は、後に、CNVの発症には、ブルッフ膜にさらなる損傷を与え、内側のコラーゲン層からのRPEの剥離をサポートする炎症メカニズムが伴うという証拠によって裏付けられました(3-5)。
新しい血管の成長が網膜内側から始まる場合、最近ではType 3 NVと表現され、網膜血管腫性増殖(RAP)としても知られていますが、非常に頻繁に起こる漿液性PEDの形成は、新生血管複合体によるRPEの侵襲に関連しているのではないかという仮説が立てられています6-8)。
これに対して、PEDの存在は、進行中の同じ疾患の表現である、さらなるブルッフ膜の損傷を通じてCNVの成長を促進する既存の状態を表すことができると考える著者もいます(9,10)。
PEDの病態は完全には解明されていないが、これらの研究から、NVの形成は極めて重要な瞬間であると考えられる。
眼底検査において、漿液性PEDは、RPEとその上にある神経感覚網膜の規則的な剥離の円形または楕円形の明瞭なドーム状の領域として現れ、黄色からオレンジ色をしており、表面は滑らかである。
しかしながら、NVを併発すると、出血や滲出成分、RPEの不規則な隆起、周囲の神経網膜の漿液性剥離など、さまざまな眼科的特徴を伴うことがあります。
PEDの縁に位置するType 1 NVの症状は様々であり、通常は連状または切欠き状、あるいは扁平なRPE剥離となる(12)。
漿液性PEDは、フルオレセイン血管造影(FA)、インドシアニングリーン血管造影(ICGA)、光干渉断層計(OCT)で画像化することができるが、
FAは漿液性PED診断のゴールドスタンダードである。
FAで検査すると、漿液性PEDは、典型的には初期に病変全体に均一な蛍光増多を示し、背景の蛍光に比べてわずかに遅れ、検査の進行とともに徐々に輝度が上昇する(プーリング)。
漿液性PEDの蛍光増多は、通常、血管造影の段階では大きさや形状に変化はない。
FAはまた、NVの存在を示すことができます。通常、漿液性PEDはType 1 NVとして関連しており、不明瞭な後期網膜下染色の領域のようなもので、RPE剥離の縁に位置する場合や「ノッチ」に対応する場合にはより明らかです(11)。
NVの存在は、PEDの出血性成分(Gassが記述したdark meniscus)の存在によっても推測することができます(12)。
しかしながら、デジタルICGAでは、新生血管成分のより正確な位置を得ることができます。
詳細には、ICGAは漿液性PEDに関連する新生血管の存在とタイプをより明確にすることができ、この理由からこの疾患の管理における基本的なツールと考えられています(13-15)。
ICGAでは、漿液性PEDは、はっきりとした境界線を持つ低蛍光性の病変として現れ、検査の全段階で常に低蛍光性を維持します(16)。
新生血管が存在しない場合には、局所的な高蛍光領域の兆候は検出されず、PEDの輪郭はシャープな丸みを帯びており、したがって、純粋な漿液性PEDと考えられる。
AMD患者において、Yannuzziは漿液性PEDの中でnon-vascularized PEDの発生率が4%であることを見出した(15)。
新生血管成分が存在する場合には、vascularized PED(15)という用語が提案されている。
漿液性PEDに伴う新生血管は、さまざまなサブタイプに分けられます。
走査型レーザー検眼鏡を用いた高速ビデオアンギオグラフィは、眼科医が新生血管のパターンとその血管学的挙動を識別するための貴重なツールです(18)。
AMDの漿液性PEDに関連する3つの主要な種類の新生血管の自然経過、視覚的予後、および治療に対する反応を区別するためには、血管造影所見を区別して、異なるタイプのNVを認識することが必須です。
漿液性PEDに関連する最も一般的なタイプの新生血管は、RPE単層の下の脈絡膜から発生するものです(15-,17)。
これらの新生血管は最近、Type 1 NVとして分類され、AMDでは圧倒的に多いタイプのNVである(19)(図1)。

図1-Type 1 NVを伴う血管のあるPED。
初期の段階では、ICGAでは脈絡膜循環から発生したNVのフィーダー動脈と、それに続くドレイン静脈が示されます。
フルオレセインとは異なり、インドシアニングリーンはわずかにリークし、NVの蛍光増強は通常、最小限に抑えられますが、例外的に、非常に活発な新生血管と考えられる激しいリークを示すケースもあります。
末期になると、NVネットワークに対応する軽度の蛍光増白の明確な領域が認められることがある。
漿液性PEDに合併する第2のタイプの新生血管は、Type 3 NV(19)とも呼ばれるRAP(7,20-22)である。
これらの血管病変は、様々な著者によって報告されているように、網膜循環および/または脈絡膜に由来すると仮定された進行を経て、網膜外層およびRPEを侵す可能性があります。
ICGAでは一般的に、網膜内新生血管複合体の初期の高蛍光に起因する「ホットスポット」の存在が示され、血管造影中に増加し、後期には強い漏出が見られます。
その明るさは、周囲のPEDの低蛍光によって強調されています(図2)。
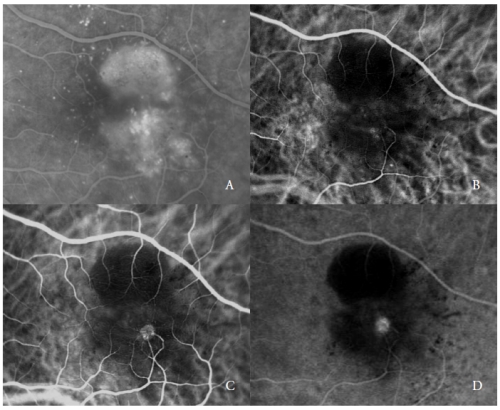
図2 – Type 3 NV(RAP)を伴う血管拡張したPED(RAP)。
病気の後期では、脈絡膜新生血管複合体は一般的に、蛇行して拡張しているように見える1本以上の網膜血管とつながっています(7,22,23)。
タイプ3のNVは単数または複数で、その起源は通常、眼球外であり、新生血管病変に対応する網膜内出血がしばしば観察されます(20)。
AMDの漿液性PEDに関連する第3のタイプの新生血管は、ポリープ状脈絡膜血管症(PCV)と一致します(24)。
PCVは特異な形態のCNVで、脈絡膜由来の分岐した血管網の境界に、オレンジ色の動脈瘤状のポリープのような円形の拡張が見られることが特徴です。
PCVは中年の黒人やアジア人に多く見られますが、その臨床スペクトラムは白人にも拡大しており、AMD病変を併発している患者の8〜13%に見られることがわかっています。
このように、PCVとAMDの両方に起因する症状が見られる場合、PCVをAMDにおけるCNVのサブタイプとみなす著者もいます(24,25)。
出血性の症状はPCVの患者によく見られます。
PCVに伴う漿液性PEDでは、剥離の下部に血液が多く見られます。
ICGAは、2つの血管成分の典型的な特徴を区別するための最新の検査です。
血管網は、初期段階から明るい蛍光を示す1つまたは複数の動脈瘤病変の存在によって特徴付けられ、後期段階では、この疾患に典型的な「ウォッシュアウト」と呼ばれる色素のクリアリングが続きます(図3)。
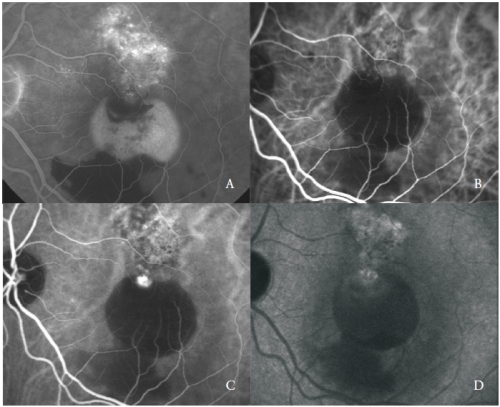
図3 – PCVによる血管新生PED:FA(A)とICGAの初期(B)、中期(C)、後期(D)の各相。
それにもかかわらず、いくつかのポリープ状の構造は、その壁と周囲の滲出物の後期染色を示す活発な漏出を起こすことがあります。
ポリープ状の病変は、通常、漿液性PEDの縁に位置しています(26)。
他の新生血管型AMDのサブタイプと比較して、臨床経過、予後、治療効果が異なるため、これらの病変の認識は非常に重要です。
OCTは、血管造影所見との正確な相関を可能にする画像を提供します。
OCTの断面図では、漿液性PEDは、光学的に空虚なドーム状の、外部の高反射帯であるRPEの隆起として現れ、Bruch膜から急峻に剥離しています(26)。
水疱性PEDの周囲にある網膜は、通常、水疱性PEDに接着していますが、病変の縁では、その下のRPEからわずかに剥離していることがあります。
血管性PEDでは、OCTによってさらに多くの情報を得ることができます(28)。
CNVに対応する領域のFAとICGAによって誘導された断層写真のセクションでは、RPEの滑らかな隆起が見られ、漿液の剥離と連続しており、線維血管組織の存在により深い後方散乱が見られます。
網膜内および網膜下の空間には、液体の蓄積に関連する均一な光学的空隙の低反射領域が頻繁に存在します(29)。
網膜内の光学的空隙は、漿液性PEDがType 3 NV、特に嚢胞状の形状を伴う場合に顕著になります(図4)。
「ホットスポット」に対応するスキャンラインを配置することにより、新生血管の異常は、外側の高反射層がもはや検出できない網膜内層の高密度または高反射の前上皮ゾーンとして表現されます(30)。
その病変に近いRPEは、その高反射層に頻繁にフラクションまたは中断を示します(31)。
漿液性のPEDやPCVを持つ眼では、ポリープ状病変はPEDに似たRPEの鋭い突出を示すが、急勾配である。
通常は光学的に空洞であるポリープの空洞は、不規則なRPEの隆起に隣接しており、病変の潜伏した新生血管成分を表現している(32,33)。
網膜下および網膜内の液体は、低蛍光の光学的に空の領域として観察され、PCVの活動に関連しています(図4-B)。
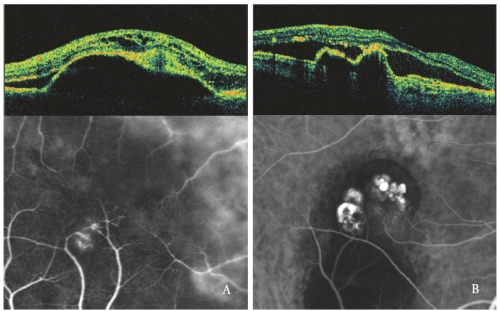
図4 – Type 3 NV(RAP)(左)およびPCV(右)。
最近、OCTアンギオグラフィ(OCT-A)が導入されたことにより、色素を注入することなく、内腔の流れを固有のコントラストとして利用することで、異なる網膜層の灌流を画像化することが可能になりました。
図5は、PCVの症例でOCT-Aがどのように脈絡膜ネットワークを画像化したかの例です。
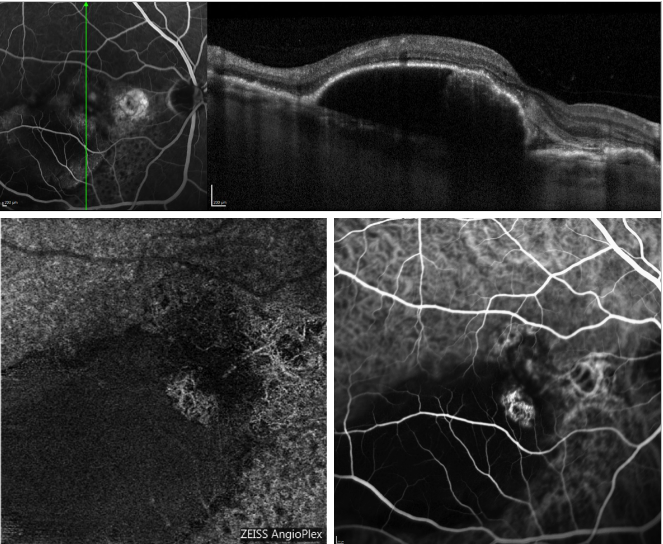
図5 – 漿液性PEDと再発したPCV(FA、OCT、ICGA、OCT-A)。
しかし、この検査の静的な性質と、起こりうるアーティファクトの存在は、認識すべき重要な限界です。
漿液性PEDに関しては、PEDに対応する信号伝達の損失によるシャドーイングにより、OCT-A上でCNV複合体を検出することが困難になる可能性があります(図6)。
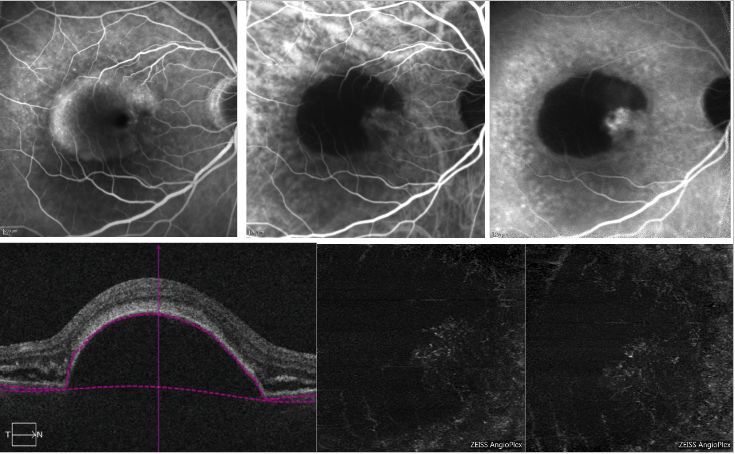
図6 – Type 1 NVを伴う血管性PEDおよび漿液性PED(FA、ICGAおよびOCT-A) 。
漿液性PEDの自然経過は、新生血管成分があるかないかで決まる(34)。
純粋な漿液性PEDでは、一般的に病変の拡大は緩やかで、視力低下の進行は数ヶ月から数年に渡って最小限である。
しかし、多くはその後に新生血管を形成し、悪化させることがある(35)。
血管化したPEDの自然経過は様々で、関連する新生血管のタイプに関係しています。
PEDの最も一般的な急性合併症はRPEの断裂です(36-39)。
これは通常、PEDの端、剥離したRPEと付着したRPEが交差する部分で起こる。
臨床的には、RPEの裂け目は剥き出しの脈絡膜の明確な領域として現れ、裂けたRPEの山に対応する暗い色素沈着したラゲート領域と連続している(40,41)。
引き裂かれたRPEは、通常、CNVに向かって転がり、その引き裂き傾向は、サイズの増加や形状の変化、PEDの縁に小さな穴があるなど、引き裂く前の特徴を観察することで予測することができます。 しかし、最も注目すべき点は、FAで見えるPEDの不規則な充填、PEDの高さ> 580 nm、持続時間> 4.
RPEの断裂は、自然に起こるものと、治療後に起こるものがあり、正式にはレーザー光凝固療法、光線力学療法、ステロイドや抗VEGF剤の硝子体内注射などが挙げられます(47-58)。
RPE断裂の正確な病因はよくわかっていません。
PEDの自然経過については、PEDにおける接線方向の剪断力が断裂端でのRPE基底膜の破壊を引き起こすという仮説がありますが、CNVの存在が主要な役割を果たしているいくつかの変数の結果である可能性が高いです。
治療後に発生したRPE断裂にはいくつかの因果関係が報告されており、光凝固による発熱、PED内液の急激な増加、関連するCNVの収縮、それに伴うRPE下液の急激な消失などが挙げられます。
硝子体黄斑牽引の複合的な存在や、針による機械的外傷によるグローブの変形も原因物質として報告されています(59)。
RPE裂孔後、大多数の患者は急激な視力低下を訴える。
ごく一部の眼では、裂孔が焦点を免れた場合、患者は一時的に良好な視機能を維持することができる(60)。
しかし、長期的には、網膜下の瘢痕が進行することにより、激しい視力低下を引き起こす。
CNVを伴うか否かにかかわらず、漿液性PEDの治療は常に課題であり、今のところ推奨される管理ガイドラインはない。
純粋な漿液性PEDは、過去にレーザーグリッドや散乱光凝固法で治療されてきましたが、残念な結果に終わりました(61)。
CNVを伴うか否かにかかわらず、漿液性PEDの治療は常に困難であり、これまでのところ、その管理のための推奨ガイドラインはありません。
純粋な漿液性PEDの治療は、過去にレーザーグリッドや散乱光凝固法で行われてきましたが、残念な結果でした(62)。
これらの病変に対する他のアプローチは試みられていません。
新血管網が存在する場合、漿液性PEDの治療はCNVの管理に焦点を当ててきました。
抗VEGF療法の時代になった今、これまで行われてきた治療はすべて満足のいくものではありません。
レーザー光凝固療法は広く採用されていますが、ICGAで明確に定義されたCNVが剥離したRPEから離れた場所にある場合には、まだ限定的な適応となる可能性があります(63)。
ベルテポルフィン光線力学療法(PDT)は、RPEの断裂、出血、急激な視力低下などのリスクがあり、有害であることが証明されています(39,48,49,64)(図7)。
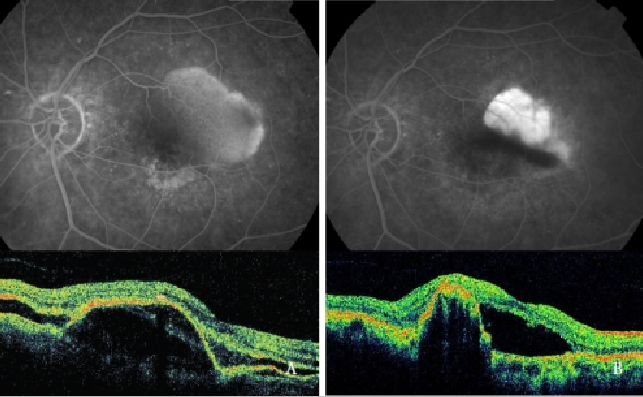
図7-PDT前(左)とPDT後(右)のCNV(Type 1 NV)を有する血管のあるPED。
しかし、PDTとトリアムシノロンアセトニド注射(IVTA)を併用することで、視力の安定化と再発の減少が期待できることが実証されています(65)。
しかし、白内障や緑内障などの合併症が多いため、トリアムシノロン注射の使用率は低くなっています。
Occult CNVの治療に抗VEGFの硝子体外用療法が用いられた後、抗VEGFの使用は血管のあるPEDにも拡大されましたが、残念な結果となりました(66-69)。
急性合併症と治療に対する解剖学的な反応の悪さの両方が、病変を治そうとする我々の試みをしばしば無効にします。
さらに、RPE下液が抗VEGF療法にほとんど反応しないのは、おそらくBruch膜の水伝導性の変化によるものと思われます(69)。
ベバシズマブ、ラニビズマブ、ペガプタニブ、PDT+IVTAでそれぞれ治療を受けた328人の患者を対象としたレトロスペクティブなケースシリーズでは、平均42.4週間のフォローアップ後、各グループで視力が有意に安定し、ベバシズマブとラニビズマブのグループでは他の2つのグループに比べて良好で、全体的なRPE断裂の頻度は12.5%と報告されています。
別のレトロスペクティブな研究(58)では、PDT単独、PDTとIVTAの併用、または抗VEGF注射(ベバシズマブまたはラニビズマブ)単独で治療した血管性PEDの患者の結果を検討し、抗VEGF治療群の方が機能的に良好であることを示しました。
さらに、このシリーズでは、血管のあるPEDを持つ1型NVは、3型NVと比較して、ベースラインでの視力が良いことに加えて、治療後に急性RPE断裂のリスクが高いことが示されました(58)。
最近の前向き研究(19)では、小窩裂溝下の1型NVに関連するPEDに対して、ラニビズマブの硝子体内注射を行い、3ヶ月ごとのローディングフェーズとpro re nata戦略による治療を行ったところ、24ヶ月間の追跡調査では部分的な結果しか得られませんでした。
最近、いくつかの研究で、AMDのPEDに対するAvitreal Aflibercept治療の有効性が検討され、視力の改善または有意な変化を伴わない良好な解剖学的反応が示されました(70-73)。
さらに、Avitreal Afliberceptは、Avitreal Ranibizumab治療に抵抗性のPEDに対する有望な治療法であることが示されました(72-74)。
いくつかの研究では、抗VEGF治療に対するPEDの反応に影響を与える可能性のある要因が特定されています(75-78)。
Diraniら(75)は、より良い視力の改善は、ベースラインの視力、網膜下液の存在、およびRAPの低下と関連していることを示しました。
Choら(76)は、最近のケースシリーズで、ベースラインでのPEDの高さ、PCVまたはRAPが典型的な新生血管性AMDと比較して低いこと、漿液性PEDが線維血管性PEDと比較して低いこと、アフリベルセプトがラニビズマブと比較して低いことが、PEDの抗VEGF治療中にPEDが解消される可能性が高いことを明らかにしました。
しかし、最近の第III相無作為化比較試験のpost hoc解析(77)では、抗VEGF治療開始後24ヵ月目に、ベースラインでPEDを呈していた患者の約半数が、PEDの状態やベースラインでの身長にかかわらず、PEDの完全な消失を示したことが示されています。
最近、Chenら(78)は、RAPを呈する眼は、1型NVを呈するPEDと比較して、より少ない注射回数で解剖学的および機能的に良好な結果が得られることから、RAPを呈する眼を区別することの重要性を概説しています。
将来的には、新しい併用療法や新しい治療戦略に加えて、治療に対する反応を示す新しい臨床バイオマーカーを特定することが、血管性PEDに罹患した患者の予後を改善するのに役立つと思われます。