学習目標
- 酸塩基指示薬の機能と色の変化を説明する
- 滴定実験に適切な指示薬を選択する方法を実演する
- 指示薬の酸性解離定数KaまたはKaiを決定する。
ある種の有機物質は、希薄な溶液中でヒドロニウムイオン濃度が特定の値に達すると色が変わります。 例えば、フェノールフタレインは、ヒドロニウムイオン濃度が5.0×10-9M(pH< 8.3)以上の水溶液では無色の物質です。 ヒドロニウムイオン濃度が5.0×10-9M(pH > 8.3)未満のより塩基性の水溶液では、赤やピンクになります。 フェノールフタレインのように、溶液のpHを知ることができる物質を酸塩基指示薬といいます。
弱酸性である酸塩基指示薬メチルオレンジの溶液中の平衡は、複雑なメチルオレンジ分子を単純に表現したHInを用いた式で表すことができます。0×10^{-4}]
メチルオレンジの陰イオンであるIn-は黄色で、非イオン化体であるHInは赤色である。 メチルオレンジの溶液に酸を加えると、ヒドロニウムイオンの濃度が上昇し、ル・シャトリエの原理により、非イオン化した赤い形に平衡が移動する。 また、塩基を加えると、黄色の形に平衡が変化する。
指示薬の色は、In-とHInの2つの種の濃度の比の結果として目に見えるものです。 インジケータの大部分(通常約60~90%以上)がIn-として存在する場合、In-イオンの色を見ることができ、これはメチルオレンジの場合は黄色になります。 大部分がHInとして存在する場合は、HIn分子の色を見ることができます(メチルオレンジの場合は赤)。 メチルオレンジの場合、Kaの式をアレンジして次のように書くことができます。 指標となる平衡を表す上記の式は、並べ替えることができます。
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:or:pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}]
最後の式は、Henderson-Hasselbalch式と同じで、指示薬の平衡状態を表すのに使用できます。
Kaと同じ数値を持つとき、toの比率は1になり、指示薬の50%が赤色の形態(HIn)、50%が黄色のイオン形態(In-)で存在し、溶液はオレンジ色に見えることを意味する。 ヒドロニウムイオンの濃度が8×10-4M(pH3.1)になると、溶液は赤色になる。 これ以上、ヒドロニウムイオン濃度を上げても(pHを下げても)色の変化は見られない。 ヒドロニウムイオン濃度が4×10-5M(pH4.4)では、指示薬の大部分が黄色のイオン形になっており、ヒドロニウムイオン濃度をさらに下げても(pHを上げても)目に見える色の変化はありません。
インジケーターには、監視する反応に応じてさまざまな物質を使用することができます。
指標となる物質には、反応に応じてさまざまなものがあります。例えば、赤キャベツの絞り汁には、pHが低いと濃い赤、中間のpHでは水色、高いpHでは黄色に変化する色のついた物質が含まれています(図 ˶ˆ꒳ˆ˵)。
- 色の変化がわかりやすいこと
- 色の変化が速いこと
- 指示薬の分子が滴定対象の物質と反応しないこと
- 。
- 誤差を最小限にするために、滴定の同値点で予想されるpHから1pH単位以内のpKinを持つこと

赤キャベツの汁には、pHによって色が変わる物質が混ざっています。 それぞれの試験管には、赤キャベツジュースを水に溶かした溶液が入っていますが、溶液のpHは、pH=2.0(左端)からpH=11.0(右端)まで変化しています。
これらの条件を満たし、ほぼすべてのpH領域をカバーする合成インジケーターが開発されている。
これらの条件を満たし、ほぼすべてのpH領域をカバーする合成インジケーターが開発されている。一般的なインジケーターが変色するおおよそのpH領域とその変色を図に示す。
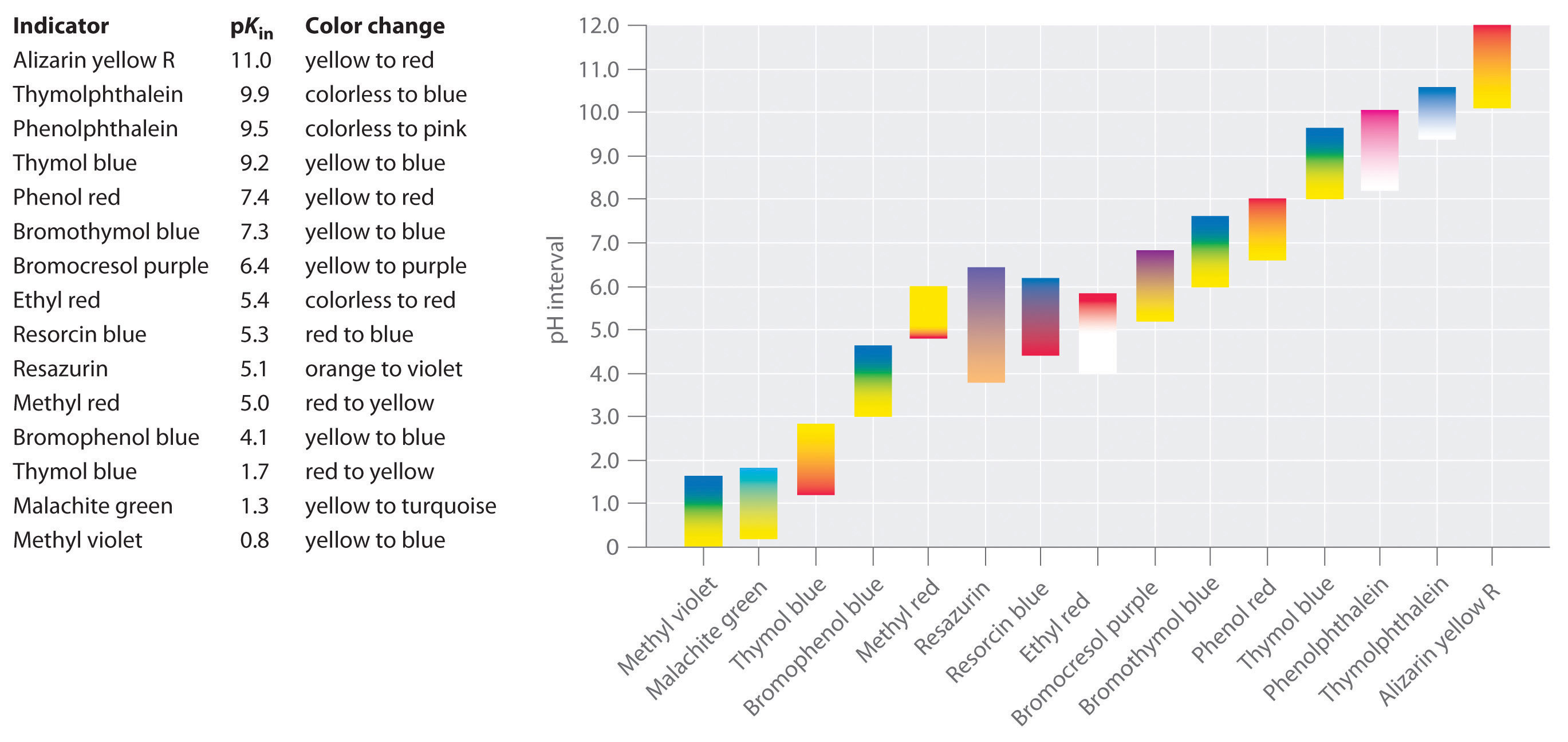
インジケータは、ある特定のpH値で急激に色が変わるのではなく、他の酸や塩基と同様にpH滴定を行うことを知っておくことが重要です。 HInの濃度が下がり、In-の濃度が上がると、溶液の色はHInの特徴的な色からIn-の特徴的な色へとゆっくりと変化していきます。 セクション16で説明するように、/の比率は、pKinより1ユニット低いpHでは0.1、pKinより1ユニット高いpHでは10に変化する。
優れた指示薬は、等価点で予想されるpHに近いpKin値を持つべきであると述べました。 強酸-強塩基滴定の場合、当量点付近でのpHの変化が非常に大きいため、指示薬の選択は特に重要ではありません。 一方、弱酸・弱塩基の滴定では、指示薬を間違えると、図のように比較的大きな誤差が生じます。 この図は,強酸(HCl)と弱酸(Acetic Acid)の0.100M溶液50.0mLを0.100MのNaOHで滴定したときの,pHと塩基の添加量の関係を示したものです。 また、一般的な指示薬であるメチルレッド(pK_{in} = 5.0\)とフェノールフタレイン(pK_{in} = 9.5‰)の変色するpH範囲を示しました。 横棒は両指標が変色するpH範囲を示しており,HClの滴定曲線とほぼ垂直に交わっていることがわかります。 したがって,両指示薬が発色するのは,ほぼ同量の\\を加えたとき(約50mL)であり,このときが当量点に相当します。 一方,酢酸の滴定では,指示薬にメチルレッドとフェノールフタレインのどちらを使うかによって,結果が大きく異なります。 フェノールフタレインが変色するpHの範囲は,強酸滴定の当量点のpHよりわずかに大きいですが,この部分の滴定曲線の傾きのために,誤差は無視できます。 塩酸滴定の場合と同様に、酢酸溶液に約50mLのNaOHを加えるとフェノールフタレイン指示薬はピンク色になります。 一方、メチルレッドはpH5付近で赤色から黄色に変化し始めますが、これは酢酸の滴定の中間点付近であり、当量点ではありません。
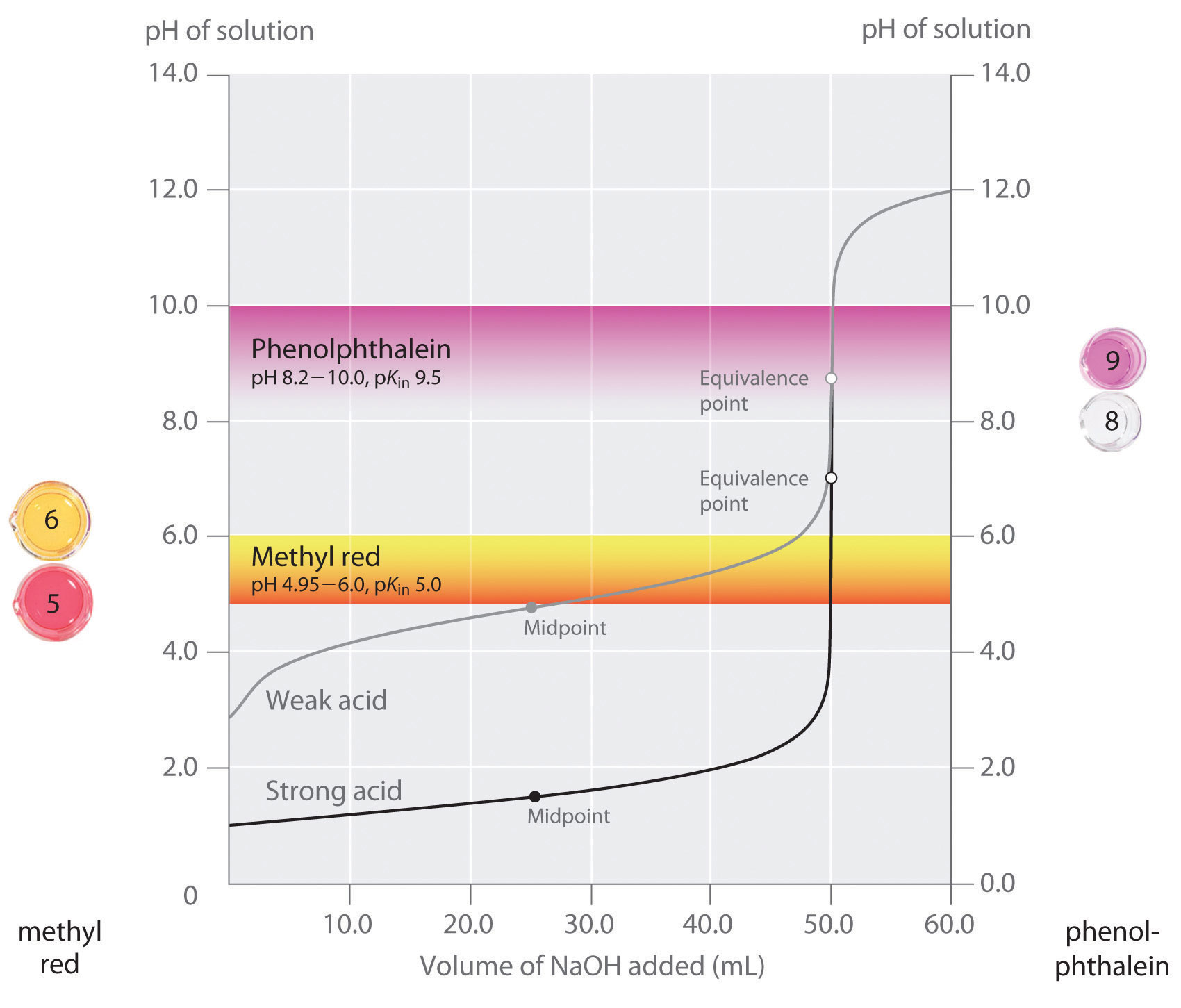
このグラフは、強酸(HCl)と弱酸(acetic acid)の0.100M溶液と0.100MのNaOH\の滴定において、2種類の指示薬(メチルレッドとフェノールフタレイン)を用いて得られた結果です。 強酸の滴定曲線は当量点付近で急峻に変化するため,強酸の滴定ではどちらの指示薬も当量点で急速に変色します。
一般に、強酸と強塩基の滴定(またはその逆)では、pKが約4.0~10.0の指示薬であれば何でも構いません。 しかし、弱酸の滴定では、当量点のpHが7.0以上なので、フェノールフタレインやチモールブルーなど、pKが>7.0の指示薬を使用します。 逆に、弱塩基の滴定では、当量点のpHが7.0未満の場合は、メチルレッドやブロモクレゾールブルーなどのpKin < 7.0の指示薬を使用します。
Example ˶‾᷄ -̫ ‾᷅˵
弱酸と強塩基の滴定において、どの指示薬を用いるのがよいでしょうか。
- Methyl Orange
- Bromocresol Green
- Phenolphtalein
Solution
正解はCです。 弱酸と強塩基の滴定では、弱酸の共役塩基が当量点のpHを7以上にするので、そのpH範囲で変化する指示薬が欲しいところです。
色やpKin値の異なる多くの指示薬が存在することは、高価な電子式pHメーターや壊れやすいpH電極を使わずに、溶液のpHを推定する便利な方法でもあります。 紙やプラスチックに指示薬の組み合わせを染み込ませたものを「pH紙」といい、pH紙を溶液に浸して、容器に印刷された基準値と色を比較するだけで、溶液のpHを推定することができます(図㊨)。
概要
酸塩基性指示薬とは、特定のpHで色が変わる化合物です。
貢献者と帰属
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. OpenStax Collegeが制作した教科書コンテンツは、Creative Commons Attribution License 4.0ライセンスで提供されています。 http://cnx.org/contents/85abf193-2bd…[email protected]で無料でダウンロードできます。
- {template.ContribBoundless()}}