水素結合は、非常に電気陰性の窒素原子のローン・ペアと、他の分子のわずかに陽性の水素原子との間に形成されます。
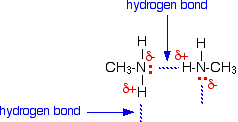
ローンペアが不足しているため、水素結合は、例えば水のように効率的ではありません。 わずかにプラスの水素原子は、水素結合するためのローンペアを見つけることができません。
大きな分子間のファンデルワールス分散力が大きくなるため、第一級アミンの沸点は鎖長が長くなるにつれて高くなります。
第二級アミン
公正な比較のためには、ジメチルアミンの沸点とエチルアミンの沸点を比較しなければなりません。
第二級アミンの沸点は、同じ数の炭素原子を持つ対応する第一級アミンよりも少し低いのですが、これらは互いに異性体です。
第二級アミンは依然として水素結合を形成しますが、窒素原子が鎖の末端ではなく中央にあることで、分子の永久双極子がわずかに少なくなります。
沸点が低くなるのは、ジメチルアミンの双極子-双極子アトラクションがエチルアミンに比べて低いことによります。
第三級アミン
今回、公平な比較をするためには、トリメチルアミンとその異性体である1-アミノプロパンを比較しなければなりません。
このページの上の方にある表を見ると、トリメチルアミンの沸点は、1-アミノプロパンの沸点(48.6℃)よりもずっと低い(3.5℃)ことがわかります。
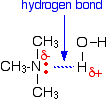
3級アミンでは、窒素に直接結合している水素原子がないため、3級アミン分子間の水素結合は不可能です。
水への溶解性
すべてのタイプの小さなアミンは、水に非常によく溶けます。
すべてのアミンは、水と水素結合を形成することができます。
3級アミンは、窒素に水素原子が結合していないため、それ自体とは水素結合を形成できませんが、窒素上のローンペアを利用するだけで、水分子と水素結合を形成することができます。
溶解性は、炭化水素鎖が長くなるにつれて低下し、炭素数が約6になると顕著になります。
炭化水素鎖は、水分子の間に無理やり入り込み、水分子間の水素結合を破壊しなければなりません。
しかし、水素結合をそれほど強力なものに置き換えることはできないため、溶液を形成するプロセスは、鎖の長さが長くなるにつれて、エネルギー的に実現しにくくなります。
匂い
メチルアミンやエチルアミンのような非常に小さなアミンは、アンモニアと非常によく似た匂いがしますが、両者を並べて比較すると、アミンの匂いはやや複雑です。
アミンが大きくなると、より「生臭い」、あるいは「腐敗臭」を感じる傾向があります。
サンザシの花の香り(コトネアスターの花のような似たような香りのものもあります)に慣れ親しんでいる方は、これがトリメチルアミンの香りで、甘くて、どちらかというと腐敗した肉の初期段階のような病的な香りです。
理解度を確認するための質問
これが初めての質問の場合は、始める前に入門ページを読んでください。
アミンの紹介に関する質問
回答
今、どこに行きたいですか?
アミンのメニューへ . . .
その他の有機化合物のメニューへ . .
メインメニューへ . . .