はじめに
慢性心不全(CHF)は、入院、院内死亡、医療費支出の主な原因のひとつです1,2。 様々なタイプの病院や臨床部門(三次病院、地域病院、循環器科、内科)がこの問題を抱えた患者を受け入れており、そのうちの約30~50%は左心室収縮機能が保たれているとされている。
左心室収縮機能が保たれているCHFの外来患者を主に対象とした研究では、末期腎不全が独立して有意に死亡率の増加と関連していることが明らかになりました13。 CHF患者における腎不全と死亡率の独立した関連性を分析する際には、腎不全は死亡率を高める可能性のある他の心血管危険因子(例えば、糖尿病や高血圧)の有病率の増加と関連していることを忘れてはならない18
我々の知る限りでは、逆流性CHFで入院した患者、特に左心室収縮機能が保たれている患者における腎不全と死亡率の関係は分析されていない。
本研究の目的は、大学病院の循環器科でCHFのために入院した患者の前向き登録を利用して、左室収縮機能が維持されている場合と低下している場合に、腎不全が死亡率の予測因子となるかどうかを調べることである。 さらに、腎不全の程度が異なる心血管リスクプロファイルと関連しているかどうかを判断するための分析を行った。
対象者と方法
試験対象者、選択基準、定義
2000年1月1日から2002年12月31日までの間に、修正フラミンガム基準(主要基準。 2000年1月1日から2002年12月31日の間に、スペイン北西部の三次病院の循環器科に、修正フラミンガム基準(主要基準:発作性夜間呼吸困難、起立性呼吸、肺パチパチ音、頸静脈怒張、第三心音、肺うっ血のX線徴候、心肥大、副基準:運動性呼吸困難、末梢性浮腫、肝腫大、胸水)で定義されたCHF患者630人が入院した。 この診断は、少なくとも2つの主要基準、または1つの主要基準+2つのマイナー基準を満たした場合に達しました。 再入院した患者は除外し、研究期間中にいずれかの患者が最初に入院したときのデータのみを考慮に入れました。 また、対象となる患者は、入院時(他の診断検査や治療決定が行われる前)に血液検査を受けて血清クレアチニン濃度を測定している必要がありました。
腎機能を表す数値として、糸球体濾過率(GFR)を用いました。 GFRはModification of Diet in Renal Disease studyで提案された式(186×血清Cr-1.154×年齢-0,203×1.210×0.742)を用いて推定された21。 > 60, 30-60, r=0.84; P
GFRの予後への影響を、全患者と、左心室収縮機能が維持されているサブグループおよび低下しているサブグループに分けて分析した。 後者のサブグループに属する患者の分類は、左心室駆出率に基づいて行われた。 左室駆出率は469名の患者において、50%をカットオフ値とした修正シンプソン法を用いて心エコーで測定された。
分析された変数
以下の変数が記録された:人口統計学的な心血管危険因子、CHFの病因、臨床状態、補完的な検査(胸部X線、心電図、血液分析)の結果、退院時に処方された治療法。 研究対象となる患者の選択とデータの収集は、CHFの治療に十分な経験を持つ2人の心臓専門医が担当しました。 臨床データは、研究期間中、前向きに収集されました。
26人の患者の最終的な状態に関する信頼できるデータは入手できませんでした。
統計解析
分類的または二分的な変数はパーセンテージで表し、χ²またはFisher正確検定を用いて比較した。 連続変数は平均値±標準偏差(SD)で表し、異なるグループ間の比較にはStudent tテストを用いた。 生存曲線は,Kaplan-Meier法を用いて作成した。 患者全体と2つのサブグループ(左室収縮機能が維持されている群と低下している群)についてプロットし、腎不全の程度と生存率の関係を明らかにし、GFRの四分位数に応じた患者の生存率を明らかにした。 生存率の差を比較するために、log rank testを使用しました。
多変量解析は、Cox比例ハザードモデル(2ステップ)を用いて行いました。 第1段階では、単変量解析で有意なすべての変数を導入し(全患者群と2つのサブグループに分けて解析)、条件付き前進法を用いた。 第2段階では、第1段階で有意であった変数を導入した。 得られた回帰係数を用いて相対リスクを推定した。 比例リスクモデルの妥当性は、導入した各共変量のlog-log関数を計算することで裏付けられた。 有意性はPとした。
結果
全体の臨床的特徴
本研究の552名の患者の平均年齢は71.5歳であった。 男性が58.7%を占め、49%が虚血性心疾患、63%が高血圧であった。 大半(69%)が入院時にNYHAクラスIII/IVに分類され、56%が収縮機能の低下を示した。 平均GFRは66.9±30.4mL/min/m²でした(図1)。 重度の腎不全(GFR60mL/min/1.73m²(無/軽度の腎不全))
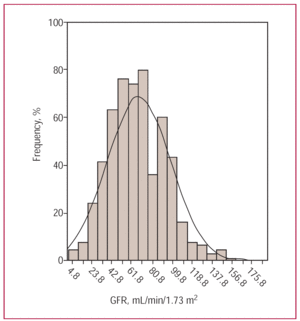
図1. 研究対象者における糸球体濾過率(GFR)の違いを示す頻度ヒストグラム
退院時には、63%の患者にアンジオテンシン変換酵素(ACE)阻害剤が処方され、42%にβ遮断薬が処方され、16%にスピロノラクトンが処方されました。 表1に分析したすべての変数を示します。

腎不全の程度が異なる患者の特徴的な臨床的特徴
重度の腎不全患者(GFR
生存率
腎不全が患者全体の予後に与える影響
平均フォローアップ期間は1.フォローアップ期間は1.4±0.9年で、526人の患者(95.3%)が可能であった。 重度の腎不全(GFR60mL/min/1.73m²)の患者は23名(53.5%)であった。 入院中に死亡したのは12名(合計)で、この死亡率は、重度の腎不全患者では中等度の腎不全患者の50.0%に対して41.7%、軽度の腎不全患者では8.3%と、重度の腎不全患者の方が軽度の腎不全患者よりも5倍高かった。 Kaplan-Meier解析では、重度腎不全患者の死亡率が顕著に高かった(平均生存期間、1.34年、95%信頼区間、0.99〜1.68年)(図2)。 中等度の腎不全患者の予後は、無/軽度の腎不全患者よりも悪かったが(平均生存期間、2.45年、95%信頼区間、2.26〜2.63年、対して2.76年、95%信頼区間、2.64〜2.89年)、その差は重度の腎不全患者と無/軽度の腎不全患者の間では、はるかに小さかった。 1年後の追跡調査では、GFRの第1~3四分位群で生存率が漸増した(それぞれ72.2%、82.4%、90.8%)。
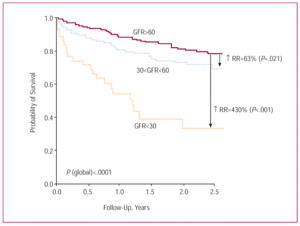
図2. 重度、中等度、無/軽度の腎不全患者のKaplan-Meier生存曲線。 GFRは糸球体濾過率,RRは相対リスクを示す。
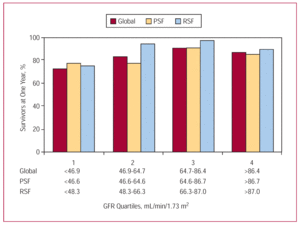
図3.
単変量解析で長期生存率に有意に関連する他の変数とは別に、重度腎不全の影響は多変量Coxモデルで確認され、最大相対リスク(RR)は2.36(95%CI、1.26-4.42)であった。 一方、中等度の腎不全は長期生存率と有意に関連していなかった。 死亡率の上昇に関連する他の独立変数は、年齢と貧血でした。 ACE阻害剤による治療は保護的であった(表2)。

腎不全が予後に及ぼす影響におけるACE阻害剤の役割
退院時にACE阻害剤を処方された患者と処方されなかった患者では、重度腎不全が生存率に及ぼす影響に差が見られた。 処方された患者では、腎不全と生存率との有意な関係が消失した(P=.309)。 それに対して 重度の腎不全が生存率に及ぼす悪影響は、ACE阻害剤を処方されていない患者では有意に大きかった(P)

腎不全が患者の予後に及ぼす影響について
腎不全は両サブグループ(左心室収縮機能が維持されている患者と低下している患者)に非常に多く見られました(図4)。 図4)。 重度の腎不全の患者の割合は比較的少ないが(収縮機能維持患者の10%、機能低下患者の6%)、生存率に最も強いマイナスの影響を与える変数であり、特に収縮機能低下患者ではその傾向が顕著であった(図5)。 保存」サブグループでは、生存期間は、腎不全がない/軽度の患者の2.75年(95%CI、2.56〜2.95年)から、重度の腎不全患者の1.66年(95%CI、1.16〜2.17年)に短縮された。 また、「減少」サブグループでは、生存期間が、腎機能正常者の2.83年(95%CI、2.66~3.00年)から、重度腎不全者の1.17年(95%CI、0.66~1.67年)に短縮された。 GFRの四分位と生存期間に関しては、患者全体と2つのサブグループ(左室収縮機能が維持されている人と低下している人)の結果の傾向は同様で、最初の3つの四分位では改善し、GFRの値が>87mL/min/1.73 m²(図3)
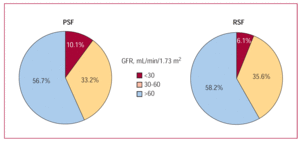
図4. 保存(PSF)および左心室機能低下(RSF)サブグループにおける腎不全の程度が異なる患者の割合.
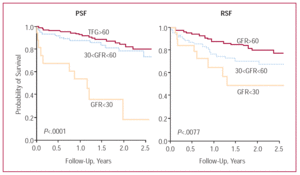
図5. 左心室収縮機能維持(PSF)および低下(RSF)サブグループにおける重度、中等度、および腎不全なし/軽度のうっ血性心不全患者のKaplan-Meier生存曲線。
重度の腎不全が予後に与える影響は強力で、他の変数とは独立しており、収縮機能維持群と収縮機能低下群の両方で生存率と有意に関連していました(表4)。

考察
今回の結果は、CHFで入院した患者において、腎不全が死亡率と独立して関連していることを示している。 この関連性は、左心室収縮機能が維持されている患者と低下している患者の両方で見られた。 この関連性は、年齢、糖尿病の有無、血圧、その他の死亡率の危険因子とは無関係であった。 死亡率との独立した関連性が認められたすべての因子のうち、特に収縮機能低下サブグループに属する患者では、腎不全が最も重要であった。 このことは、CHF患者では心血管疾患と腎疾患が並行して進行していることを示している。 Ezekowitzら22は最近、CHFと虚血性心疾患を持つ患者には腎不全が非常に多く見られ、この共存がより進んだ冠動脈硬化と関連していると述べている。
今回の結果は、左室収縮機能が維持されているかどうかにかかわらず、CHFにより入院した患者の死亡率の強力な危険因子としての腎不全の重要性を強調するものである。
いくつかの論文では、さまざまなタイプの臨床的な心血管疾患を持つ患者の腎機能の低下と予後の関連性が報告されています13-17,23-25。 このような悪化は、高血圧、糖尿病、虚血性心疾患(特に)、CHFを有する患者において、心血管合併症や死亡のリスクを高めることと関連しています。26-33年に行われたVALIANT試験(心筋梗塞後の心室機能障害とCHFを有する患者)では、腎機能の悪化が死亡率と心血管合併症の有意な増加と関連していることが明らかになりました。 このリスクの増加は、患者の予後に影響を与える他の変数とは無関係であった26。最近、SAVE試験(心筋梗塞後の心室機能障害を有する患者)の結果を解析したところ、同様の結果が得られ、腎不全を併発した患者ではカプトプリルによる治療が特に重要であることが示された27。
中等度の腎不全とCHFを有する外来患者における死亡リスクの増加はよく知られており、特に左心室収縮機能障害が低下している患者において顕著である。14-17 これを説明するためにいくつかのメカニズムが提案されている。 腎不全は、より進行したCHFのマーカーであるかもしれないし、他の心血管危険因子のより高い有病率と関連しているかもしれないし、予後に良い影響を与えることが知られている薬剤(ACE阻害剤など)の使用が制限されるかもしれない34,35。本研究では、収縮機能が維持されているサブグループと低下しているサブグループの両方で、CHFの重症度マーカーと他の危険因子を調整した後、腎不全も死亡率の独立した予測因子であることがわかった。 腎不全とCHFの間には双方向の関係があるのかもしれません。つまり、前者は後者の進行を加速させ、後者は前者の出現に影響を与えるのかもしれません36
今回の結果は、腎不全がより進行した患者が心血管リスクプロファイルを悪化させたことから、ある程度そのような関係を示唆しています。
上述したように、死亡率と腎不全の関連性は、収縮機能が維持されているサブグループと低下しているサブグループの両方の患者で認められました。 左心室収縮機能が保たれているCHFの生理病理を念頭に置くと、CHFと腎不全の両方の病因は同じであり、心血管疾患と腎疾患の並行した進行を反映している可能性があります。 現在、左心室収縮機能が保たれているCHFに対する最も適切な治療法を決定するために、いくつかの臨床試験が行われています。
腎不全とCHF患者の予後との間に重要な関係があることから、臨床評価とフォローアップ戦略の一環として、少なくともGFRという観点から腎機能を評価することが賢明であると考えています。 腎不全があれば、治療可能な原因を探す必要があり、ACE阻害薬やβ遮断薬などの有効性が知られている薬剤を使用する必要があります。 14,15,22,27 ある研究では、ACE阻害薬が女性患者の死亡率を有意に低下させることが示された。 同様に、6427人の患者を対象とした研究では、22 ACE阻害薬とβ遮断薬がCHFと腎不全の患者の予後を有意に改善した。
今回の研究では、患者の予後に独立して影響を与える他の要因も明らかになった。 貧血の存在とCHFとの間には非常に強い関連性が認められ、貧血は患者の予後に負の(そして有意な)影響を与えると思われる37。生理学的な観点からは、CHF患者における貧血と腎不全との関連性を説明できるメカニズムがいくつかあり、実際、腎不全は貧血の発症要因となりうる34。
結論
腎不全は、左室収縮機能が維持されているか低下しているかにかかわらず、CHFで入院している患者の死亡率の強力な予測因子である。 今回の患者では、腎不全は心血管リスクプロファイルの悪化と関連しており、CHFでは心血管疾患と腎疾患が共に進行することが示唆された。
CHF患者の臨床検査に腎機能の評価を加えることが推奨されます。
CHFと腎不全の関連性を正当化するメカニズムを明らかにし、左心室収縮機能が低下した患者だけでなく、特に左心室収縮機能が維持された患者においても、最善の治療戦略を決定するためには、さらなる実験的・臨床的研究が必要である。