Case Report
Manage of Proliferative Endometrium on Biopsy in Post-Menopausal Women
Sidharth Srinivas1, Sachchidananda Maiti2, Perunkulam Jothilakshmi2
1Manchester Medical School, University of Manchester, Manchester, United Kingdom
2Obstetrics & Gynaecology, The Pennine Acute NHS Hospitals, Crumpsall, United Kingdom
Email address:
 (S. Srinivas)
(S. Srinivas)To cite this article:
Sidharth Srinivas, Sachchidananda Maiti, Perunkulam Jothilakshmi.
Sidharth Srinivas, Sachchidananda Maiti, Perunkulam Jothilakshmi, 閉経後の女性におけるProliferative Endometrium on Biopsyの管理。 Journal of Gynecology and Obstetrics(婦人科・産科学ジャーナル)。 Vol.4, No.6, 2016, pp.38-43. doi: 10.11648/j.jgo.20160406.12
Received: September 4, 2016; Accepted: September 21, 2016; Published: 2016年10月15日
概要:閉経後の出血(PMB)は、通常、いくつかの子宮内膜の状態(過形成および癌)によって引き起こされ、それに対するエビデンスに基づく治療法がある。 しかし、PMBを発症した女性のピペル子宮内膜生検で異型性を伴わない増殖性子宮内膜が認められた場合の文献は少なく、エビデンスに基づく治療法もない。 我々の目的は、このような女性の管理と治療法の選択肢を探ることである。 本研究は、英国マンチェスターの地方総合病院の婦人科迅速アクセスクリニックにPMBを来院した女性を対象に、3週間にわたって行われたレトロスペクティブな観察的ケースシリーズレビューである。 子宮内膜パイペル生検で増殖性または分泌性の子宮内膜が認められた女性4人を選んだ。 彼らの病歴、診察所見、検査、治療、追跡調査の結果を分析した。 このケースシリーズでは、子宮内膜サンプリングで異型を認めない増殖性子宮内膜を有する患者が抱える管理上のジレンマが明らかになった。 この4人の患者は、婦人科専門病棟に来院してから6週間後にピペル式子宮内膜生検を繰り返してフォローアップされた。 その後、カウンセリングを受けるか、6~8週間の経口プロゲステロン療法を受けました。 管理オプションには、ミレーナ子宮内システム(IUS)、経口プロゲステロン療法、プライマリーケアへの退院が含まれていました。 経口プロゲステロンの重要性や、このような患者群における子宮内膜増殖症やがんの発生を監視するために必要なフォローアップ期間については、コンセンサスが得られていない。 PMB女性の増殖性子宮内膜に対するエビデンスに基づく管理ガイドラインを作成するためには、さらなる研究が必要である。
キーワード 閉経後出血、異型性のない増殖性子宮内膜、プロゲステロン療法
1. はじめに
閉経後の出血は、婦人科診療所において重要かつ一般的な症状です。 英国で最も多い婦人科悪性腫瘍である子宮内膜がんを除外するためには、緊急の検査が必要です。 萎縮性膣炎、ポリープ、子宮筋腫などの良性の原因も、患者さんに大きなストレスを与える可能性があります。 組織学的に子宮内膜増殖症と診断された場合、悪性腫瘍のリスクが高まり、退縮させるための治療が必要となります。
本報告では、検査で組織学的に増殖性子宮内膜が認められたPMBの4症例を分析した。 このケースシリーズが興味深いのは、PMBの症状を呈する閉経後女性の増殖性子宮内膜に関する文献的証拠が乏しく、その結果、証拠に基づく治療法がないためである。
方法
本研究は、2014年11月にマンチェスターの地方総合病院の婦人科rapid access clinic(RAC)に3週間かけてPMBを呈示した女性を対象とした、レトロスペクティブな観察的ケースシリーズである。 Pipelleデバイスを用いた子宮内膜サンプリングで増殖性または分泌性の子宮内膜が認められた4名の患者を無作為に選んだ。 このケースシリーズの閉経後の女性は、全員が少なくとも1回の出血を経験した後、二次医療に緊急に紹介された。 このケースシリーズでは、自然な閉経を迎えたすべての年齢の女性が対象となっている。 ケースノートを用いて、各患者の病歴、検査所見、調査、治療、フォローアップを分析した。
2. ケースシリーズ
表1. 患者の病歴の関連する側面
| 患者 | &td | 紹介の理由 | 付随する症状 | 過去の病歴 | 避妊の有無。 HRT & タモキシフェンの状態 | 子宮頸部塗抹標本の履歴 |
| 1 | 54, ポスト | 無し | 無し | & up-to-datetd | ||
| 2 | 59, | 10日間の血栓を伴う重い膣の出血 | 下腹部の不快感と体重減少 | 2型糖尿病。 高血圧、胆石症 | GPが出血のためにNorethisteroneを開始 | & up-and-date |
| 3 | 52, 閉経後1年 | プライマリーケアでの超音波検査で不規則に厚い子宮内膜 | 塊や浸水を伴う間欠的な出血 | 乳がんです。 | Mirena IUSとTamoxifenを1年前に使用 | & up-to-date |
| 4 | 59, 閉経後 | 8日間の連続した軽い膣出血 | 軽度の腹痛 | 高血圧症。 甲状腺機能亢進症 | Nil | Unknown |
表2. 調査結果と治療法。
| 患者 | & TVUS | ピペール生検 | リピート ピペルバイオプシー | 治療 | フォローアップの期間 | ||
| 1 | & 1.3mm | 異型性や悪性度のない増殖性子宮内膜 | 。 | MDPA 100mgのBDを6~8週間使用 | 6週間 | ||
| td | &10mm | 異型性や悪性度のない秘密の子宮内膜 | Mirena IUSカウンセリング | 6週間 | |||
| 3 | & 2mm | 異型性や悪性度のない増殖性の子宮内膜 | 異型性や悪性度のない増殖性の子宮内膜。 | ||||
| Nil | 8 weeks | ||||||
| 4 | &10mm | 異型性や悪性度のない増殖性の子宮内膜 | MDPA 100mgBDを6~8週間投与 | 8週間 |
3. 考察
3.1. 更年期における子宮内膜の変化
子宮内膜が萎縮して機能層を失い、子宮内膜間質が繊維状になり、腺が増殖も分泌もしない状態が、閉経後の子宮内膜の一般的な姿です。 このような子宮内膜の退行は、月経の停止と一致しているため、出血があった場合には病的なものを除外しなければなりません。 閉経後の子宮内膜の生理機能と骨盤内病理におけるその役割は、ここ数十年、特に子宮内膜癌の前駆体に注目が集まっている。
全体的な研究では、閉経後の女性の4分の3は、様々な程度の拡張した嚢胞腺を伴う萎縮した子宮内膜であることが示されています。 さらに15%は、嚢胞腺からなる子宮内膜ポリープを持っています。 残りの10%は、増殖や過形成を示す子宮内膜です。 子宮内膜の萎縮は閉経1年目に見られ、その発生率は閉経まで一定です。
1954年、McBrideは閉経後の子宮内膜を分析する大規模な研究を行いました。 その結果、1,315例では粘液以外の物質はほとんど得られず、残りの206例では、萎縮、単発またはびまん性の嚢胞腺、過形成、増殖、分泌性ポリープ、線維性腺腫性ポリープといった子宮内膜のパターンが見られた。 この結果から、増殖性または分泌性子宮内膜の発生率は6.3%であることが示唆された。 しかし、著者は、サンプルが得られなかった場合、子宮内膜は不活性または萎縮していると提案している。 この仮定の下では、増殖性または分泌性の子宮内膜の発生率は0.8%である。
継続的にHRTを受けている閉経前後の女性の子宮内膜生検を調査した研究では、大部分の子宮内膜が萎縮性(68.7%)または増殖性(23.5%)であることがわかりました。 また、0.6%が異型性のない単純過形成、0.5%が分泌性子宮内膜で、0.07%に高分化型腺癌が認められました。 このことは、ホルモン刺激を受けている閉経後の女性は、増殖性子宮内膜の発生率が高いことを示唆しています。
3.2. 閉経後の出血の原因
閉経後の出血とは、閉経後の女性の膣からの出血で、ホルモン補充療法を連続して行った場合に起こる周期的な出血ではないものを指します。 PMBは、これらの患者の10%が子宮内膜がんであるため、緊急に婦人科に紹介する必要があります。 子宮内膜癌の早期診断は、局所および悪性腫瘍の拡大を抑えるために重要であり、最大90%の生存率を得ることができます。 子宮内膜がんは、早期にPMBを呈することが多いですが、萎縮性膣炎やポリープや子宮筋腫などの良性病変もよく見られます。 ある研究によると、PMBの症例の最大30%に、基礎となる解剖学的な異常が見られます(表3参照)。
表3. 閉経後出血の解剖学的原因。
| 子宮内膜 | td 膣 | 卵巣 |
| 線維腫 | ポリープ | 癌 |
| 過形成 | 癌 | |
| ポリープ | ||
| がん | ||
| 子宮内膜炎 |
3.3. 閉経後出血の調査
米国国立医療技術評価機構(NICE)のガイドラインに従い、今回のケースシリーズでは、PMBを呈し、HRTを受けていない3人の患者が、がんを除外するために二次医療機関に紹介されました。
HRTによる治療を受けている患者は、正常な周期的出血と不規則な出血の区別が難しいため、より複雑です。 HRT開始時の子宮出血や点状出血は一般的ですが、6ヶ月後には止まるはずです。
Scottish Intercollegiate Guidelines Network (SIGN)は、PMBの調査のためのアルゴリズムを提供している(表4参照)。
SIGN(Scottish Intercolgian Guidelines Network)は、PMBの調査アルゴリズムを提示している(表4参照)。これらのガイドラインに沿って、4人の患者はすべて、子宮頸部外反症やポリープなどの良性の出血原因がないか、あるいは悪性腫瘍の疑いがないかを調べるために、骨盤検査を受けた。 慢性的な無排卵、肥満、糖尿病、エストロゲンやタモキシフェンの使用、遺伝的症候群などの子宮内膜がんの危険因子を特定するためには、十分な病歴が必要です。 さらに、経験豊富な臨床医は、検鏡検査によって外陰部、膣部、子宮頸部の病変を診断することができる。
SIGNで推奨されているように、TVUSは、我々のケースシリーズでPMBを呈する女性に使用される第一選択の検査であった。
SIGNで推奨されているように、TVUSはPMBを呈した女性の第一選択の検査として用いられました。 子宮内膜が厚くなると、悪性腫瘍などの病理学的リスクが高まるため、さらなる調査が必要である。 一方、子宮内膜が薄い女性は、安心して、出血が続く場合にのみ再検査を受けることができます。 子宮内膜の厚さのカットオフ値を設定することは、すべての悪性疾患を発見する必要性と資源の過剰使用を最小限に抑えることのバランスをとることである。 カットオフ値を3mmに設定すると、高い感度(100%)が得られるが、検査の特異度(25.8%)が低下し、結果的に多くの患者が検査を受けることになる。
他にも、経膣ドップラー、三次元、生理食塩水強化、子宮内膜テクスチャの測定、マージン分析などの超音波検査法があります。
子宮内膜組織の直接観察とサンプリングは、このような患者のコホートにおけるゴールドスタンダードであり、セカンドラインの調査と考えられています。 現在の臨床現場やSIGNガイドラインでは、子宮内膜がんのリスクが高いと考えられる患者をさらに詳しく調べるために、子宮内膜生検装置の使用が推奨されています。 従来、異常出血の調査には、拡張術&掻爬術が用いられていましたが、現在では、私のケースシリーズの4人の患者全員に使用されたPipelle装置などの子宮内膜サンプリング装置の使用を支持する証拠があります。 この装置は、閉経後の女性における子宮内膜がんの検出率が99.6%であり、異型過形成の検出においても高い感度(81%)と特異性(98%)を有しています。
タモキシフェンによる治療を受けている患者は、子宮内膜がんの発生率が3~6倍高く、このような女性がPMBを訴えた場合、NICEは緊急に紹介することを推奨しています。 タモキシフェンの弱いエストロゲン作用による癌や増殖のリスクは、投与量や投与期間の増加とともに上昇することが示されています。 我々のケースシリーズの患者3は、タモキシフェンを投与されている59歳の女性で、TVUSとピペル生検に加えて、子宮鏡検査によってより広範囲な調査が行われました。 これは、タモキシフェンを服用している患者では、子宮内膜が厚くなっているために超音波検査の解釈が難しくなることから、TVUSよりも生検を伴う子宮鏡検査を行うことが望ましいとするガイドラインに沿ったものです。 閉経後の出血を呈する女性(タモキシフェンを服用していない).
3.4. 子宮内膜増殖症
子宮内膜増殖症(EH)の診断は、PMBを呈する女性の約10%に行われます。 世界保健機関(WHO)は、子宮内膜増殖症を単純型と複雑型に分類しており、それぞれの型は核異型性の有無でさらに分類されている。 子宮内膜生検で異型性(図2参照)が認められた女性は、約50%が子宮内膜がんを併発しているため、さらなる調査が必要である。 また、異型性がある場合には、がんに進展するリスクが高くなるが(診断後9年で27.5%)、異型性のない過形成の場合にははるかに低い(診断後9年で4.6%)。 将来の悪性腫瘍の可能性を考慮すると、異型性を伴うEHを有する閉経後の女性には、両側サルピンゴ・卵巣摘出を伴う子宮摘出術が推奨されます。 異型細胞がない場合、女性はプロゲスチンで管理することができ、治療への反応を確認するために6ヵ月ごとに連続して生検を行います。 一般的に使用されるプロゲスチンは、酢酸メゲストロールと酢酸メドロキシプロゲステロンです。
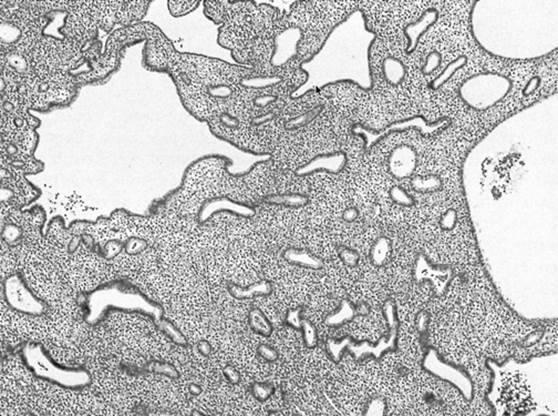
図1. 単純な子宮内膜過形成を示す子宮内膜生検で、子宮内膜腺が不規則に分布し、過形成間質によって広く分離されている。
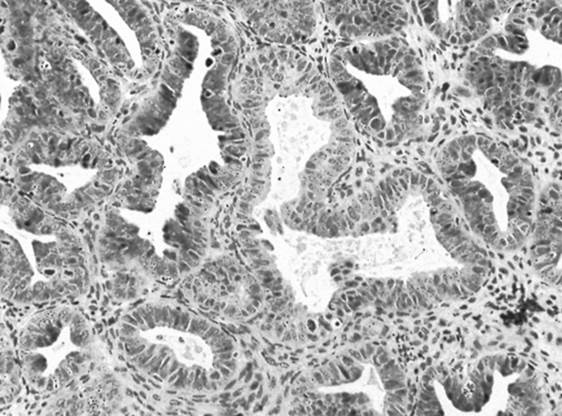
図2. 異型腺細胞を伴う子宮内膜過形成を示す子宮内膜生検 .
3.5. 増殖性子宮内膜の病因
私の報告では、閉経後の女性の生検が、生殖能力のある女性の毎月の月経周期に見られる子宮内膜と似ていることを確認しました。 子宮内膜の増殖期には、間質上皮の細胞分裂が活発になり、細胞の過形成や細胞外マトリックスの増加を伴い、子宮内膜が厚くなります(図3参照)。 この増殖は、月経周期中に発育中の卵胞から分泌されるエストロゲンによって刺激される。 プロゲステロンは、エストロゲンの作用に対抗し、その作用によって子宮内膜周期の増殖期を停止させます。 プロゲステロンは、子宮内膜腺を刺激して血管を増やすことにより、分泌期を誘導します(図4参照)。 子宮腺、間質細胞、血管が充実してくると、子宮内膜の厚みがさらに増します。 閉経後の女性では、卵胞外からの低濃度のエストロゲンとプロゲステロンが子宮内膜を刺激して増殖させると考えられています。 また、油糧種子、大豆製品、豆腐などの植物性エストロゲンは、構造的にも機能的にもエストラジオールに類似した植物性物質である。 植物性エストロゲンは、増殖を誘発せず、子宮内膜がんのリスクを増加させないことを示唆する研究にもかかわらず、その長期的な影響は比較的不明である。 同様に、子宮内膜に増殖作用を及ぼす可能性のあるハーブ療法であるブラックコホシュの市販品の使用についても不明な点があります。
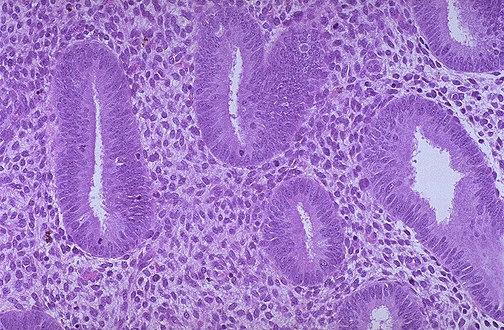
図3. 増殖性子宮内膜の顕微鏡像で、管状腺が増殖し、間質が密になっている。
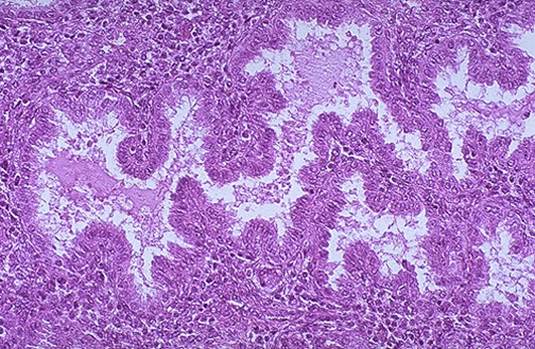
図4. 顕微鏡で見ると、分泌性子宮内膜と、分泌物で満たされた大きな蛇行腺が見られます。
研究では、増殖性子宮内膜は珍しいものではなく、子宮内膜のがんは、惰性ではなく増殖活動の背景から発生することが示唆されています。 しかし、単純に増殖した子宮内膜が悪性腫瘍に変化する可能性は非常に低く、子宮内膜過形成が癌に進展する0.3~1%のリスクよりも大幅に低いと考えられます。 しかし、危険因子として、肥満度と年齢の上昇が挙げられます。
3.6. 増殖性子宮内膜の管理
我々の知る限り、閉経後の出血における異型性のない子宮内膜増殖の管理について発表された研究はありません。 そのため、現在のところ、このような女性に対するエビデンスに基づく治療法はありません。 また、このような患者に対するMDPAの推奨投与量および投与期間についても意見が一致していません。 さらに、より深刻な子宮内膜増殖症を除外するために必要なフォローアップの頻度についても合意が得られていません。
これらの患者をどのように管理するのが最善かについて、婦人科医の間ではいくつかの考え方があります。 増殖性子宮内膜が癌になるリスクは非常に低いと考えられているため、患者を安心させてからプライマリーケアに退院させるという選択肢があります。 一方、より保守的なアプローチとしては、全身性プロゲステロン療法を用いて子宮内膜の退縮を誘導する方法がある。 酢酸メドロキシプロゲステロンの経口投与は、比較的短期間(我々のケースシリーズでは6〜8週間)で子宮内膜退縮を誘導するために処方することができる。 プロゲステロン療法の利点は、深部静脈血栓症のリスクなどの副作用と慎重にバランスをとる必要がある。 一部の婦人科医が検討しているより長期的な選択肢は、ミレーナ子宮内システムである。これは、プロゲステロンを子宮内に放出することによって子宮内膜を薄くする、長時間作用型の可逆的避妊法である。 これらのプロゲステロンはいずれも子宮内膜増殖症にも使用され、子宮内膜を増殖や悪性化から守ることがわかっています。 ミレーナIUSは4年間、子宮内膜を保護することが認可されている。 今回のケースシリーズでは、2人目の患者は1回のパイペル生検で増殖性子宮内膜が見つかった後にプロゲステロン治療を開始し、4人目の患者は再度のパイペル生検で組織を確認した後に同じ治療を開始した。 エビデンスが不足しているため、所見を確認するために反復生検が必要なのか、1回の生検で十分な治療が可能なのかは不明です。 また、我々のケースシリーズでは、患者がメドロキシプロゲステロンの経口投与を6〜8週間受けていることがわかったが、我々の知る限り、理想的な治療期間を調べた研究はない。 増殖性子宮内膜を治療するためのより根本的なアプローチは、子宮内膜癌への変化のリスクを排除するために、PMBを繰り返すエピソードに対して子宮摘出を行うことであろう。 しかし、麻酔や手術のリスク、心理的な影響を考えると、これは最後の手段である。 4人の患者のうち3人については、6週間後にフォローアップとリピートのパイペル子宮内膜生検が行われた。 しかし、フォローアップの頻度や治療への反応の評価についてのエビデンスはない。
4.結論
本報告では、経口メドロキシプロゲステロンを用いた増殖性子宮内膜の管理について、現在の傾向を明らかにした。 また、治療期間やフォローアップなど、不確実な部分が複数浮き彫りになった。 エビデンスに基づいた治療ガイドラインを作成するためには、PMBの増殖性子宮内膜に関するさらなる研究が必要である。
- UK CR. Cancer Statistics: Registrations Series.
- McBride. The normal post-menopausal endometrium(閉経後の正常な子宮内膜)。 J Obstet Gynaecol Br Emp 1954;61 (5):691-7.
- Noer T. The histology of the senile endometrium. Acta Pathologica Microbiologica Scandinavica 1961;51 (3):193.
- Korhonen MO, Symons JP, Hyde BM, Rowan JP, Wilborn WH. 継続的なホルモン補充療法のためのスクリーニングを受けた閉経前後の女性2964人から得られた子宮内膜生検標本の組織分類と病理所見(CHART 2 Study)。 American Journal of Obstetrics and Gynecology 1997;176 (2):377.
- Goldstein RB, Bree RL, Benson CB, Benacerraf BR, Bloss JD, Carlos R, et al. Evaluation of the woman with postmenopausal bleeding: Society of Radiologists in Ultrasound-Sponsored Consensus Conference statement. J Ultrasound Med 2001;20 (10):1025-36.
- SIGN. 閉経後出血の調査。 2002年。
- Paley PJ. 女性に影響を与える主要な悪性腫瘍のスクリーニング。 最新のガイドライン。 American journal of obstetrics and gynecology 2001;184 (5):1021.
- NICECG27. Referral Guidlines for Suspected Cancer.
- Nand SL, Webster MA, Baber R, O’Connor V. Bleeding pattern and endometrial changes during continuous combined hormone replacement therapy(継続的複合ホルモン補充療法中の出血パターンと子宮内膜の変化)。 The Ogen/Provera Study Group. Obstet Gynecol 1998;91 (5 Pt 1):678-84.
- Davidson KG, Dubinsky TJ. 閉経後の膣内出血における子宮内膜の超音波評価。 Radiol Clin North Am 2003;41 (4):769-80.
- Gupta JK, Chien PFW, Voit D, Clark TJ, Khan KS. 閉経後の出血がある女性の子宮内膜病理診断のための超音波による子宮内膜厚:メタアナリシス。 Acta Obstetricia et Gynecologica Scandinavica 2002;81 (9):799.
- Dijkhuizen FPHLJ, BrÃ-Lmann HAM, Potters AE, Bongers MY, Heintz APM. The Accuracy of Transvaginal Ultrasonography in the Diagnosis of Endometrial Abnormalities(子宮内膜異常の診断における経膣超音波検査の精度)。 Obstetrics & Gynecology 1996;87 (3):345-349.
- Ciatto S, Cecchini S, Gervasi G, Landini A, Zappa M, Crocetti E. タモキシフェン治療中の乳癌患者の経膣超音波検査による子宮内膜癌のサーベイランス。 Br J Cancer 2003;88 (8):1175-9.
- Weber G, Mere E, Bahlmanw E, Riisch B. Evaluation of different transvaginal sonographic diagnostic parameters in women with postmenopausal bleeding. Ultrasound in Obstetrics and Gynecology 1998;12 (4):265.
- Gruboeck K, Jurkovic D, Lawton F, Savvas M, Tailor A, Campbell S. 閉経後出血のある患者における、三次元超音波による子宮内膜の厚さと体積の測定の診断的価値について。 Ultrasound in Obstetrics and Gynecology 1996;8 (4):272.
- Dijkhuizen FPHLJ, Mol BWJ, Brölmann HAM, Heintz APM. The accuracy of endometrial sampling in the diagnosis of patients with endometrial carcinoma and hyperplasia(子宮内膜癌および過形成患者の診断における子宮内膜サンプリングの精度)。 Cancer 2000;89 (8):1765.
- Van den Bosch T, Vandendael A, Van Schoubroeck D, Wranz PA, Lombard CJ. 閉経後の女性の子宮内膜疾患の診断における膣内超音波検査とオフィスでの子宮内膜サンプリングの併用。 Obstet Gynecol 1995;85 (3):349-52.
- Curtis RE, Boice JD, Shriner DA, Hankey BF, Fraumeni JF.
- Curtis RE, Boice JD, Shriner DA, Hankey BF, Fraumeni JF, Adjuvant Tamoxifen Therapy for Breast Cancer. Journal of the National Cancer Institute 1996;88 (12):832-835.
- Karlsson B, Granberg S, Wikland M, Torvid K, Marsal K, et al. Transvaginal ultrasonography of the endometrium in women with postmenopausal bleeding âa Nordic multicenter study. American Journal of Obstetrics and Gynecology 1995;172 (5):1488.
- Lacey JV, Chia VM. 子宮内膜過形成と癌への進行のリスク。 Maturitas 2009;63 (1):39.
- Lacey JV, Sherman ME, Rush BB, Ronnett BM, Ioffe OB, Duggan MiA, et al.A. Absolute Risk of Endometrial Carcinoma During 20-Year Follow-Up Among Women With Endometrial Hyperplasia. Journal of Clinical Oncology 2010;28 (5):788-792.
- Silverberg. 子宮体部の腫瘍と妊娠性絨毛性疾患。 AFIP Atlas of Tumor Pathology 1995.
- Balk JL, Whiteside DA, Naus G, DeFerrari E, Roberts JM. A pilot study of the effects of phytoestrogen supplementation on postmenopausal endometrium(閉経後の子宮内膜に対する植物性エストロゲン補充の効果に関する試験)。 J Soc Gynecol Investig 2002;9 (4):238-42.
- 病理学的FG。 http://library.med.utah.edu/WebPath/FEMHTML/FEMIDX.html#2.
- Sivridis E, Giatromanolaki A. Proliferative activity in postmenopausal endometrium: the lurking potential for giving rise to an endometrial adenocarcinoma. J Clin Pathol 2004;57 (8):840-4.
- Baak JP, Wisse-Brekelmans EC, Fleege JC, van der Putten HW, Bezemer PD. 過形成における子宮内膜癌のリスクの評価、形態学的および形態学的特徴によるもの。 Pathol Res Pract 1992;188 (7):856-9.
- Wan YL, Holland C. The efficacy of levonorgestrel intrauterine systems for endometrial protection: a systematic review(子宮内膜保護のためのレボノルゲストレル子宮内システムの有効性:システマティックレビュー). Climacteric;14 (6):622-632.