Sulfur Electron Configuration: 硫黄(いおう)は、化学元素の一つです。 化学記号はSで、原子番号は16です。 硫黄は多価で、豊富で、非金属です。
硫黄の電子配置
元素の硫黄は、室温では黄色の明るい結晶性の固体です。 硫黄は、白金、金、テルル、イリジウム、希ガスを除くすべての元素と化学反応を起こします。 地球上では質量比で5番目、宇宙では10番目に多い元素です。

硫黄は純粋な形や天然の形で見られることもあります。 硫黄は通常、硫酸塩や硫化物の鉱物として存在します。 このように自生しているものが多いので、古代にも硫黄は知られていました。 古代ギリシャ、古代インド、エジプト、中国などで、その用途が言及されています。
- 塩素の価電子
- アルゴンの価電子
- カリウムの価電子
- カルシウムの価電子
- テクネチウムの価電子li 価電子
- チタン 価電子
- バナジウム 価電子
- クロム 価電子
- マンガン 価電子 li
- 鉄の価電子
- コバルトの価電子
- ニッケルの価電子
- 銅の価電子
- 亜鉛の価電子
- ガリウムの価電子
- ゲルマニウムの価電子
- ヒ素の価電子
- セレンの価電子
聖書の中では。 硫黄は “brimstone “という名前で知られています。 現在、すべての元素状硫黄は、石油や天然ガスから硫黄を含む汚染物質を取り除く際の副産物として作られています。
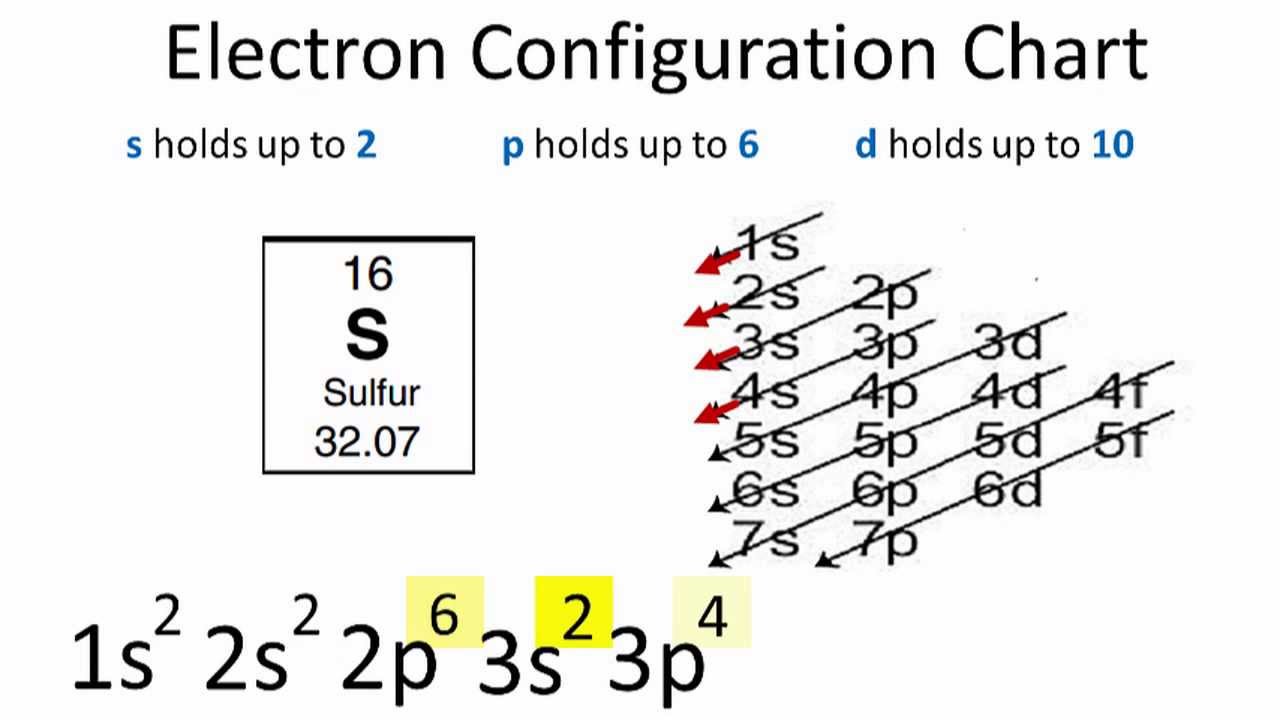
硫黄の電子配置とは
3s² 3p⁴が電子の電子配置であることを表しています。
How many Valence Electrons Does Sulfur Have
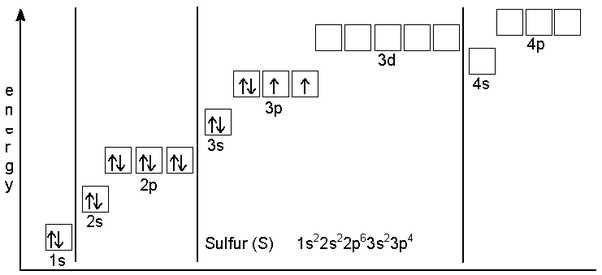
イオウの外殻には6個の価電子があります。


イオウの価電子数
イオウの外殻には6個の価電子があります。
硫黄の基底状態の電子配置
硫黄の電子配置を見ると、最初の2つの電子は1s軌道に入っています。 1sは2つの電子しか持たないので、硫黄の次の2つの電子は2s軌道に入ります。
Sの電子配置は1s22s22p63s23p4です。