INLEIDING
Humane papillomavirussen (HPV) vormen een heterogene virale groep; hun genoom bestaat uit een helicoïdaal dubbelstrengs DNA-molecuul met een eiwitcapside. Zij worden gevormd door epitheliotrope entiteiten die het epitheel in basale toestand infecteren en als gevolg daarvan de DNA-transcriptie en -replicatie op basaal niveau behouden, waardoor hyperplastische papillomateuze en verrucieuze laesies in de huid en mucosae ontstaan.1
Er zijn meer dan 230 HPV-types (waarvan 118 goed gekarakteriseerd) en meer dan 40 anaal-genitale types, waarvan er 15 oncogeen zijn. Bij de mens zijn ze een van de virale groepen die het vaakst epitheel van huid en conjunctieve mucosae, mondholte (genotypes 33 en 32) larynx, bronchiale boom, oesofagus, blaas, anus en genitaal kanaal infecteren.2,3
In het geval van tong HPV zijn er twee hoofdgroepen van klinische presentatie:
a) Benigne laesies en b) pre-maligne of maligne laesies. Onder de goedaardige orale laesies vinden we oraal papilloom, orale verruca vulgaris (gewone wrat), oraal acumina condyloma en focale epitheliale hyperplasie (ziekte van Hecks).4-6 Kwaadaardige en prekwaadaardige laesies worden voornamelijk vertegenwoordigd door leukoplakie en plaveiselcelcarcinoom.7
Squameus papilloma van het mondslijmvlies is de meest frequent gevonden papillaire laesie, het vertegenwoordigt 2,5% of alle laesies gevonden in de mond.6 HPV klinische laesies worden het vaakst waargenomen in de bovenlip, de onderlip, linguaal frenulum, dorsum van de tong en de hoeken van de lippen.8
De meest waargenomen morfologie van deze laesies neemt een bloemkoolachtige vorm aan, maar er kunnen ook andere vormen worden waargenomen, zoals gewone wratten, hyperkeratose of zelfs niet-gekeratiniseerde oppervlakken, die oppervlakkige kleurveranderingen vertonen (gewoonlijk een violette tint).9 Volgens bibliografische referenties wordt deze ziekte meestal overgedragen via een oraal-genitale seksuele praktijk.10
Het doel van de huidige studie was een literatuuroverzicht uit te voeren over orale papillomatose en tevens een klinisch geval te rapporteren.
HISTOLOGIE VAN DE TONGUE
Cellen die zich in de tong bevinden, vertonen een gepolystratificeerde structurele rangschikking. Zij zijn gevestigd op een (oppervlakkig) stratum corneum, een korrelige laag, spinous laag en basale laag (diepste laag). De kern van deze cellen verandert van grootte naar gelang van hun rijpheid en specialisatie.11
PAPILLOMA VIRUS GENOME
Virale deeltjes zijn opgebouwd uit een eiwit-capside dat voor 95% bestaat uit eiwit L1 en voor 5% uit eiwit L2. Deze eiwitten verbinden zich tot icosahedrale capsomeren. Dubbelstrengs cirkelvormig DNA van ongeveer 8000 basenparen bevindt zich binnenin de capsid. Het wordt gevormd door acht genen en een niet-gecodeerd regulerend gebied; dit gebied bevat koppelingsplaatsen voor hormonale en eiwitfactoren van de gastheer, die het virus nodig heeft om zijn replicatiecyclus te voltooien.12
HHPV-virus wordt op dezelfde manier gevormd door twee soorten genen: genen die gecodeerd zijn tijdens de vroege infectiestadia, beter bekend als E genen (E voor vroeg) en genen die gecodeerd zijn tijdens de late replicatiestadia, bekend als E genen: E1, E2, E4, E5, E6, E7 (hoewel E4 als een laat gen wordt beschouwd), alsmede twee late genen, L1 en L2. Vroege genen coderen eiwitten die betrokken zijn bij de virale replicatie en regulatie, en ook bij hun carcinogene vermogen. Anderzijds coderen de late genen structurele eiwitten die een virale kapside vormen.12,13
HPV CYCLE OF LIFE
HPV komt de gastheer binnen via een klein schaafwondje in het integrale epitheel van de tong.13 Het begint dan zijn productieve cyclus door slecht gedifferentieerde cellen van de basale lagen van het epitheel te infecteren, waar de transcriptie van de genen begint.12
Wanneer geïnfecteerde cellen differentiëren en van de basale laag migreren naar de doornlaag van het epitheel (immunologisch toelaatbaar), wordt de virale replicatie gestimuleerd, wat leidt tot ophoping van virionen in de kern en de assemblage van de capside in het cytoplasma. Er zijn ten minste twee cycli voor virale replicatie: a) lytische infectie en b) lysogene infectie.
In geval van lytische infectie komt het virus met replicatievermogen aan in de parabasale cellen, dringt het door in het cytoplasma en later in de celkern. Eenmaal in de celkern repliceert het zich in het episomale gebied, zonder in het celgenoom te integreren, en produceert aldus ongeveer 20 virale kopieën. Deze complete virale deeltjes veroorzaken celdood en blijven dus vrij en in de nabijheid van epitheliale oppervlakken.
In gevallen van lysogene infectie wordt het celgenoom direct aangetast. Dit is het geval bij de hoog-risico HPV (16 en 18). Na het bereiken van de celkern integreert het virus zich in het celgenoom van de gastheer, voornamelijk in de segmenten E6 en E7. In dit geval gaat de virusreplicatie over in een latentiefase totdat de gastheercel zowel zijn eigen DNA als het DNA van geïntegreerde virussen repliceert. De virale DNA-segmenten zijn transcriptioneel actief na de celdeling; dit garandeert hun voortplanting.13 In tegenstelling tot lytische infectiegevallen wordt dit type infectie waargenomen in cellen die een kwaadaardige groei doormaken.
De genexpressie van verschillende HPV-types wordt strikt en specifiek gereguleerd door transcriptiefactoren zoals AP-1, keratinocyt-specifieke factor, NF-1CTF, CEFI, CEFII en TEFI, alsook door een aantal hormonale origine-factoren.
In beide soorten infecties starten E1- en E2-eiwitten hun expressie in opgaande richting (supraregulatie), waardoor ze zowel de DNA-transcriptie als de door de basale cellen gecontroleerde expressie activeren.12
E6 en E7 HPV-genen staan in direct verband met kwaadaardige celtransformatie via de oncoproteïnen E6 en E7. Deze eiwitten zijn in staat verbindingen aan te gaan met cellulaire genproducten die de celcyclus reguleren, waaronder p53 en Rb. Oncoproteïne E6 vormt een verbinding met p53 proteïne, terwijl E7 een verbinding vormt met Rb proteïne.
Rb proteïne reguleert de overgang van G1 naar S. Oncoproteïne E7 sequestreert Rb waardoor het de celproliferatie proteïnen niet kan reguleren, dit dwingt de celcyclus om in de synthese fase te blijven.13 Deze twee gebeurtenissen: virale gen integratie in het celgenoom en blokkering van de normale functie van tumor suppressor genen p53 en Rb worden geassocieerd met cellulaire transformatie van cellen geïnfecteerd met hoog oncogeen potentieel virussen (16 en 18). De progressieve veranderingen die keratocyten ondergaan, wijzigen de micro-omgeving en veranderen de balans van het epitheel door stimulansen voor celproliferatie die worden geleid door secretie van alfa- en bèta-epidermale groeifactoren.
De proteïnen E2, E3, E4, E5, E6 en E7 induceren verlies van gen-eiwitcontrole (episomaal DNA in de kern), terwijl E6 en E7 viraal DNA repliceren. L1 en L2 assembleren het virus en plaatsen zich in rijpe plaveiselcellen om later af te glijden (meer dan 1000 kopieën per cel).
In goedaardige laesies, zoals tongpapilloma, bevordert de proliferatie van episomale DNA-deeltjes abnormale groei van het epitheel, waardoor de genfouten van de cellen toenemen (gastogenese).
E6 en E7 bevorderen de virusproliferatie en immortalisatie. Wanneer het virus oncogeen potentieel bezit, veroorzaakt het malignisatie, wanneer dat niet het geval is, ontstaat een goedaardige laesie die zichzelf in een periode van twee jaar kan begrenzen. Dit mechanisme wordt voornamelijk geïnduceerd door het verlies van DNA-telomeren, waardoor apoptose wordt geremd, het aantal geïnfecteerde cellen toeneemt en de acetylering en fosforylering van p53 en Rb afneemt. Bovendien wordt de expressie van angiogene factoren bevorderd. Dat is het geval voor de vasculaire groeifactor die het celcytoskelet en de extracellulaire matrix ontregelt en de regulatiefactoren beïnvloedt die een rol spelen bij de gezondheid van deze structuren.12
HPV-infectie veroorzaakt belangrijke veranderingen in de celmorfologie. Zo wordt de vorming van peri-nucleaire vacuolen waargenomen, evenals vergrote, onregelmatige en hyperchromatische kernen en bi-nucleatie. Cellen die deze veranderingen hebben ondergaan, worden koylocyten genoemd en worden beschouwd als de “vingerafdruk” van het virus.
Condyloma is de meest voorkomende morfologische manifestatie van HPV-infectie (condyloma acuminatum).14
CASE PRESENTATION
De patiënte was een 21-jarige alleenstaande vrouw. Ze werkte niet buitenshuis, was geboren en woonachtig in de Estado de Mexico (staat Mexico). Haar bloedgroep was O, Rh positief. Als onderdeel van haar familiegeschiedenis meldde zij dat haar vader multiple sclerose had en een zus reumatoïde artritis. De patiënte ontkende drugsverslaving. Ze was getroffen door meerdere juveniele borst fibroadenoma in de linker borst, die operatief werden behandeld. Ze begon menarche op 15, met menstruatieritme 28 × 3. Seksuele activiteit begon op 17. Ze meldde één seksueel actieve partner, ontkende de praktijk van orale-genitale seks. Ze werd zwanger en kreeg een levend kind van 3,1 kg.
Een jaar eerder was ze onderworpen aan cytologisch en colposcopisch onderzoek in het onderste genitale kanaal, naast een borstcontrole. De resultaten waren negatief voor kanker en HPV. De door patiënte gebruikte gezinsplanningsmethode was een intra-uterien apparaat.
De patiënte zocht voor het eerst consultatie in april 2014, klagend over ventrale glossodynie met een evolutie van drie maanden. Hierna ervoer zij een gevoel van vreemd lichaam en uitstulping in het zachte weefsel, met progressieve centrifugale groei tot vorming van een linzevormige tumor die bloedde bij contact met het harde gehemelte en tijdens kauwen. Zij bezocht een dokterspraktijk waar zij een niet nader gespecificeerde systemische behandeling onderging die geen bevredigend resultaat opleverde.
De mond werd geïnspecteerd door middel van een colposcopie procedure met 0,66x vergroting (Hinselmann colposcoop, 2014 Mexico). Deze procedure onthulde een laesie van ongeveer 1 cm diameter, met een rozige tint, cirkelvormig, met gekartelde randen, zonder pedikel en van avasculaire aard (figuur 1). Na afloop van het onderzoek werd de patiënte geïnformeerd over de diagnose en de wenselijke behandeling.
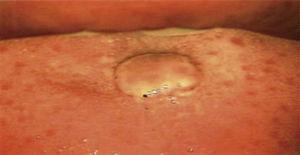
Directe inspectie van de mond onder colposcopisch perspectief. I (Hinselmann, 2014), met een vergroting van 0,66. Lesie met een diameter van 1 cm, van rozige tint, cirkelvormig, gekartelde randen, avasculair en zonder pedikel.
TREATMENT
Onder plaatselijke verdoving en 2% xylocaïne met epinefrine (1mL) werd de basis van de laesie geïnfiltreerd met een 30G kaliber naald. Het laesieoppervlak werd geschoren en ontleed met een wigvormige scherpe dissectie. Nadat haemostase was bereikt, werden de randen in één vlak met omgekeerde hechtingen afgedekt (Dermalon 000). Het verkregen monster werd gefixeerd in 5 ml 10% formaline om vervolgens te worden verzonden naar de afdeling Pathologie.
Vijftien dagen later werden de hechtingen verwijderd en een gezond operatiegebied werd aldus verkregen (figuur 2). Histopathologisch rapport onthulde de aanwezigheid van weefsel met 0.6 × 0.5cm afmetingen. Het specimen was van onregelmatige vorm, donkerbruine tint en zachte consistentie. Microscoopanalyse onthulde polygestratificeerd, hoornvliesepitheel, acanthosis en hyperkeratose. De binnenkant van het monster toonde intra-epitheliale verhoorningshaarden van verschillende grootte. In het algemeen waren de epitheelcellen kleiner dan die van het normale stratum spinosum (Figuren 3 en 4). De definitieve diagnose wees op een plaveiselpapilloma van de tong. Virale gen-typering uitgevoerd met polymerase kettingreactie (PCR) in real time meldde de aanwezigheid van een 58 genotype (hoog-risico virus).
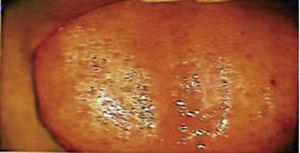
Foto van de tong onder colposcopisch perspectief 15 dagen na de operatie.
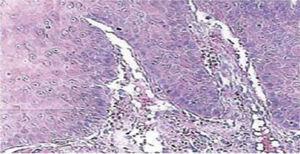
10x microscopische vergroting. Polygestratificeerd corneumepitheel, acanthosis en hyperkeratosis.
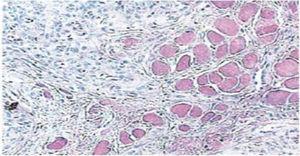
40 x Microscopische vergroting. Intra-epitheliale verhoorningshaarden van verschillende grootte.
DISCUSSIE
HPV is een DNA-virus; het behoort tot de papovaviridae-familie, van het papillomavirus-geslacht. Er zijn meer dan 230 genotypen beschreven. De incubatieperiode varieert van drie weken tot acht maanden, met een gemiddelde van drie maanden. Van de 230 papillomavirusgenotypes worden er 16 het vaakst in verband gebracht met orale laesies (1, 2, 3, 4, 6, 7, 10, 11, 13, 16, 31, 32, 33, 35 en 57).
Er zijn twee hoofdgroepen van HPV klinische presentatie: a) goedaardige laesies en b) premaligne of maligne laesies. Goedaardige orale laesies zijn oraal papilloma, verruca vulgaris (gewone wrat), oraal acuminatum condiloma en focale epitheliale hyperplasie (ziekte van Heck). Premaligne en maligne laesies worden voornamelijk vertegenwoordigd door leukoplakie en plaveiselcelcarcinoom die in verband worden gebracht met genotype 16 en 18. De overdracht van HPV vindt plaats via orale en genitale seksuele praktijken.
Er zijn verschillende technieken om HPV te diagnosticeren, waaronder conventionele cytologie, vloeistofcytologie, histologie, colposcopie en moleculairbiologische technieken zoals in situ hybridatie en polymerasekettingreactie (PCR).15,16 In het hier gepresenteerde klinische geval werd besloten tot gentypering van het virus met PCR, deze procedure toonde de aanwezigheid van een 58 genotype aan. Dit gegeven is niet gedocumenteerd in de in de literatuur gerapporteerde classificatie.
De behandeling wordt voor elk individueel geval op maat gemaakt. Destructieve technieken kunnen worden gebruikt, zoals cryotherapie of elektrochirurgie, gebruik van immunemodulatoren (imiquimod aan 5%), of gebruik van een antimetaboliet om te interfereren met RNA (ribonucleïnezuur) en DNA, of door thymidylaatsynthetaseremming (5-fluoracil).17,18 In het onderhavige geval werd besloten tot chirurgie met koud scalpel op basis van de plaats van verschijning van de laesie, om te profiteren van de mogelijkheid om geen sequels achter te laten.
CONCLUSIE
In orale mucosa blootgesteld aan microtrauma, kunnen micro-organismen en chemische en fysische factoren synergetisch samenwerken met HPV om de ontwikkeling van benigne laesies of carcinomen te bevorderen.
HPV speelt een belangrijke rol bij de ontwikkeling van plaveiselcelcarcinomen in de anale en genitale tractus, evenals in verruciforme epidermodysplasie, en in de larynx.
In benigne laesies komen genotypen 33 en 32 het meest voor. Niettemin, in onze studie, wees het verslag van de moleculaire biologie procedure op de aanwezigheid van genotype 58.
In de wereldwijde literatuur is 58 gen-typering niet gerapporteerd bij dit type laesies die klinisch goedaardig lijken te zijn.
Om deze aandoening met succes te benaderen, is interdisciplinaire diagnose en behandeling onder tandartsen, oncologen en gynaecologen die voldoende getraind zijn in het bestuderen van deze laesies onder colposcopisch perspectief, van het grootste belang.
Behandeling door middel van een chirurgische ingreep met een koud scalpel, gericht op het achterlaten van laesie-vrije grenzen is een adequate oplossing om dit type laesies uit te roeien en geen vervolgstappen te veroorzaken, vooral bij tumoren die klinisch goedaardig lijken, maar die op grond van hun gen-type op middellange en lange termijn kwaadaardig gedrag zullen gaan vertonen.
Wij vinden de huidige casusbespreking interessant omdat er weinig rapporten met betrekking tot deze aandoening in de Mexicaanse wetenschappelijke bibliografie waren.