Waterstofbruggen kunnen zich vormen tussen het lone paar op het zeer elektronegatieve stikstofatoom en het licht positieve waterstofatoom in een ander molecuul.
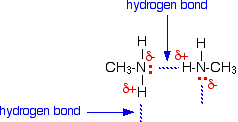
De waterstofbruggen zijn niet zo efficiënt als in bijvoorbeeld water, omdat er een tekort is aan lone paren. Sommige licht positieve waterstofatomen kunnen geen eenlingpaar vinden om een waterstofbrug mee te maken. Er zijn twee keer zoveel geschikte waterstofatomen als er eenzame paren zijn.
Het kookpunt van de primaire amines neemt toe naarmate de ketenlengte toeneemt, omdat er meer van der Waals dispersiekrachten optreden tussen de grotere moleculen.
Secondaire amines
Voor een eerlijke vergelijking zou je het kookpunt van dimethylamine moeten vergelijken met dat van ethylamine. Het zijn isomeren van elkaar – elk bevat precies evenveel dezelfde atomen.
Het kookpunt van het secundaire amine ligt iets lager dan dat van het overeenkomstige primaire amine met hetzelfde aantal koolstofatomen.
Secundaire aminen vormen nog steeds waterstofbruggen, maar doordat het stikstofatoom in het midden van de keten zit in plaats van aan het eind, is de permanente dipool op het molecuul iets minder.
Het lagere kookpunt is het gevolg van de lagere dipool-dipool attracties in het dimethylamine vergeleken met ethylamine.
Tertiaire aminen
Dit keer zou je, om een eerlijke vergelijking te maken, trimethylamine moeten vergelijken met zijn isomeer 1-aminopropaan.
Als je de tabel verderop bekijkt, zie je dat trimethylamine een veel lager kookpunt heeft (3,5°C) dan 1-aminopropaan (48,6°C).
In een tertiair amine zijn er geen waterstofatomen direct aan de stikstof verbonden. Dat betekent dat waterstofbinding tussen tertiaire aminemoleculen onmogelijk is. Daarom ligt het kookpunt veel lager.
Oplosbaarheid in water
De kleine amines van alle typen zijn zeer goed oplosbaar in water. De amines die normaal als gas bij kamertemperatuur worden aangetroffen, worden meestal als oplossing in water verkocht – net zoals ammoniak meestal als ammoniakoplossing wordt geleverd.
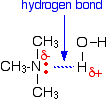
Alle amines kunnen waterstofbruggen vormen met water – zelfs de tertiaire amines.
Hoewel de tertiaire aminen geen waterstofatoom aan de stikstof hebben en dus geen waterstofbruggen met zichzelf kunnen vormen, kunnen ze waterstofbruggen vormen met watermoleculen door gewoon gebruik te maken van het lone paar op de stikstof.
De oplosbaarheid neemt af naarmate de koolwaterstofketens langer worden – merkbaar na ongeveer 6 koolwaterstoffen. De koolwaterstofketens moeten zich een weg banen tussen de watermoleculen door waterstofbruggen tussen de watermoleculen te verbreken.
Ze vervangen deze echter niet door iets dat net zo sterk is, en dus wordt het proces van het vormen van een oplossing steeds minder energetisch haalbaar naarmate de ketenlengte toeneemt.
Geur
De hele kleine amines zoals methylamine en ethylamine ruiken erg naar ammoniak – hoewel als je ze naast elkaar zou vergelijken, de aminegeuren iets complexer zijn.
Als de amines groter worden, gaan ze meer “visachtig” ruiken, of ze ruiken naar bederf.
Als je bekend bent met de geur van meidoornbloesem (en vergelijkbaar ruikende dingen als cotoneasterbloesem), dan is dit de geur van trimethylamine – een zoete en nogal ziekelijke geur als de eerste stadia van rottend vlees.
Vragen om je begrip te testen
Als dit de eerste reeks vragen is die je hebt gemaakt, lees dan eerst de inleidende pagina voordat je begint. U zult de BACK BUTTON van uw browser moeten gebruiken om daarna hier terug te komen.
Vragen over de inleiding tot aminen
antwoorden
Waar wilt u nu naar toe?
Naar het menu aminen . .
Naar het menu van de andere organische verbindingen . .
Naar het hoofdmenu . . .