Door Caroline Helwick
May 25, 2019

In patiënten met intermediair- tot hoog-risico smoldering multiple myeloom, leidde behandeling met enkelvoudig-agent lenalidomide, versus observatie, tot een 72% reductie in het risico van ziekteprogressie na 3 jaar.1 Resultaten van de fase III E3A06-studie werden gepresenteerd op een persbriefing voorafgaand aan de 2019 ASCO Annual Meeting door Sagar Lonial, MD, FACP, van Emory University, Atlanta.
“We hebben aangetoond, in de grootste gerandomiseerde studie tot nu toe in smoldering myeloom, dat we de ontwikkeling van symptomatisch myeloom kunnen voorkomen bij een significante fractie van de patiënten,” zei Dr. Lonial. Meer dan 90% van de interventiegroep bleef progressievrij na 3 jaar, meldde hij.

We weten niet of een echte behandelingsstrategie een verschil maakt, maar we hebben aangetoond dat interventie een verschil kan maken.
– Sagar Lonial, MD, FACPTweet deze quote
Hoewel patiënten met smeulend multipel myeloom – een vroege, asymptomatische entiteit zonder de aanwezigheid van CRAB-criteria (verhoogd calcium, nierfalen, bloedarmoede, botletsels)- gewoonlijk worden gecontroleerd en niet behandeld, hebben sommige onderzoekers zich afgevraagd of vroegtijdige interventie de resultaten zou kunnen verbeteren en zelfs de ziekte zou kunnen genezen voordat de volledige impact ervan wordt gevoeld.
“Het staat buiten kijf dat patiënten met multipel myeloom onmiddellijk behandeld moeten worden om aanwijzingen van orgaanschade ongedaan te maken, maar een uitdaging waar we mee worstelen is het identificeren van patiënten zonder orgaanschade die het grootste risico lopen op ziekteprogressie, en proberen in te grijpen,” zei Dr. Lonial.
Patiënten die worden geclassificeerd als patiënten met smeulende ziekte hebben over het algemeen een risico op ziekteprogressie van ongeveer 10% per jaar. Na 5 jaar zal ongeveer de helft van deze patiënten symptomatische ziekte hebben, zei hij.
Vorige bevindingen door Spaanse Myeloomgroep
De studie bouwt voort op eerder werk van de Spaanse Myeloomgroep, die in de kleinere PETHEMA-studie van 2015 rapporteerde dat lenalidomide/dexamethason de progressievrije en algehele overleving verbeterde, versus observatie, bij patiënten met een hoog risico op ziekte -progressie.2
Die studie werd echter bekritiseerd op manieren die werden vermeden door de huidige studieopzet: patiënten werden niet gescreend met geavanceerde beeldvormingstechnieken; onderzoekers pasten een verouderde definitie van hoog risico toe; en het regime omvatte dexamethason, waardoor het onmogelijk was om het effect van lenalidomide te isoleren, zei hij.
“Het feit dat de studie geen gebruik maakte van moderne beeldvorming is belangrijk, omdat patiënten met negatieve röntgenfoto’s een botziekte kunnen hebben door magnetische resonantie beeldvorming (MRI) of positron-emissie tomografie (PET) scan,” merkte Dr. Lonial op. “In onze studie eisten we MRI vóór de deelname aan de studie om er zeker van te zijn dat we geen patiënten opnamen die al myeloom hadden, wat de belangrijkste kritiek op de Spaanse studie was.”
E3A06 elimineerde ook dexamethason, dat de kwaadaardige kloon kan onderdrukken of elimineren en een tijdelijke respons kan produceren, in tegenstelling tot het onder controle houden van de kloon, wat het doel was van het gebruik van lenalidomide met één middel, zei hij.
De vorige proef, hoewel belangrijk geacht, veranderde daarom niets aan de standaard van zorg, “maar nu,” zei hij, “met de E3A06-proef, in combinatie met de PETHEMA-proef, zouden velen van ons stellen dat vroegtijdig ingrijpen met een preventiestrategie het risico op conversie naar symptomatisch myeloom kan verminderen.”
E3A06 Details
E3A06 was een gerandomiseerde fase III-intergroepstrial die het effect testte van enkelvoudig-agent lenalidomide in vergelijking met observatie bij patiënten die werden geclassificeerd als patiënten met intermediair- of hoog-risico smolterend myeloom. Om in aanmerking te komen moesten de patiënten ≥ 10% plasmacellen en een abnormale serum vrije lichte keten ratio (< 0.26 of > 1.65) hebben.
In een initiële fase II run-in kregen 44 patiënten lenalidomide om de veiligheid aan te tonen. In de fase III-studie werden 182 patiënten willekeurig toegewezen aan lenalidomide (25 mg/d gedurende 21 van de 28 dagen) of observatie. De basiskenmerken waren vergelijkbaar voor beide groepen. De mediane follow-up bedroeg 71 maanden voor het fase II-gedeelte en 28 maanden voor fase III. Het primaire eindpunt was progressievrije overleving.
Significante vermindering van het risico op progressie
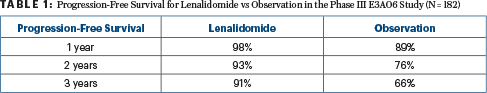
Op 3 jaar was 87% van het fase II-cohort, die allemaal lenalidomide kregen, progressievrij, net als 78% op 5 jaar. Voor de fase III vergelijking waren de 1-, 2- en 3-jaars progressievrije overlevingspercentages 98%, 93% en 91% voor lenalidomide versus respectievelijk 89%, 76% en 66% voor observatie (hazard ratio = 0,28; P = .0005), zoals weergegeven in Tabel 1. Het totale responspercentage met lenalidomide was 47,7% voor de fase II-studie en 48,9% voor de fase III-studie, waarbij geen respons werd gezien in de observatie-arm.
Interessant is dat bij uitsplitsing in laag-, intermediair- en hoog-risicogroepen, elke subgroep “bijna evenveel” bleek te profiteren van vroegtijdige interventie. “Dit suggereert dat we ons nu op patiënten met een hoog risico moeten richten, maar dat we verder onderzoek moeten doen naar de middengroep, voor wie nog geen onderzoek heeft aangetoond dat ze baat hebben bij het voorkomen van symptomatische ziekte. We zien wel een voordeel voor de patiënten met een intermediair risico, maar de follow-up van de totale overleving is te kort om te zeggen dat deze patiënten allemaal moeten worden behandeld,” concludeerde hij.
Patiënten met een laag-intermediair risico werden opgenomen toen de criteria om in aanmerking te komen voor de studie werden versoepeld voor slechts licht afwijkende vrije lichte keten ratio’s. Hoewel ook zij baat hadden bij de studie, is dit geen groep om op dit moment voor behandeling te overwegen, voegde hij eraan toe.
Bijwerkingen
Graad 3 tot 4 niet-hematologische toxiciteiten werden waargenomen bij ongeveer 28% van de patiënten, en graad 3 tot 4 hematologische toxiciteit (voornamelijk neutropenie) bij ongeveer 6%. De cumulatieve incidentie van invasieve secundaire primaire maligniteiten was 5,2% voor lenalidomide en 3,5% voor observatie.
Er waren geen verschillen in kwaliteit-van-leven scores tussen de armen. Wel stopte 80% van de patiënten in fase II en 51% in fase III met lenalidomide.
Looking Ahead
Een preventieve strategie voor smeulend myeloom zal waarschijnlijk minder intensief zijn dan de behandelingsstrategieën die worden toegepast voor symptomatische ziekte, zei hij. “We richten ons op het verbeteren van de immuunbewaking van de bestaande kwaadaardige kloon en voorkomen dat die kloon zich ontwikkelt, in tegenstelling tot het uitroeien van de ziekte, wat het doel van de behandeling is,” zei Dr. Lonial.
In lopende studies worden in feite agressievere interventies nagestreefd, zoals het combineren van lenalidomide, dexamethason, en daratumumab, of andere nieuwe actieve middelen. Andere studies evalueren het voordeel van inductietherapie, consolidatie, transplantatie, en 2 jaar onderhoud bij smeulende ziekte, zei hij.
“We weten niet of een echte behandelingsstrategie een verschil maakt, maar we hebben laten zien dat interventie een verschil kan maken,” zei hij. “Nu is het tijd om andere ideeën te onderzoeken, met intensievere regimes en met een andere focus.” ■
DISCLOSURE: Dr. Lonial heeft geraadpleegd of geadviseerd voor Celgene, Bristol-Myers Squibb, Janssen Oncology, Novartis, GlaxoSmithKline, Amgen, AbbVie, Takeda, Merck, en Juno Therapeutics; en heeft onderzoeksfinanciering ontvangen van Celgene, Bristol-Myers Squibb, en Takeda.
1. Lonial S, Jacobus SJ, Weiss M, et al: E3A06: Randomized phase III trial of lenalidomide versus observation alone in patients with asymptomatic high-risk smoldering multiple myeloma. 2019 ASCO Annual Meeting. Abstract 8001. Wordt gepresenteerd op 2 juni 2019.
2. Mateos M-V, Hernandez M-T, Giraldo P, et al: Lenalidomide plus dexamethason voor hoog-risico smoldering multipel myeloom. N Engl J Med 369:438-447, 2013.