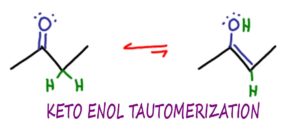
 Keto Enol Tautomerisatie of KET, is een organisch-chemische reactie waarbij keton- en enolmoleculen kunnen isomeriseren of interconverteren, meestal in een zuur of base gekatalyseerde reactie.
Keto Enol Tautomerisatie of KET, is een organisch-chemische reactie waarbij keton- en enolmoleculen kunnen isomeriseren of interconverteren, meestal in een zuur of base gekatalyseerde reactie.
Keto Enol Tautomerisatie zal in je cursus organische chemie heel wat keren voorkomen, te beginnen met alkynehydratatiereacties, en weer opduiken in je geavanceerde (orgo 2) enolaat- en condensatiereacties.
Tautomerisatie is een heel specifiek type isomerisatie,
in dit geval de interconversie tussen de keto en enol vormen van een molecuul.

Keto verwijst naar de keton-functiegroep – hoewel KET niet beperkt is tot JUST ketonen.
Aldehyden, die erg lijken op ketonen,
met uitzondering van een eindwaterstof,
kunnen ook tautomerisatie ondergaan.
 Enol komt van ‘Ene’ als in alkeen,
Enol komt van ‘Ene’ als in alkeen,
een dubbele binding van koolstof aan koolstof.
En ‘ol’ als in alcohol – een OH groep.
Voel je je roestig? Bekijk de Functionele Groepen Organische Chemie
Als tautomerisatie hetzelfde is als isomerisatie,
Denk aan tautomers als isomeren, in het bijzonder constitutionele isomeren.
De term tautomers verwijst naar de twee specifieke vormen van het molecuul die in evenwicht met elkaar kunnen convergeren.
In KET zijn de Keto en Enol vormen tautomers van elkaar.

Welke vorm is stabieler, Keto of Enol?
Ondanks dat het een omkeerbare reactie is, is de Keto vorm stabieler en dus bevoordeeld door het evenwicht.
Dit komt omdat een dubbele koolstof gebonden aan zuurstof stabieler is dan een enkele koolstof gebonden aan zuurstof en een enkele gebonden aan waterstof.
Gelukkig genoeg komt deze wiskunde uit de thermodynamica die al in de algemene scheikunde wordt behandeld en iets wat je niet hoeft te berekenen op het niveau van organische scheikunde (sommige professoren eisen het echter nog steeds).
Dit is geen harde en snelle regel.
Er zijn enkele situaties waarin de enolvorm een grotere stabiliteit aan het totale molecuul geeft. Kijk maar eens naar het voorbeeld hieronder:

De keto vorm heeft een stabielere carbonyl, maar de enol vorm zorgt ervoor dat de pi binding deel uitmaakt van een veel stabieler aromatisch systeem (bekijk hier de aromaticiteit). Daarom zal de enolvorm van dit molecuul bij evenwicht overheersen.
Keto Enol Tautomerisatie komt in verschillende organische reacties voor, te beginnen met hydroborering en oxymercuratie van alkynen.
KET in Oxymercuratie van Alkynen
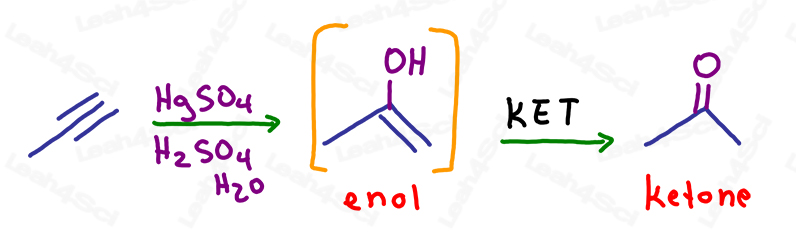
Zoals bij alkenen breekt de oxymercuratie-reactie eenvoudig EEN pi binding om een alcohol toe te voegen aan de meer gesubstitueerde koolstof, volgens de regel van Markovnikov.
Het resulterende molecuul heeft nog steeds één pi binding: een alkeen op dezelfde koolstof als de alcohol.
Dit is een onstabiel enol en zal automatisch keto enol tautomerisatie ondergaan om een stabieler keton eindproduct te vormen.
KET in Hydroboratie van Alkynen
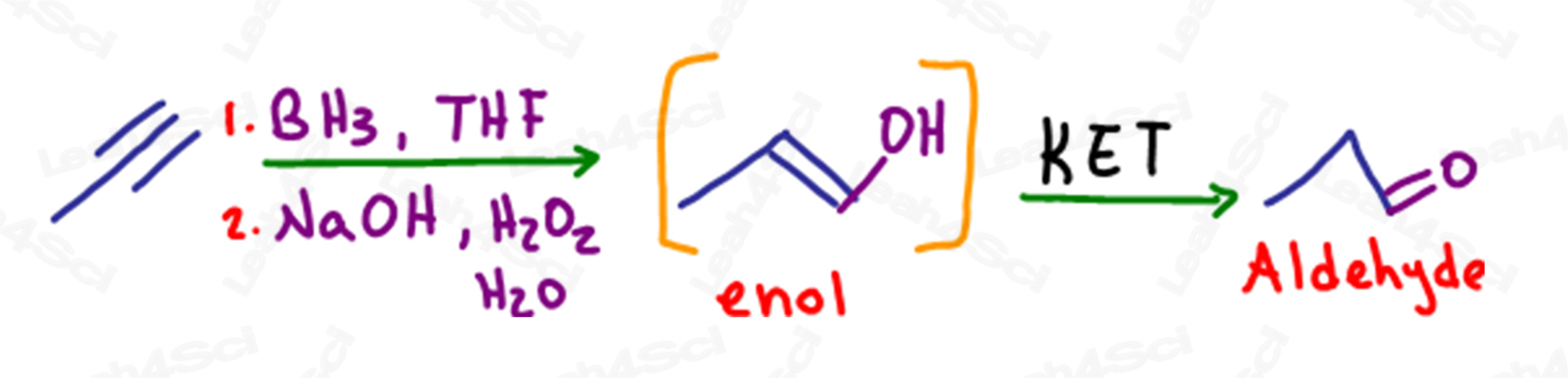
Zoals bij alkenen is hydroboratie een anti-Markovnikov-reactie waarbij een pi-binding wordt verbroken en een alcohol wordt toegevoegd aan de minder gesubstitueerde koolstof.
In het geval van een eindalkyne, wanneer een enkele pi binding wordt omgezet in een alcohol, heeft de eindkoolstof nog steeds een pi binding of alkeen, waardoor het een enol wordt.
Dit molecuul zal ook tautomerisatie ondergaan om een stabieler aldehyde product te vormen.
Ondanks de vorming van een aldehyde, wordt deze reactie nog steeds beschouwd als Keto enol tautomerisatie.
Voor deze 2 reacties wordt de resulterende keton of aldehyde bepaald door de plaats van het enol.
Als het enol zich op een interne (niet-terminale) koolstof bevindt, zal het resulterende product een keton vormen.
Als het enol terminaal is, dan zal het resulterende carbonyl een aldehyde zijn.
Tautomerisatie kan zowel in zuur-gekatalyseerde als in base-gekatalyseerde omstandigheden plaatsvinden.
Bedenk bij bovenstaande reacties wat de omstandigheden moeten zijn na het ondergaan van hydratatie zoals geschreven.
De onderstaande video loopt stap voor stap door
- Zuur-gekatalyseerde tautomerisatiereactie en -mechanisme
- Base-gekatalyseerde tautomerisatiereactie en -mechanisme
- De omgekeerde reactie (keto naar enolvorm) voor beide reacties
Zuur-gekatalyseerd tautomerisatiemechanisme
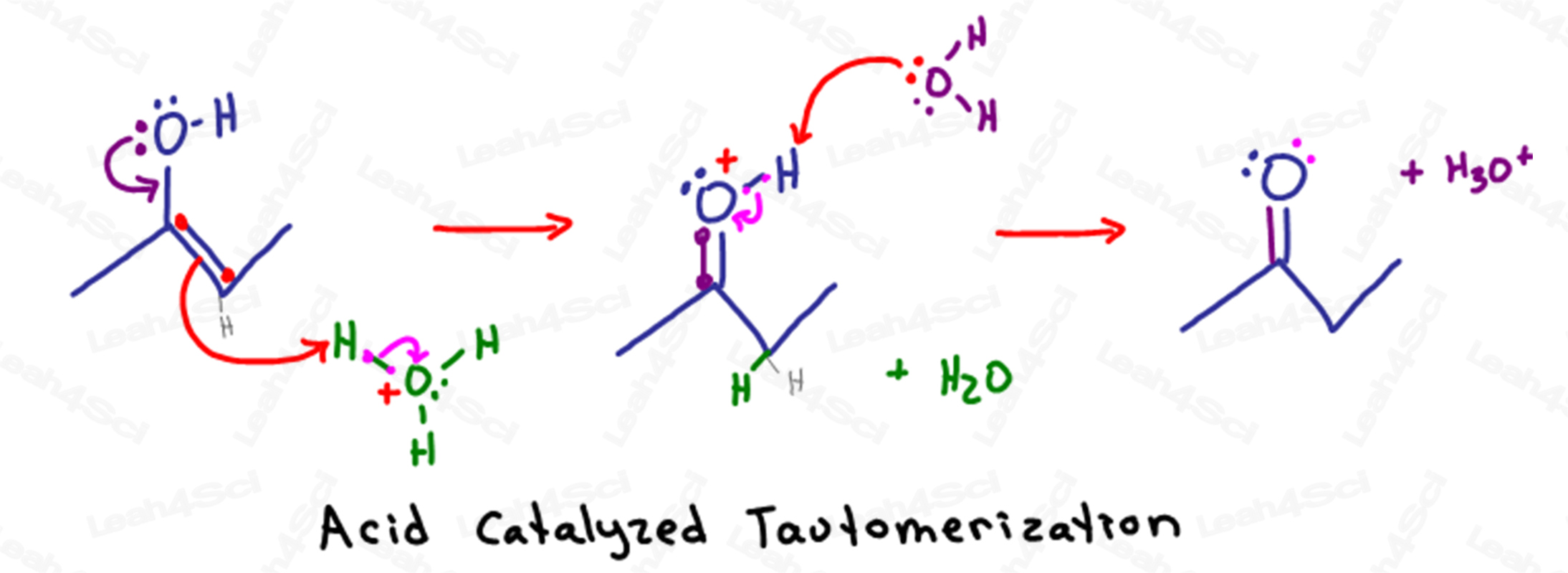
Bedenk dat we in zure waterige oplossingen veel water en hydronium (H3O+) in oplossing beschikbaar hebben.
Tautomerisatie begint wanneer de gedeeltelijk negatieve elektronen op de zuurstof van de alcohol naar beneden reiken om het sp2 koolstofatoom aan te vallen (het atoom dat de pi binding bevat).
Bij het vormen van een tweede binding tussen koolstof en zuurstof, zou koolstof in totaal 5 bindingen hebben.
Om te voorkomen dat het octet wordt verbroken, zal koolstof de pi binding tussen zichzelf en het andere sp2 koolstofatoom verbreken en de elektronen naar de andere koolstof duwen.
In plaats van als een eenzaam paar op koolstof te zitten, worden de negatieve elektronen aangetrokken door het gedeeltelijk positieve H+ atoom op een nabijgelegen hydronium molecuul.
Omdat dat H+ atoom maar één binding kan hebben, laat het de elektronen los die het aan zuurstof vasthouden, waardoor water in oplossing kan wegdrijven.
Het resulterende molecuul lijkt op een keton, behalve het onstabiele zuurstofatoom.
Zuurstof, met 2 bindingen aan koolstof, 1 binding aan waterstof, en een enkel lone pair, heeft een onstabiele positieve lading.
Een ander watermolecuul in oplossing gebruikt zijn gedeeltelijk negatieve elektronen om het zuurstof te deprotoneren, zodat het zijn elektronen teruggeeft en een neutraal, stabiel keton vormt.
Laten we even snel rekenen.
Deze reactie begon toen het enol hydronium, onze zure katalysator, aanviel.
In de laatste stap deprotoneert water het keton, waardoor onze zure hydroniumkatalysator weer reformeert.
Herinnering: als het enol terminaal is, is het resulterende product een aldehyde in plaats van een keton
Base-gekatalyseerd Tautomerisatie Mechanisme Overzicht
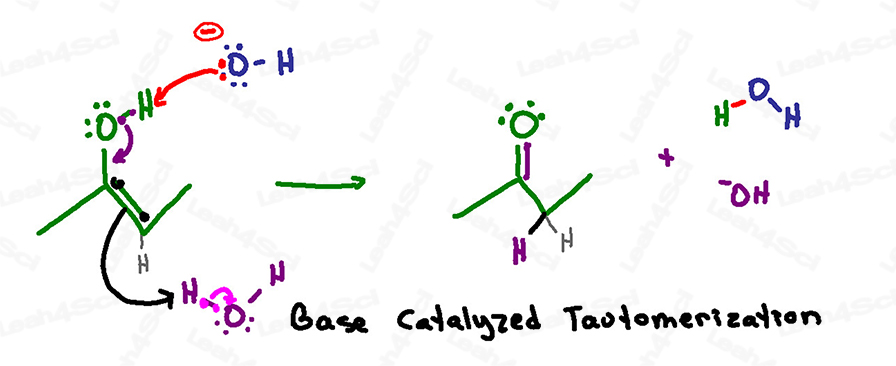
Herinnering: in een basische waterige oplossing hebben we zowel hydroxide als water rondzweven.
Nooit H+ of hydronium in een basische oplossing!
Deze reactie lijkt erg op het zuur-gekatalyseerde mechanisme, behalve dat deprotonatie de eerste in plaats van de laatste stap is.
Dit komt omdat de basische oplossing wel een negatieve zuurstof aankan, maar de zure oplossing geen negatieve zuurstof laat ontstaan.
Deze reactie begint wanneer een basisch hydroxide in oplossing naar de zure waterstof op het enol grijpt.
In plaats van terug te vallen op zuurstof om een negatief oxide te vormen, vallen de elektronen snel naar beneden om een carbonyl pi binding te vormen tussen koolstof en zuurstof.
Zoals bij het zuur-gekatalyseerde mechanisme, moet koolstof zijn huidige dubbele binding uitschakelen om te voorkomen dat hij 5 bindingen heeft en zijn octet schendt.
De elektronen van de pi-binding blijven niet op de andere koolstof zitten wachten, maar zoeken en grijpen een proton uit de oplossing – ze grijpen het van een watermolecuul.
In één serie aanvallen (één stap) hebben we een keton als ons eindproduct.
Let op wat er in deze reactie is gebruikt en hervormd:
Hydroxide heeft een proton gepakt en water gevormd,
Maar het enol heeft een proton van water gepakt en hydroxide gevormd en zo de basische katalysator hervormd die deze reactie in gang heeft gezet.
Houd in gedachten: als het enol terminaal is, is het resulterende product een aldehyde in plaats van een keton