Serous PED in AMD
Retinale pigmentepithelial detachment (PED) maakt deel uit van het klinische spectrum van leeftijdsgebonden maculadegeneratie (AMD).
Er zijn echter verschillende soorten PED gerapporteerd in de literatuur en ze zijn al dan niet gerelateerd aan AMD.
Sereuze PED wordt gedefinieerd als een gebied van scherp begrensde, koepelvormige sereuze verhevenheid van het retinale pigmentepitheel (RPE). De histopathologie van sereuze PED is consistent met de loslating van het RPE-basismembraan, samen met het overliggende RPE van het resterende Bruch’s membraan als gevolg van vochtophoping(1).
De aanwezigheid van deze laesie is een negatieve prognostische factor voor AMD in termen van gezichtsscherpte.
Hoewel er tot op heden geen definitieve therapeutische indicaties zijn vastgesteld, is vroege detectie van sereuze PED belangrijk voor de prognose en het management van patiënten met AMD.
In AMD kan sereuze PED al dan niet geassocieerd zijn met choroidale nieuwe vaten (choroidale neovascularisatie – CNV). Het gevasculariseerde type wordt echter verreweg het meest waargenomen.
Er zijn verschillende theorieën over de relatie tussen sereuze PED en CNV voorgesteld.
Om de pathogenese te verklaren, theoretiseerde Gass de groei van nieuwe vaten vanuit het choroïd (Type 1 neovascularisatie (NV)) binnen de Bruch’s membraandikte, die actief lekken, waardoor de hydrostatische druk toeneemt en RPE-onthechting tussen de minder hechtende lagen wordt veroorzaakt(2).
Dit concept werd later ondersteund door het bewijs dat de ontwikkeling van CNV gepaard gaat met ontstekingsmechanismen die meer schade toebrengen aan het membraan van Bruch, waardoor RPE loslating van de binnenste collagene laag wordt ondersteund(3-5).
Wanneer de groei van nieuwe vaten vanuit het binnenste netvlies begint, recentelijk beschreven als Type 3 NV en ook bekend als retinale angiomateuze proliferatie (RAP), is de hypothese geopperd dat de sereuze PED-vorming, die zeer frequent optreedt, in verband kan worden gebracht met RPE-invasie door het neovasculaire complex6-8).
Daarentegen hebben andere auteurs opgemerkt dat de aanwezigheid van PED een reeds bestaande aandoening kan vertegenwoordigen die de groei van CNV kan bevorderen door een verdere beschadiging van het Bruch’s membraan, uitdrukking van dezelfde voortgaande ziekte(9,10).
Hoewel de pathogenese van de PED niet volledig wordt begrepen, lijkt uit deze studies de vorming van NV een scharniermoment te zijn.
Bij fundusonderzoek verschijnt sereuze PED als een rond of ovaal, duidelijk koepelvormig gebied van regelmatige onthechting van de RPE en het bovenliggende neurosensore retina, met gele tot oranje kleur en glad oppervlak. De randen zijn doorgaans scherp begrensd; en focale RPE atrofie en pigmentfiguren worden vaak waargenomen(9,11).
De gelijktijdige aanwezigheid van NV kan echter een verscheidenheid aan geassocieerde oftalmoscopische aspecten genereren, zoals hemorragische en exudatieve componenten, gebieden van onregelmatige verhoging van het RPE en sereuze loslating van de omliggende neuroretina.
De presentatie van NV type 1 aan de rand van de PED kan variëren, meestal resulterend in een reniform of ingekerfd aspect, of een vlakzijdige RPE-detachering(12).
Sereuze PED kan worden afgebeeld met fluoresceïne-angiografie (FA), indocyaninegroen-angiografie (ICGA) en optische coherentietomografie (OCT).
FA vertegenwoordigt echter de gouden standaard voor de diagnose van sereuze PED.
Bij onderzoek met FA vertoont sereuze PED klassiek een vroege uniforme hyperfluorescentie van de gehele laesie, enigszins vertraagd ten opzichte van de achtergrondfluorescentie, die progressief in helderheid toeneemt naarmate het onderzoek vordert (pooling).
Sereuze PED-hyperfluorescentie verandert doorgaans niet van grootte of vorm tijdens de angiografische fasen.
FA kan ook de aanwezigheid van NV aantonen, gewoonlijk geassocieerd met sereuze PED als type 1 NV, als gebieden van onduidelijke late subretinale kleuring, duidelijker wanneer deze zich aan de rand van de RPE-detachering bevinden of overeenkomen met de “inkeping”(11).
De aanwezigheid van NV kan ook worden afgeleid uit de aanwezigheid van een hemorragische component van de PED, de donkere meniscus beschreven door Gass(12).
Echter, een meer precieze lokalisatie van de neovasculaire component kan worden verkregen met digitale ICGA. Indocyanine groen molecuul heeft biofysische eigenschappen die, in tegenstelling tot fluoresceïne, het nuttig maken om de anatomie van de vaten door RPE, bloed en troebele exsudatie te verbeteren.
In detail, ICGA maakt het mogelijk om de aanwezigheid en het type van nieuwe vaten geassocieerd met een sereuze PED beter af te bakenen, en om deze reden wordt het beschouwd als een fundamenteel hulpmiddel bij de behandeling van deze ziekte(13-15).
Op ICGA, verschijnt sereuze PED als een hypofluorescerende laesie, met scherp begrensde marges, die constant hypofluorescerend blijft tijdens alle fasen van het onderzoek(16).
Wanneer de nieuwe vaten niet aanwezig zijn, zijn er geen tekenen van gelokaliseerde hyperfluorescerende gebieden waarneembaar; de omtrek van de PED is scherp rond en het wordt daarom beschouwd als een zuiver sereuze PED.
In AMD patiënten, vond Yannuzzi een incidentie van 4% van niet-gevasculariseerde PED onder sereuze PED(15).
Wanneer de neovasculaire component aanwezig is, is de term gevasculariseerde PED voorgesteld(15),.die goed is voor ongeveer 24% van de nieuw gediagnosticeerde exudatieve AMD(17).
Nieuwe vaten geassocieerd met sereuze PED zijn vertegenwoordigd in verschillende subtypes.
High-speed videoangiografie met scanning laser oftalmoscope blijkt een kostbaar instrument dat de oogarts in staat stelt om het nieuwe vaatpatroon en hun angiografische gedrag te identificeren(18).
Herkenning van de verschillende typen NV, door het onderscheiden van angiografische bevindingen, is verplicht voor het verschillende natuurlijke beloop, de visuele prognose en de verschillende reactie op de behandeling van de drie belangrijkste soorten nieuwe vaten die geassocieerd zijn met sereuze PED bij AMD.
Het meest voorkomende type nieuwe vaatjes bij sereuze PED zijn die welke vanuit het vaatvlies onder de RPE-monolaag ontstaan(15-,17).
Deze nieuwe bloedvaten zijn onlangs geclassificeerd als Type 1 NV en zijn verreweg het meest voorkomende type NV bij AMD(19)(figuur 1).

Figuur 1 – Gevasculariseerde PED met Type 1 NV. (A) FA, (B)ICGA en (C) OCT.
In de vroege fasen toont ICGA de NV-voedingsslagader die ontspringt uit de choroïdale circulatie, en vervolgens de drainerende venule.
Tegelijkertijd kan het capillaire netwerk van het neovasculaire membraan worden gedetecteerd.
In tegenstelling tot fluoresceïne lekt indocyaninegroen weinig en is de NV-hyperfluorescentie gewoonlijk minimaal, met uitzondering van enkele gevallen die een intense lekkage vertonen, die als zeer actieve nieuwe vaten worden beschouwd.
Vaak, in de late fasen, kan een goed gedefinieerde zone van milde hyperfluorescentie die overeenkomt met het NV netwerk waarneembaar zijn.
Het tweede type van nieuwe vaten die serieuze PED compliceren zijn de RAP(7,20-22), ook wel aangeduid als Type 3 NV(19).
Deze vasculaire laesies, zoals gerapporteerd door verschillende auteurs, kunnen het buitenste netvlies en de RPE aantasten, via een progressie waarvan wordt verondersteld dat ze voortkomt uit de retinale circulatie en/of het vaatvlies.
ICGA toont gewoonlijk de aanwezigheid van een “hot-spot”, te wijten aan de vroege hyperfluorescentie van het intraretinale neovasculaire complex, die toeneemt tijdens de angiografie, met een intense lekkage in de late fasen.
De helderheid ervan wordt versterkt door de omringende hypofluorescentie van de onderliggende PED (figuur 2).
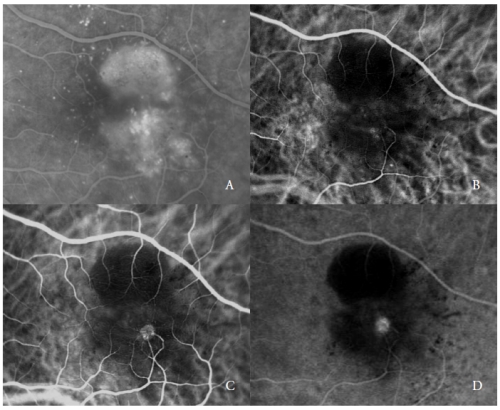
Figuur 2 – Gevasculariseerde PED met NV type 3 (RAP). FA (A) en ICGA vroege (B) en late fasen (C en D).
In de late stadia van de ziekte is het choroidale neovasculaire complex typisch verbonden met een of meer netvaatjes die er kronkelig en verwijd uitzien(7,22,23).
Het type 3 NV kan enkelvoudig of meervoudig zijn, zijn oorsprong is typisch extrafoveal, en een intraretinale bloeding in overeenstemming met de neovasculaire laesie wordt vaak waargenomen(20).
Het derde type nieuwe vaten geassocieerd met sereuze PED in AMD komt overeen met polypoidale choroidale vasculopathie (PCV)(24).
PCV is een eigenaardige vorm van CNV, gekenmerkt door de aanwezigheid van oranje, aneurismale, poliepachtige ronde dilataties aan de rand van een vertakkend vaatnetwerk van choroidale oorsprong.
Hoewel PCV vaker voorkomt bij zwarte en Aziatische bevolkingsgroepen van middelbare leeftijd, is het klinische spectrum uitgebreid tot blanken, waar het aanwezig bleek te zijn bij 8-13% van de patiënten met gelijktijdige AMD laesies.
In deze gevallen, wanneer de manifestaties die kunnen worden toegeschreven aan zowel PCV als AMD aanwezig zijn, beschouwen sommige auteurs PCV als een subtype van CNV bij AMD(24,25).
Hemorrhagische manifestatie komt vaak voor bij patiënten met PCV.
Serieuze PED geassocieerd met PCV vertoont vaak een bloedspiegel in het onderste deel van het detachement.
ICGA is het state-of-the-art onderzoek om de typische kenmerken van de twee vasculaire componenten te onderscheiden.
Het vasculaire netwerk wordt gekenmerkt door de aanwezigheid van een of meer aneurismale laesies die een heldere fluorescentie vertonen sinds de vroege fasen, in de late fasen gevolgd door een opheldering van de kleurstof, “wash-out” genoemd, typisch voor deze ziekte (figuur 3).
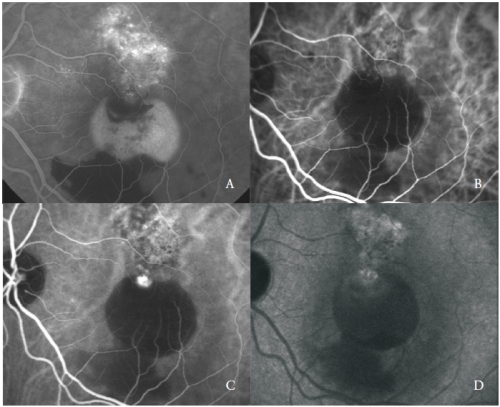
Figuur 3 – Gevasculariseerde PED met PCV: FA (A) en vroege (B), midden (C) en late (D) fasen van ICGA.
Niettemin kunnen sommige poliepachtige structuren actief lekken, waarbij late kleuring van hun wanden en omringende exsudatie wordt waargenomen.
De polypoïdale laesies bevinden zich meestal aan de rand van de sereuze PED(26).
Herkenning van deze laesies is van cruciaal belang vanwege hun afwijkende klinische beloop, prognose en behandelingsrespons in vergelijking met de andere neovasculaire AMD-subtypen.
OCT levert beelden die een exacte correlatie met de angiografische bevindingen mogelijk maken.
In transversale OCT scans, verschijnt sereuze PED als een optisch lege koepelvormige verhoging van de externe hoge reflecterende band – de RPE, die steil loskomt van Bruch’s membraan(26).
Het bovenliggende netvlies, gewoonlijk vastgehecht aan de bulleuze PED, aan de randen van de laesie, kan lichtjes loskomen van de onderliggende RPE.
Meer aanvullende informatie kan worden verkregen door OCT in gevasculariseerde PED(28).
De tomografische doorsneden, geleid door FA en ICGA in het gebied dat overeenkomt met de CNV, tonen een gladdere elevatie van het RPE, continu met de sereuze detachment, met een diepere backscattering, te wijten aan de aanwezigheid van het fibrovasculaire weefsel.
Hyporeflecterende gebieden van homogene optisch lege ruimten die verwijzen naar vochtophoping zijn vaak aanwezig in de intraretinale en subretinale ruimten(29).
Intraretinale optisch lege ruimten zijn meer uitgesproken wanneer de sereuze PED geassocieerd is met een Type 3 NV, vooral met cysteuze vorm (figuur 4).
Door de scanlijn te positioneren die overeenkomt met de “hot-spot”, wordt de neovasculaire afwijking voorgesteld als een dichte of hyperreflecterende pre-epitheliale zone in de binnenste retinale lagen, waar de buitenste hyperreflecterende lagen niet langer detecteerbaar zijn(30).
De RPE in de buurt van die laesie vertoont vaak effracties of onderbrekingen in zijn hyperreflecterende laag(31).
De retinale topografische meting houdt een verhoogde retinale dikte aan.
In ogen met sereuze PED en PCV, vertonen de polypoïdale laesies een scherpe uitstulping van RPE, vergelijkbaar met de PED maar steil hellend.
De poliepholte, meestal optisch leeg, grenst aan onregelmatige RPE-elevatie, uitdrukking van de occulte neovasculaire component van de laesie(32,33).
Subretinale en intraretinale vloeistof, waargenomen als hypofluorescerende optisch lege gebieden, zijn gerelateerd aan de PCV-activiteit (figuur 4-B).
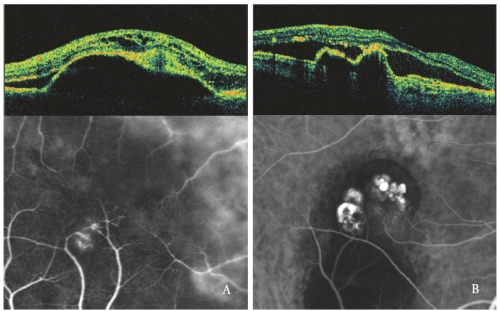
Figuur 4 – Type 3 NV (RAP) (links) en PCV (rechts): OCT en ICGA patronen.
De recente introductie van OCT angiografie (OCT-A) heeft het mogelijk gemaakt perfusie van de verschillende retinale lagen in beeld te brengen, zonder injectie van de kleurstof en door gebruik te maken van endoluminale flow als intrinsiek contrast.
Figuur 5 geeft een voorbeeld van hoe OCT-A het choroidale netwerk in een geval van PCV in beeld brengt.
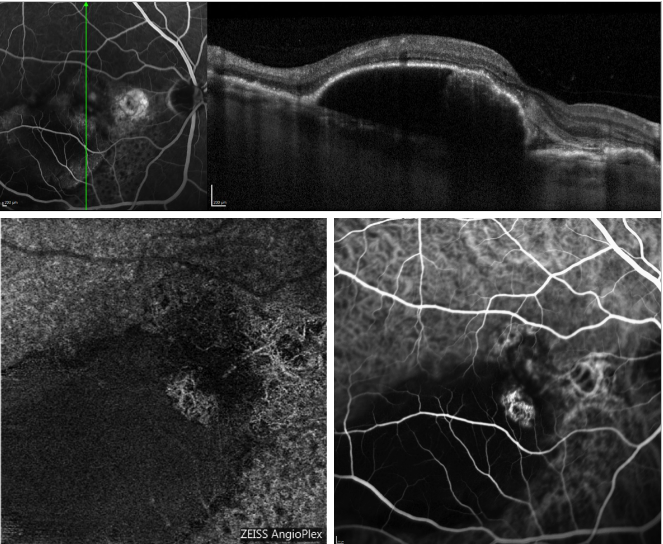
Figuur 5 – Serous PED en recurrent PCV (FA, OCT, ICGA en OCT-A). Boven: OCT-scan, gelijktijdig verkregen met FA; onder: profiel van de poliepen op OCT-A (links) en ICGA (rechts).
Het statische karakter van dit onderzoek en de aanwezigheid van mogelijke artefacten zijn echter belangrijke beperkingen die moeten worden erkend.
Bij sereuze PED kan schaduwvorming door verlies van signaaloverdracht in overeenstemming met de PED de detectie van het CNV-complex op OCT-A bemoeilijken (figuur 6).
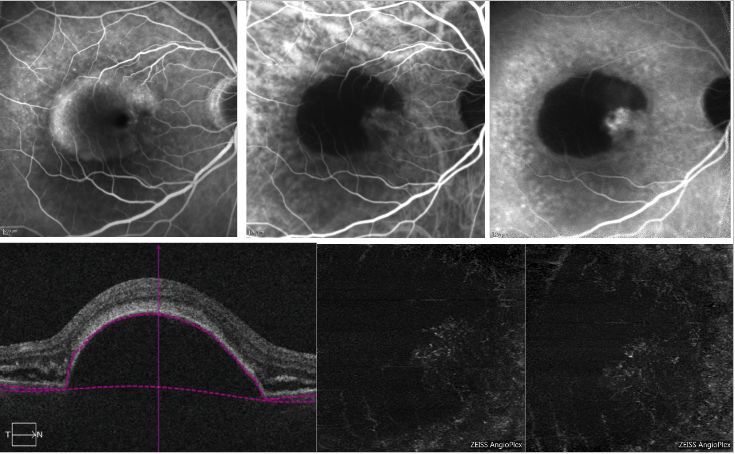
Figuur 6 – Gevasculariseerde PED en sereuze PED met NV type 1 (FA, ICGA en OCT-A) . Boven: FA (links) toont pooling van kleurstof door de aanwezigheid van een sereuze PED; ICGA (middenboven en rechts) toont een neovasculair netwerk aan de rand van de PED (inkeping); Onder: OCT-A geeft geen duidelijk beeld van het neovasculaire netwerk.
Het natuurlijk beloop van sereuze PED hangt af van het al dan niet aanwezig zijn van de neovasculaire component(34).
Bij zuivere sereuze PED is er over het algemeen een langzame uitbreiding van de laesie, met een minimale progressie van het gezichtsverlies over een lange periode (maanden of jaren).
Velen kunnen echter vervolgens neovascularisatie ontwikkelen, waardoor het verergert(35).
Het natuurlijke beloop bij gevasculariseerde PED kan variëren, en het is gerelateerd aan het type nieuwe vaten dat geassocieerd is.
De meest voorkomende acute complicatie van PED is het scheuren van de RPE(36-39).
Het treedt gewoonlijk op aan de rand van de PED, op de kruising van de losgemaakte en vastzittende RPE.
Klinisch verschijnt een RPE scheur of rip als een goed gedefinieerd gebied van kaal choroid, grenzend aan een donkerder gehyperpigmenteerd rugate gebied, dat overeenkomt met de heuvel van de RPE die is weggescheurd(40,41).
De afgescheurde RPE rolt gewoonlijk naar het CNV toe, en de neiging ervan om te scheuren kan worden voorspeld door de waarneming van pre-tear kenmerken, zoals een toename in de grootte en een verandering in de vorm, de aanwezigheid van kleine gaatjes bij de PED marges, de aanwezigheid van bloedingen of subretinale vloeistof, maar de meest opmerkelijke aspecten zijn de onregelmatige vulling van de PED die zichtbaar is bij de FA, hoogte van de PED > 580 nm, duur > 4.5 maanden, hyperreflecterende radiale lijnen op nabije reflectiebeeldvorming, kleinere verhouding van gevasculariseerde PED en anti-vasculaire endotheliale groeifactor (anti-VEGF) therapie(42-46).
RPE scheuren treedt spontaan op of na een behandeling, formeel laser fotocoagulatie, fotodynamische therapie en intravitreale injectie van steroïden of anti-VEGF middelen(47- 58).
De precieze pathogenese van RPE-scheuren is slecht begrepen.
Met betrekking tot het natuurlijke beloop van PEDs is verondersteld dat tangentiële schuifkrachten in de PED de breuk van het RPE-keldermembraan aan de rand van de onthechting kunnen veroorzaken; het is echter waarschijnlijker dat dit het gevolg is van verschillende variabelen, waarbij de aanwezigheid van een CNV een belangrijke rol speelt.
Er zijn verschillende oorzakelijke verbanden gemeld voor RPE-scheuren die na behandeling optreden, waaronder de warmte die door fotocoagulatie wordt opgewekt, de abrupte toename van intra-PED vloeistof, een samentrekking van het geassocieerde CNV en de gelijktijdige plotselinge oplossing van de sub-RPE vloeistof.
De gecombineerde aanwezigheid van vitreomaculaire tractie en de vervorming van de oogbol als gevolg van het mechanische trauma door de naald zijn ook gemeld als oorzakelijke factoren(59).
Na RPE scheuren, klaagt de meerderheid van de patiënten over een plotselinge ernstige visuele achteruitgang.
In een klein percentage van de ogen, waar de scheur de fovea spaart, kunnen patiënten een tijdelijk behoud van een goede visuele functie ervaren(60).
Op lange termijn echter, leidt de progressie van een subretinaal litteken tot een ernstige visuele achteruitgang. Bij de prognose van sereuze PED moet ook rekening worden gehouden met het hoge risico van bilaterale betrokkenheid(61).
Behandeling van sereuze PED, al dan niet geassocieerd met CNV, is altijd een uitdaging geweest en tot nu toe zijn er geen aanbevolen richtlijnen voor hun behandeling.
Pure sereuze PEDs zijn in het verleden behandeld met laser grid of scattered photocoagulation, maar met teleurstellende resultaten(61).
Behandeling van sereuze PED, al dan niet geassocieerd met CNV, is altijd een uitdaging geweest en er zijn tot nu toe geen aanbevolen richtlijnen voor hun behandeling. Zuivere sereuze PED’s zijn in het verleden behandeld met laser grid of verspreide fotocoagulatie, met teleurstellende resultaten(62).
Er zijn geen andere benaderingen geprobeerd om deze laesies te behandelen.
Wanneer een neovasculair net aanwezig is, is de behandeling van sereuze PED gericht geweest op CNV-beheer. Aangezien gevasculariseerde PED’s echter nooit zijn opgenomen in de grote gerandomiseerde gecontroleerde onderzoeken, moeten we de behandelingsbeslissing baseren op kleine gepubliceerde reeksen, die vaak retrospectief zijn en verschillende therapeutische benaderingen omvatten.
Nu, in het tijdperk van de anti-VEGF therapie, lijken alle tot nu toe toegepaste behandelingen niet meer te voldoen.
Fotocoagulatie met laser is op grote schaal toegepast en kan nog steeds een beperkte indicatie hebben wanneer een ICGA-goed gedefinieerd CNV ver van het losgemaakte RPE ligt(63).
Verteporfin fotodynamische therapie (PDT) alleen is schadelijk gebleken, het verhoogt het risico van RPE scheuren, bloedingen en plotselinge gezichtsscherpte afname(39,48,49,64) (figuur 7).
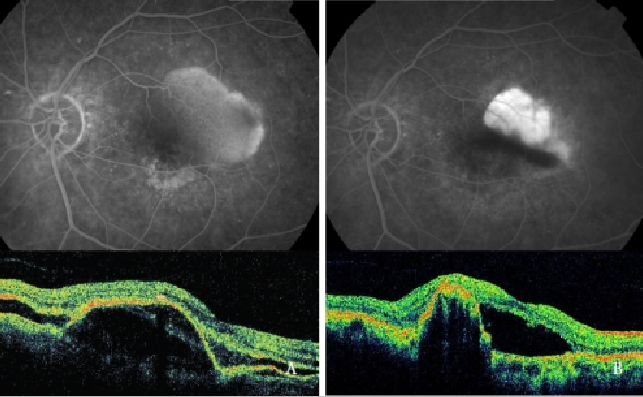
Figuur 7 – Gevasculariseerde PED met CNV (type 1 NV) vóór (links) en na (rechts) PDT: RPE scheur (FA en OCT).
Echter, PDT gecombineerd met intravitreale triamcinolone acetonide injectie (IVTA) is aangetoond dat het mogelijk is de gezichtsscherpte te stabiliseren en recidieven te verminderen(65).
Niettemin heeft het hoge risico op complicaties (cataract en glaucoom) het gebruik van intravitreale triamcinolone verminderd.
Na de bemoedigende resultaten verkregen met de anti-VEGF intravitreale therapie bij de behandeling van occulte CNV, is het gebruik van anti-VEGF behandeling uitgebreid tot gevasculariseerde PED met teleurstellende resultaten(66-69).
Zowel acute complicaties als slechte anatomische respons op de behandeling maken onze pogingen om de laesie te genezen vaak ongeldig. RPE scheuren en subretinale bloedingen zijn gemeld als complicaties bij intravitreale behandelingen met ranibizumab en bevacizumab(51-57).
Daarnaast reageert de sub-RPE vloeistof nauwelijks op de anti-VEGF therapie, mogelijk als gevolg van de hydroconductiviteitsveranderingen van Bruch’s membraan(69).
In een retrospectieve case-serie van 328 patiënten die werden behandeld met respectievelijk bevacizumab, ranibizumab, pegaptanib en PDT+IVTA, na een gemiddelde follow-up van 42,4 weken, meldden de auteurs een significante stabilisatie van de gezichtsscherpte in elke groep, beter in die met bevacizumab en ranibizumab in vergelijking met de andere twee, en een totale RPE-scheurfrequentie van 12.5%.
Zij concluderen echter dat met deze behandelingen slechts een gedeeltelijke regressie van de laesies kan worden verkregen, en dat het risico van RPE scheuren niet wordt vermeden(69).
Een andere retrospectieve studie(58). beoordeelde de patiëntenuitkomsten van gevasculariseerde PED behandeld met PDT alleen, PDT gecombineerd met IVTA of intravitreale anti-VEGF injecties alleen (bevacizumab of ranibizumab) en toonde betere functionele resultaten voor de anti-VEGF behandelingsgroep.
Meer, in deze serie vertoonde Type 1 NV met gevasculariseerde PED in vergelijking met Type 3 NV, samen met een betere gezichtsscherpte bij baseline, een groter risico op acute RPE scheur na behandeling(58).
In een recente prospectieve studie(19), behandeling van PED geassocieerd met subfoveale Type 1 NV met intravitreale ranibizumab injectie en met een 3-maandelijkse laadfase en een pro re nata strategie leidde tot slechts gedeeltelijke resultaten over een 24-maand follow-up.
Recentelijk hebben verschillende studies de werkzaamheid onderzocht van intravitreale aflibercept therapie van PED bij AMD die een goede anatomische respons lieten zien met verbetering of geen significante verandering in gezichtsscherpte(70-73).
Daarnaast is aangetoond dat intravitreale aflibercept een veelbelovende behandeling is bij PED die resistent is voor intravitreale ranibizumab behandeling(72-74).Verschillende studies hebben factoren geïdentificeerd die de respons van PED op anti-VEGF behandeling zouden kunnen beïnvloeden(75-78).
Dirani et al.(75) toonden aan dat een betere visuele verbetering geassocieerd was met een lagere gezichtsscherpte op baseline, aanwezigheid van subretinale vloeistof en RAP. Bovendien was in hun serie PED-reductie geassocieerd met een hogere PED bij baseline, overwegend sereuze PED en gebruik van aflibercept.
Cho et al.(76) vonden in een recente case-serie dat een lagere PED-hoogte bij baseline, PCV of RAP in vergelijking met typische neovasculaire AMD, sereuze PED in vergelijking met fibrovasculaire PED, en aflibercept in vergelijking met ranibizumab, een hogere kans hebben op PED-resolutie tijdens anti-VEGF-behandeling van PED’s.
Echter, in een recente post hoc analyse van een fase III gerandomiseerde gecontroleerde studie(77), is aangetoond dat, op 24 maanden na de start van anti-VEGF behandeling, ongeveer de helft van de patiënten met PED op baseline een volledige resolutie van PED vertoonden, ongeacht de PED status en lengte op baseline.
Recentelijk hebben Chen et al.(78) gewezen op het belang van het differentiëren van ogen met RAP, aangezien zij betere anatomische en functionele resultaten hebben met minder injecties in vergelijking met PED met type 1 NV.
In de toekomst zullen nieuwe combinatietherapieën en nieuwe therapeutische strategieën, samen met de identificatie van nieuwe klinische biomarkers voor de respons op behandeling, helpen om de prognose van de patiënten die zijn getroffen door gevasculariseerde PED te verbeteren.