Cara Gormally’s zwangerschap werd overschaduwd door verdriet. Als homoseksuele vrouw met een kinderwens dacht de biologieprofessor dat het vinden van een spermadonor het enige obstakel zou zijn voor haar en haar partner. Maar dankzij Gormally’s organisatietalent en liefde voor het maken van lijsten, vond het stel met relatief gemak een donor.
Toen worstelde Gormally om zwanger te worden. Elke maand bracht nieuwe teleurstelling en verlies.
“Zo veel van het proces hing af van willekeurig, hartverscheurend toeval,” zegt ze. De emotionele en financiële achtbaan was uitputtend.
Maar dat was niet het moeilijkste deel. Het stel had geaccepteerd dat, hoe graag ze ook een baby wilden, hun kind niet biologisch verwant zou zijn aan Gormally’s echtgenoot.
“Ik treurde dat ons kind niet genetisch verwant zou zijn aan ons beiden,” zegt Gormally. “Ik verlangde naar het biologisch onmogelijke.”
Maar nu kunnen nieuwe technologieën verandering brengen in wat mogelijk is – zodat partners van hetzelfde geslacht kinderen kunnen krijgen die hun genetisch materiaal delen, net als heterostellen.
Onvoorstelbaar
Bij zoogdieren heeft vrijwel elke cel in het lichaam twee sets genetisch materiaal. De ene set is afkomstig van moeder, de andere van vader. Eieren en sperma zijn de enige uitzonderingen; zij hebben maar één set. Wanneer een zaadcel een eicel bevrucht, worden die twee sets gecombineerd, waardoor het gebruikelijke aantal van twee sets per cel wordt hersteld.
Gormaal en andere partners van hetzelfde geslacht worden momenteel uit hun dromen geweerd door een fenomeen dat genomische inprenting wordt genoemd. Hierbij wordt het DNA dat zoogdieren aan hun nakomelingen doorgeven, gemarkeerd met een markering van elke ouder. Dit proces zorgt ervoor dat we voor een klein percentage van de genen alleen de kopie van het genetisch materiaal van onze moeder of onze vader tot expressie brengen. Wanneer dit inprentingsproces misgaat, kunnen kinderen inactieve gengebieden krijgen die miskramen, ontwikkelingsstoornissen en kanker veroorzaken.
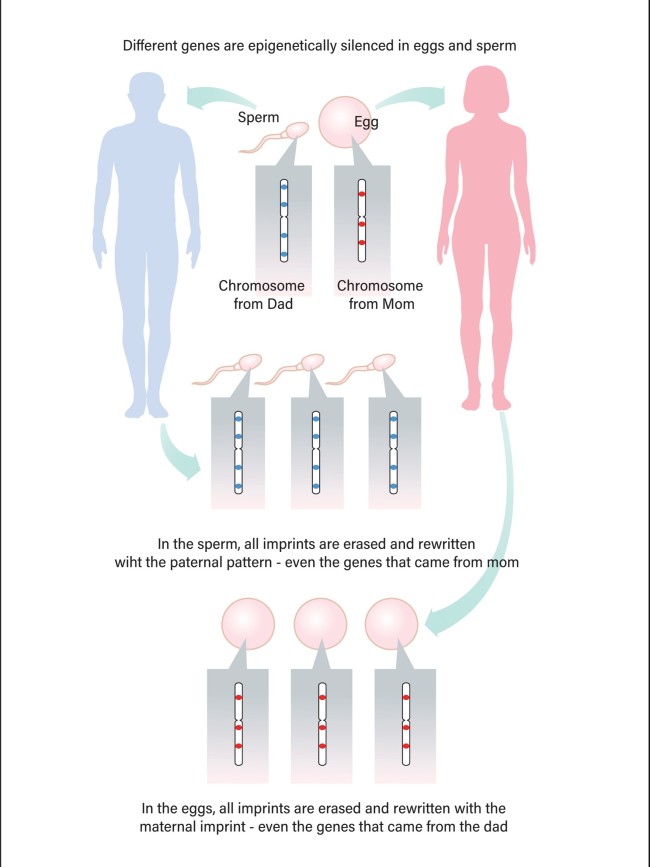
Tijdens deze genomische inprenting worden bepaalde genen uitgeschakeld door de specifieke verzameling markeringen van de moeder, zodat alleen de kopie van de vader tot expressie komt. En vader brengt zijn eigen markeringen aan die alleen de maternale kopie tot uitdrukking laten komen. (De meeste imprints schakelen genexpressie uit, maar sommige activeren het.) Dat is een probleem voor paren van hetzelfde geslacht die een baby willen. Als beide sets van de genen van een nakomeling afkomstig zijn van het DNA van de moeder, bijvoorbeeld, dan zullen beide kopieën van ingeprente genen uitgeschakeld zijn.
“We krijgen niet de volledige set producten die we nodig hebben voor een goede ontwikkeling, tenzij we zowel een maternale als vaderlijke bijdrage hebben aan een bevruchte eicel,” zegt Marisa Bartolomei, een geneticus aan de Universiteit van Pennsylvania in Philadelphia, die een van de eerste ingeprente genen bij muizen ontdekte.
Wetenschappers ontdekten de genomische inprenting bij zoogdieren zo’n 30 jaar geleden. Tijdens experimenten in het midden van de jaren tachtig verwijderden onderzoekers de genetische bijdragen van de moeder of de vader uit pas bevruchte muizeneieren. Vervolgens brachten zij een tweede set genen van een andere muis in om embryo’s te creëren met ofwel twee sets vrouwelijk genetisch materiaal ofwel twee sets mannelijk genetisch materiaal. Een surrogaatmuis kon de embryo’s drachtig maken, maar geen enkele overleefde. Hieruit bleek dat voor een normale ontwikkeling genetisch materiaal van zowel de vader als de moeder nodig is. Meer dan dat, de uitkomsten toonden aan dat het genetisch materiaal van de moeder en de vader op betekenisvolle manieren van elkaar verschillen.
Later bleek uit experimenten dat muizen zich anders ontwikkelden, afhankelijk van de vraag of ze toevallig beide kopieën van bepaalde regio’s van het DNA van één ouder kregen (in plaats van één kopie van elke ouder).
Muizen met haarspeldvormige staarten waren sprekende voorbeelden. Toen onderzoekers het gengebied dat verantwoordelijk is voor een haarspeldstaart verwijderden uit het genoom van de moeder, werden de muizenembryo’s groot en stierven ze halverwege de zwangerschap. Daarentegen had het verwijderen van dezelfde regio uit het genoom van de vader geen effect op de groei of ontwikkeling van de knaagdieren.
In de drie decennia die sindsdien zijn verstreken, hebben onderzoekers meer ingeprente genen gevonden (zij vermoeden dat er tussen de 100 en 200 van dergelijke genen zijn) en de moleculaire tags die hen het zwijgen opleggen. Wetenschappers hebben ook vooruitgang geboekt bij het leggen van verbanden tussen inprentingsdefecten en ontwikkelingsstoornissen bij mensen. Maar onderzoekers hebben al die tijd geweten dat inprenting ouders van hetzelfde geslacht verhindert kinderen te krijgen.
Editing Out Impossibility
In oktober 2018 overwinden onderzoekers deze onmogelijkheid bij muizen. Door ingeprente regio’s te schrappen, produceerden Wei Li en een team van de Chinese Academy of Sciences in Beijing gezonde muizen van twee moeders. De onderzoekers creëerden ook voor het eerst muizenpups uit twee vaders. De nakomelingen stierven echter al een paar dagen na de geboorte.
Ondanks het verlies is Li optimistisch. “Dit onderzoek laat ons zien wat er mogelijk is,” zegt hij.
Om de barrière van inprenting te overwinnen, wendden Li en zijn collega-onderzoekers zich tot CRISPR, een gen-editing techniek die het veranderen van genomen makkelijker dan ooit heeft gemaakt. Zij gebruikten dit hulpmiddel om gengebieden te verwijderen uit embryonale stamcellen van muizenmoeders. De onderzoekers injecteerden deze gewijzigde stamcellen vervolgens in de eicel van een vrouwtjesmuis en gebruikten vervolgens een derde vrouwelijke draagmoeder om de foetus te voldragen.
Het team had twee jaar eerder al enig succes geboekt toen het muizenpups met twee genetische moeders creëerde door twee ingeprente gebieden te schrappen. Hoewel deze bimaternale muizen ook opgroeiden tot volwassenheid en zelf pups voortbrachten, ontwikkelden ze groeistoornissen. Gemiddeld waren de bimaternale muizen 20 procent lichter dan hun hetero-ouderlijke tegenhangers. In hun laatste studie verwijderden Li en zijn team ook een derde regio uit de genen van de moeders, waardoor de groei van de dieren weer normaal werd.
Maar de wetenschappers moesten nog een paar hordes nemen om muizen met twee genetische vaders te genereren. Met vallen en opstaan ontdekten ze dat ze bij de bipaternale muizen twee keer zoveel ingeprente gebieden moesten verwijderen als bij de bimaternale muizen. In totaal verwijderde het team zeven ingeprente gebieden om met succes muizen van twee vaders te creëren.
Dan nog waren de cijfers niet in hun voordeel. Slechts twee en een half procent van de embryo’s werd voldragen en minder dan een half procent leefde twee dagen. Geen enkele haalde de volwassenheid.
“De geproduceerde bipaternale muizen zijn niet levensvatbaar, wat impliceert dat er meer obstakels moeten worden overbrugd om hun postnatale overleving te ondersteunen, indien mogelijk,” zegt Li. “Het lagere geboortecijfer daarentegen impliceert het bestaan van een onbekende barrière die de ontwikkeling van bipaternale embryo’s belemmert.”
Bij de bimaternale muizen ging het daarentegen veel beter. Deze muizen groeiden op tot volwassenheid en waren gezond genoeg om zelf jongen te krijgen door te paren met typische mannelijke muizen. Ze gedroegen zich ook hetzelfde als de controlemuizen. Voor zover de onderzoekers konden nagaan, leken de bimaternale muizen even gezond en normaal als alle andere laboratoriummuizen.
“Dat wil niet zeggen dat ze in alle opzichten normaal zijn,” waarschuwt Li. “Men kan niet alle aspecten onderzoeken onder beperkte experimentele omstandigheden met een beperkt aantal dieren.”
Ondanks het succes van de onderzoekers, zegt Li dat de techniek niet klaar is voor gebruik bij mensen. “Het is nooit te veel om de risico’s en het belang van veiligheid te benadrukken voor elk menselijk experiment,” zegt hij, vooral met betrekking tot de bipaternale nakomelingen, die momenteel “ernstig abnormaal zijn en niet kunnen overleven tot volwassenheid.”
De bimaternale nakomelingen zijn veelbelovender. Het team werkt nu aan de vertaling van hun bevindingen naar apen. En dat werk zou het onmogelijke een stap dichter bij de haalbaarheid voor mensen kunnen brengen.
Het opnieuw creëren van potentieel
Li’s onderzoek is bemoedigend, maar het is nog ver weg van het helpen van Gormally en haar echtgenote. Het is echter niet de enige kans voor paren van hetzelfde geslacht. Een andere nieuwe technologie, in vitro gametogenese of IVG, kan een alternatief zijn voor paren van hetzelfde geslacht om hun eigen kinderen te krijgen.
Wetenschappers gebruiken de techniek om eicellen en sperma te maken van andere cellen in het lichaam. Om dit te doen, herprogrammeren biologen eerst volwassen huidcellen tot stamcellen. Vervolgens stimuleren ze de van de huid afkomstige stamcellen zich te ontwikkelen tot eicellen of spermacellen.
Onderzoekers uit Japan hebben de techniek nu geperfectioneerd bij muizen. In baanbrekend werk genereerden Katsuhiko Hayashi en Mitinori Saitou en hun team functionele eicellen uit staartcellen van muizen.
De onderzoekers bevruchtten vervolgens de eicellen met sperma van mannelijke muizen en implanteerden de embryo’s in draagmoeders. De nakomelingen groeiden gezond en vruchtbaar op. In principe zou het met deze aanpak mogelijk zijn de huidcellen van een vrouw om te vormen tot sperma en te gebruiken om de eicel van haar partner te bevruchten.
IVG zou de mogelijkheid van paren van hetzelfde geslacht om hun eigen kinderen te krijgen, kunnen veranderen. “Als het toen mogelijk was geweest, hadden we het zeker geprobeerd,” zegt Gormally, die nu de trotse ouder is van een peuter dankzij de spermadonor van haar en haar echtgenoot. “

Dit verhaal maakt deel uit van “De toekomst van vruchtbaarheid”, een nieuwe serie op Discover die de grenzen van de voortplanting verkent. Lees meer:
Kunnen mensen baby’s krijgen in de ruimte?
George Church wil genetische koppeling tot werkelijkheid maken
Het bewerken van menselijke genen is controversieel. Shoukhrat Mitalipov laat zich niet afschrikken