PED perigoso em AMD
Desprendimento epitelial de pigmento retinal (PED) é parte do espectro clínico da degeneração macular relacionada com a idade (AMD).
No entanto, diferentes tipos de DAP foram relatados na literatura e foram relacionados ou não com a DMRI.
DAP grave é definida como uma área de elevação serosa do epitélio do pigmento da retina (RPE), em forma de cúpula, fortemente demarcada. A histopatologia do PED seroso é consistente com o descolamento da membrana do porão RPE, juntamente com o RPE sobrejacente da membrana de Bruch restante devido à acumulação de fluido(1).
A presença desta lesão é um factor de prognóstico negativo para a AMD em termos de acuidade visual.
Embora não tenham sido estabelecidas até agora indicações terapêuticas definitivas, a detecção precoce da DAP serosa é importante para o prognóstico e a gestão de pacientes com DAP.
Na DAP, a DAP serosa pode ser associada ou não a novos vasos coróides (neovascularização coróide – CNV). No entanto, o tipo vascularizado é de longe o mais observado.
Teorias transversais sobre a relação entre a DSP serosa e o VCN foram propostas.
Para explicar a sua patogénese, Gass teorizou o crescimento de novos vasos do coróide (neovascularização tipo 1 (NV)) no interior da espessura da membrana de Bruch, que activamente se libertam, aumentando a pressão hidrostática e causando o descolamento do RPE entre as camadas menos aderentes(2).
Este conceito foi posteriormente apoiado pela evidência de que o desenvolvimento do CNV vem com mecanismos inflamatórios que acrescentam mais danos à membrana de Bruch, suportando a separação do RPE da camada colagénica interna(3-5).
Quando o crescimento de novos vasos começa a partir da retina interna, mais recentemente descrita como NV tipo 3 e também conhecida como proliferação angiomatosa da retina (RAP), foi feita a hipótese de que a formação serosa de PED, que é muito frequentemente associada, pode estar relacionada com a invasão de RPE pelo complexo neovascular6-8).
Por contraste, outros autores observaram que a presença de PED pode representar uma condição pré-existente que pode promover o crescimento do CNV através de um dano adicional da membrana de Bruch, expressão da mesma doença em curso(9,10).
Embora a patogénese da DPE não seja completamente compreendida, a partir destes estudos a formação de NV parece ser um momento fulcral.
No exame de fundo, a DPE serosa aparece como uma área redonda ou oval, em forma de cúpula distinta, de descolamento regular da RPE e da retina neurosensorial sobreposta, de cor amarela a laranja e superfície lisa. As margens são tipicamente demarcadas de forma acentuada; e observam-se frequentemente atrofia focal da RPE e figuras de pigmento(9,11).
No entanto, a presença concomitante de NV pode gerar uma variedade de aspectos oftalmoscópicos associados, tais como componentes hemorrágicos e exsudativos, áreas de elevação irregular da RPE e desprendimento seroso da neuroretina circundante.
Apresentação de NV Tipo 1 localizada na margem da DPE pode variar, geralmente resultando num aspecto reniforme ou entalhado, ou num descolamento RPE de face plana(12).
P>DAPeroso DPE pode ser imitado por angiografia fluorescente (FA), angiografia verde de indocianina (ICGA) e tomografia de coerência óptica (OCT).
FA representa, contudo, o padrão ouro para o diagnóstico de DPE seroso.
Examinado por FA, o PED seroso mostra classicamente uma hiperfluorescência uniforme precoce de toda a lesão, ligeiramente retardada em comparação com a fluorescência de fundo, que aumenta progressivamente de brilho à medida que o exame progride (pooling).
Serosa hiperfluorescência do PED normalmente não muda de tamanho ou forma durante as fases angiográficas.
FA também pode demonstrar a presença de NV, geralmente associada a PED seroso como NV de Tipo 1, como áreas de coloração indistinta da subretiniana tardia, mais evidente quando localizadas na margem do destacamento de RPE ou correspondente ao “entalhe”(11).
A presença de NV também pode ser deduzida pela presença de um componente hemorrágico do PED, o menisco escuro descrito por Gass(12).
No entanto, uma localização mais precisa do componente neovascular pode ser obtida com a ICGA digital. A molécula verde indocianina tem propriedades biofísicas que, ao contrário da fluoresceína, tornam-na útil para melhorar a anatomia dos vasos através de RPE, sangue e exsudação turva.
Em detalhe, a ICGA permite delinear melhor a presença e o tipo de novos vasos associados a um PED seroso, e por esta razão é considerada uma ferramenta fundamental na gestão desta doença(13-15).
No ICGA, o PED seroso aparece como uma lesão hipofluorescente, com margens nitidamente delineadas, que permanece constantemente hipofluorescente durante todas as fases do exame(16).
Quando os novos vasos não estão presentes, não são detectáveis sinais de áreas hipofluorescentes localizadas; o contorno do DPE é nitidamente arredondado e por isso é considerado um DPE seroso puro.
Em pacientes com DME, Yannuzzi encontrou uma incidência de 4% de DPE não vascularizado entre os DPE serosos(15).
Quando o componente neovascular está presente, foi sugerido o termo DPE vascularizado(15),.que representa aproximadamente 24% do exsudado AMD(17).
Novos vasos associados à DPE serosa estão representados em diferentes subtipos.
A videoangiografia de alta velocidade com oftalmoscópio laser de varrimento aparece como uma ferramenta preciosa que permite ao oftalmologista identificar o novo padrão de vasos e o seu comportamento angiográfico(18).
Reconhecer os diferentes tipos de NV, distinguindo os resultados angiográficos, é obrigatório para o curso natural distinto, prognóstico visual e resposta diferente ao tratamento dos três principais tipos de novos vasos associados ao PED seroso na AMD.
Os tipos mais comuns de novos vasos associados à DPE serosa são os que ocorrem a partir do coróide sob a monocamada de RPE(15-,17).
Estes novos vasos foram recentemente classificados como NV Tipo 1 e são de longe o tipo mais comum de NV na AMD(19)(Figura 1).

Figure 1 – PED vascularizado com NV Tipo 1. (A) FA, (B)ICGA e (C) OCT.
Nas fases iniciais, ICGA mostra a artéria de alimentação de NV que surge da circulação coróide, e subsequentemente a vênula de drenagem.
Ao mesmo tempo, a rede capilar da membrana neovascular pode ser detectada.
Não semelhante à fluoresceína, o verde indocianina vaza ligeiramente e a hiperfluorescência de NV é geralmente mínima, com excepção de alguns casos que mostram uma fuga intensa, considerada como vasos novos muito activos.
Frequentemente, nas fases tardias, uma área bem definida de hiperfluorescência suave correspondente à rede NV pode ser apreciável.
O segundo tipo de novos vasos complicando o PED seroso é o RAP(7,20-22), também referido como NV Tipo 3(19).
Estas lesões vasculares, como relatadas por vários autores, podem envolver a retina externa e a RPE, através de uma progressão que tem sido hipotética para ter origem na circulação da retina e/ou do coróide.
ICGA mostra tipicamente a presença de um “ponto quente”, devido à hiperfluorescência precoce do complexo neovascular intraretinal, que aumenta durante a angiografia, com uma fuga intensa nas fases tardias.
O brilho das células é aumentado pela hipofluorescência circundante do PED subjacente (Figura 2).
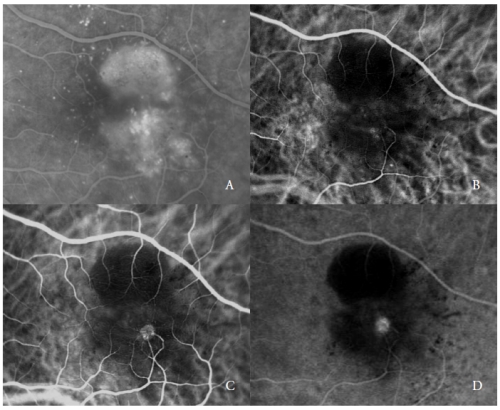
Figure 2 – PED vascularizado com NV tipo 3 (RAP). FA (A) e ICGA nas fases precoce (B) e tardia (C e D).
Nas fases tardias da doença, o complexo neovascular coróide está tipicamente ligado a um ou mais vasos da retina que parecem tortuosos e dilatados(7,22,23).
O tipo 3 NV pode ser único ou múltiplo, a sua origem é tipicamente extrafoveal, e uma hemorragia intraretinal na correspondência da lesão neovascular é frequentemente observada(20).
O terceiro tipo de novos vasos associados à DSP serosa na AMD é consistente com a vasculopatia coróide polipoidal (PCV)(24).
PCV é uma forma peculiar de VCN, caracterizada pela presença de dilatações redondas tipo pólipo, aneurismal, na fronteira de uma rede vascular ramificada de origem coróide.
Embora o VCP afecte mais frequentemente populações negras e asiáticas de meia-idade, o seu espectro clínico é alargado aos brancos, onde se verificou a sua presença em 8-13% dos doentes com lesões concomitantes da DMRI.
Nestes casos, quando as manifestações atribuíveis tanto ao VCP como à DMRI estão presentes, alguns autores consideram o VCP como um subtipo de VCN na DMRI(24,25).
A manifestação hemorrágica é comum em doentes com VCP.
DCP associada ao VCP mostra frequentemente um nível sanguíneo na porção inferior do descolamento.
ICGA é o exame de última geração para distinguir as características típicas dos dois componentes vasculares.
A rede vascular é caracterizada pela presença de uma ou mais lesões aneurismáticas que mostram uma fluorescência brilhante desde as fases iniciais, seguidas nas fases tardias por uma limpeza do corante, chamada “wash-out”, típica desta doença (Figura 3).
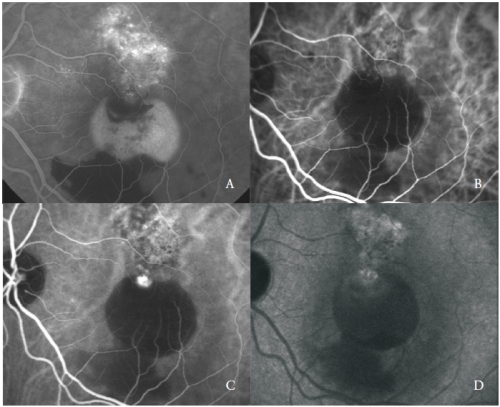
Figure 3 – PED vascularizado com PCV: FA (A) e fases iniciais (B), médias (C) e tardias (D) da ICGA.
Não obstante, algumas estruturas semelhantes ao pólipo podem apresentar fugas mostrando manchas tardias das suas paredes e exsudação circundante.
As lesões polipoidais estão geralmente localizadas na margem do PED seroso(26).
O reconhecimento destas lesões é crítico devido à sua evolução clínica, prognóstico e resposta ao tratamento diferentes em comparação com os outros subtipos da AMD neovascular.
OCT fornece imagens que permitem uma correlação exacta com os achados angiográficos.
Em rastreios OCT de secção transversal, o PED seroso aparece como uma elevação em forma de cúpula opticamente vazia da banda externa altamente reflectora – a RPE, que se desprende acentuadamente da membrana de Bruch(26).
A retina sobrejacente, geralmente aderente ao PED bolhoso, nas margens da lesão, pode ser ligeiramente descolada da RPE subjacente.
Mais informação adicional pode ser fornecida por OCT em PED vascularizado(28).
As secções tomográficas, guiadas por FA e ICGA na área correspondente ao VCN, mostram uma elevação mais suave da RPE, contínua com o descolamento seroso, com um retrocesso mais profundo, devido à presença do tecido fibrovascular.
Áreas tipo-reflectoras de espaços vazios opticamente homogéneos referenciáveis à acumulação de fluidos estão frequentemente presentes nos espaços intraretinais e subretinais(29).
Espaços vazios opticamente intra-retinais são mais pronunciados quando a DPE serosa está associada a uma NV de Tipo 3, especialmente com forma cística (Figura 4).
Ao posicionar a linha de varredura correspondente ao “ponto quente”, a anomalia neovascular é representada como uma zona pré-epitelial densa ou hiperreflectora nas camadas retinianas internas, onde as camadas hiperreflectoras externas já não são detectáveis(30).
O RPE próximo dessa lesão mostra frequentemente efracções ou interrupções na sua camada hiperreflectora(31).
A medida topográfica da retina sustenta um aumento da espessura da retina.
Em olhos com PED seroso e PCV, as lesões polipoidais mostram uma protrusão acentuada de RPE, semelhante à PED mas acentuadamente inclinada.
A cavidade de pólipos, geralmente vazia opticamente, é contígua à elevação irregular de RPE, expressão da componente neovascular oculta da lesão(32,33).
Fuído subretinal e intraretínico, observado como áreas vazias ópticas hipofluorescentes, estão relacionadas com a actividade PCV (Figura 4-B).
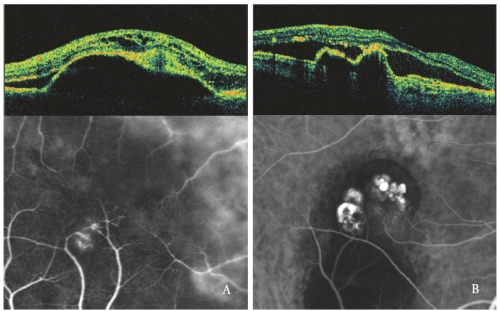
Figure 4 – Tipo 3 NV (RAP) (esquerda) e PCV (direita): Padrões OCT e ICGA.
A recente introdução da angiografia OCT (OCT-A) tornou possível a perfusão das diferentes camadas da retina, sem injecção do corante e utilizando o fluxo endoluminal como contraste intrínseco.
Figure 5 fornece um exemplo de como OCT-A imagina a rede coróide num caso de PCV.
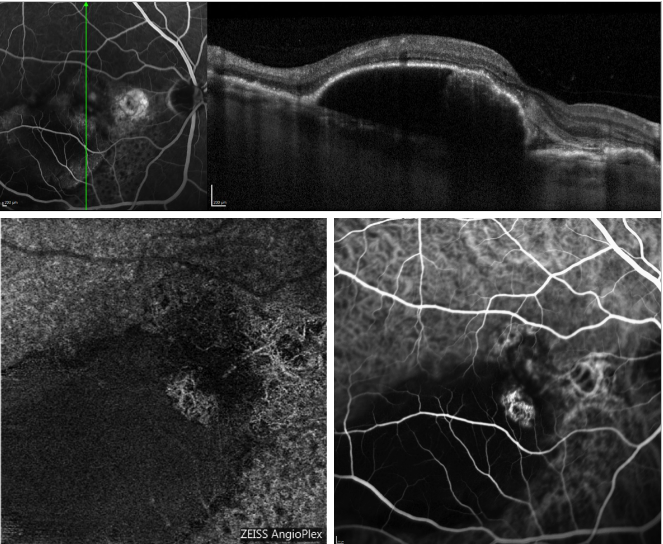
Figure 5 – Serous PED e PCV recorrente (FA, OCT, ICGA e OCT-A). No topo, OCT scan adquirido em simultâneo com FA; no fundo, aspecto do perfil dos pólipos em OCT-A (esquerda) e ICGA (direita).
No entanto, a natureza estática deste exame e a presença de possíveis artefactos são limitações importantes que devem ser reconhecidas.
Com respeito à DSP serosa, o sombreamento devido à perda de transmissão de sinal na correspondência da DSP pode dificultar a detecção do complexo VCN na OCT-A (Figura 6).
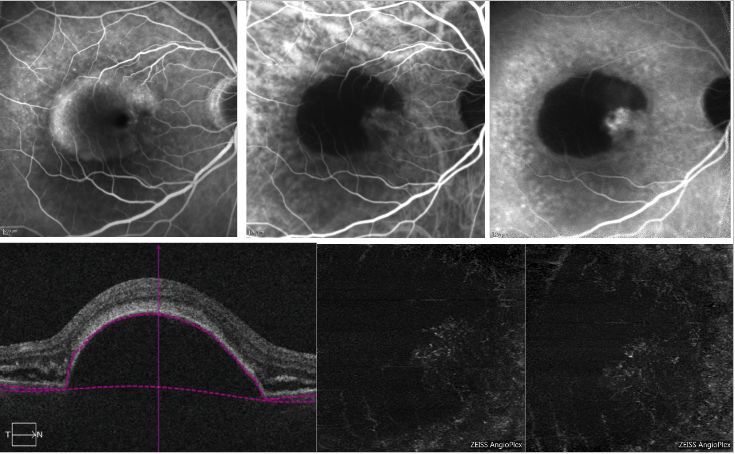
Figure 6 – DSP vascularizada e DSP serosa com NV tipo 1 (FA, ICGA e OCT-A) . Na parte superior, FA (esquerda) mostra a coloração devido à presença de um PED seroso; ICGA (superior médio e direito) mostra uma rede neovascular na extremidade do PED (entalhe); Na parte inferior, OCT-A não fornece uma imagem definida da rede neovascular.
Curso natural do PED pesado depende da presença ou não do componente neovascular(34).
No entanto, muitos podem subsequentemente desenvolver a neovascularização, o que a torna pior(35).
O curso natural na DPE vascularizada pode variar, e está relacionado com o tipo de novos vasos associados.
A complicação aguda mais comum da DPE é o rasgamento da RPE(36-39).
Ocorre normalmente na borda do DPE, na intersecção do RPE descolado e ligado.
Clinicamente, o rasgão ou rasgão do RPE aparece como uma área bem definida de coróide nu, contígua a uma área de régua hiperpigmentada mais escura, que corresponde ao monte do RPE que se rasgou(40,41).
O RPE rasgado rola geralmente em direcção ao CNV, e a sua propensão para rasgar pode ser prevista pela observação de características pré-tear, tais como um aumento no tamanho e uma modificação na forma, a presença de pequenos orifícios nas margens do PED, a presença de hemorragias ou fluido subretinal, mas os aspectos mais notáveis são o enchimento irregular do PED visível no FA, altura do PED > 580 nm, duração > 4.5 meses, linhas radiais hiper-reflexivas em imagem de reflectância próxima, menor proporção de PED vascularizado e terapia anti-vascular endotelial de factor de crescimento (anti-VEGF)(42-46).
RPE lacerações ocorrem espontaneamente ou após um tratamento, fotocoagulação formal a laser, terapia fotodinâmica e injecção intravitreal de esteróides ou agentes anti-VEGF(47- 58).
A patogénese exacta das rasgões de RPE é mal compreendida.
Cuidando com o curso natural dos DPE, foi levantada a hipótese de que forças de tosquia tangencial no DPE podem causar a quebra da membrana do porão de RPE na borda do desprendimento; contudo, é mais provável que seja o resultado de várias variáveis, onde a presença de um VCN desempenha um papel importante.
Relações causais transversais têm sido relatadas para rasgões RPE que ocorrem após o tratamento, incluindo o calor gerado pela fotocoagulação, o aumento abrupto do fluido intra-PED, uma contracção do CNV associado e a concomitante resolução súbita do fluido sub RPE.
A presença combinada de tracção vitreomacular e a deformação do globo devido ao trauma mecânico pela agulha também têm sido relatadas como agentes causadores(59).
Após o rasgo de RPE, a maioria dos pacientes queixa-se de uma súbita diminuição visual grave.
Numa pequena percentagem de olhos, onde a lágrima poupa a fovea, os pacientes podem experimentar uma preservação temporária de uma boa função visual(60).
No entanto, a longo prazo, a progressão de uma cicatriz subretiniana leva a uma grave diminuição visual. No prognóstico da DSP serosa, também deve ser considerado o elevado risco de envolvimento bilateral(61).
O tratamento da DSP serosa, associada ou não ao CNV, sempre foi um desafio e até agora não existem directrizes recomendadas para a sua gestão.
Os PED puros serosos foram tratados no passado com grelha laser ou fotocoagulação dispersa, no entanto com resultados decepcionantes(61).
O tratamento dos PED serosos, associados ou não ao CNV, foi sempre um desafio e até agora não há directrizes recomendadas para a sua gestão. PEDs serosos puros foram tratados no passado com grelha laser ou fotocoagulação dispersa, com resultados decepcionantes(62).
Nenhuma outra abordagem foi tentada para tratar estas lesões.
Quando uma rede neovascular está presente, o tratamento de PED seroso tem sido centrado na gestão do CNV. Contudo, dado que os DSP vascularizados nunca foram incluídos nos grandes ensaios controlados aleatorizados, precisamos de tomar a decisão de tratamento com base em pequenas séries publicadas, que são frequentemente retrospectivas e envolvem abordagens terapêuticas diferentes.
Agora, na era da terapia anti-VEGF, todos os tratamentos anteriormente utilizados parecem insatisfatórios.
A fotocoagulação laser tem sido amplamente empregada e pode ainda ter uma indicação limitada quando um ICGA – bem definido CNV encontra-se à distância do RPE destacado(63).
Terapia fotodinâmica de Verteporfina (PDT) por si só provou ser prejudicial, aumentando o risco de laceração RPE, hemorragias e diminuição súbita da acuidade visual(39,48,49,64) (Figura 7).
p>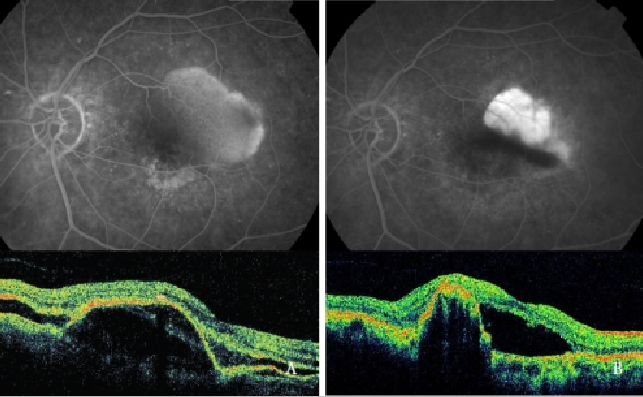
Figure 7 – PED vascularizado com CNV (Tipo 1 NV) antes (esquerda) e depois (direita) da TDP: RPE tear (FA e OCT).
No entanto, a PDT combinada com a injecção intravitreal de acetonolona triamcinolona (IVTA) demonstrou ser potencialmente capaz de estabilizar a acuidade visual e reduzir as recidivas(65).
Não obstante, as complicações de alta taxa (catarata e glaucoma) reduziram o uso de triamcinolona intravitreal.
Após os resultados encorajadores obtidos com a terapia anti-VEGF intravitreal no tratamento do VCN oculto, o uso do tratamento anti-VEGF foi alargado à DSP vascularizada com resultados decepcionantes(66-69).
As complicações agudas e a má resposta anatómica ao tratamento invalidam frequentemente as nossas tentativas de curar a lesão. As lacerações RPE e hemorragias subretinais foram relatadas como complicando os tratamentos intravitreais de ranibizumab e bevacizumab(51-57).
Além disso, o fluido sub-RPE dificilmente responde à terapia anti-VEGF, possivelmente devido às alterações de hidrocondutividade da membrana de Bruch(69).
Numa série de casos retrospectiva de 328 pacientes tratados com bevacizumab, ranibizumab, pegaptanibe e PDT+IVTA respectivamente, após um seguimento médio de 42,4 semanas, os autores relataram uma estabilização significativa da acuidade visual em cada grupo, melhor nos bevacizumab e ranibizumab em comparação com os outros dois, e uma frequência global de lágrimas RPE de 12.5%.
No entanto, concluem que com estes tratamentos, apenas se pode obter uma regressão parcial das lesões, e o risco de lacerações RPE não é evitado(69).
Outro estudo retrospectivo(58). Reviram os resultados dos pacientes de PED vascularizado tratados apenas com PDT, PDT combinado com injecções IVTA ou intravitreal anti-VEGF apenas (bevacizumab ou ranibizumab) e mostraram melhores resultados funcionais para o grupo de tratamento anti-VEGF.
Mais, nesta série, a NV Tipo 1 com DSP vascularizada em comparação com a NV Tipo 3, juntamente com uma melhor acuidade visual na linha de base, mostrou um maior risco de laceração RPE aguda após o tratamento(58).
Num estudo prospectivo recente(19), o tratamento da DSP associada à NV subfoveal Tipo 1 com injecção de ranibizumabe intravitreal e com uma fase de carga 3 meses e uma estratégia pro re nata levou a resultados apenas parciais durante um seguimento de 24 meses.
Recentemente vários estudos investigaram a eficácia da terapia intravitreal aflibercept de DAP em AMD mostrando uma boa resposta anatómica com melhoria ou nenhuma alteração significativa na acuidade visual(70-73).
Além disso, o intravitreal aflibercept demonstrou ser um tratamento promissor em DAP resistente ao tratamento intravitreal de ranibizumabe(72-74)..
Estudos transversais identificaram factores que podem influenciar a resposta da DSP ao tratamento anti-VEGF(75-78).
Dirani et al.(75) mostraram que uma melhor melhoria visual estava associada a uma menor acuidade visual de base, presença de fluido subretinal e RAP. Além disso, nas suas séries, a redução da DSP foi associada a uma DSP mais elevada na linha de base, predominantemente DSP serosa e uso de aflibercept.
Cho et al.(76), numa série de casos recente, descobriram que uma altura de DSP mais baixa na linha de base, PCV ou RAP em comparação com a DAM neovascular típica, DSP serosa em comparação com DSP fibrovascular, e aflibercept em comparação com o ranibizumabe, têm uma maior probabilidade de resolução da DSP durante o tratamento anti-VEGF de DSPs.
No entanto, numa análise post hoc recente de um ensaio aleatório controlado fase III(77), foi demonstrado que, 24 meses após o início do tratamento anti-VEGF, cerca de metade dos pacientes que apresentavam DSP na linha de base mostraram uma resolução completa da DSP independentemente do estado e altura da DSP na linha de base.
Recentemente Chen et al.(78) sublinharam a importância de diferenciar os olhos que apresentam PED, uma vez que têm melhores resultados anatómicos e funcionais com menos injecções em comparação com PED com NV.
No futuro, novas terapias combinadas e novas estratégias terapêuticas, juntamente com a identificação de novos biomarcadores clínicos de resposta ao tratamento, ajudarão a melhorar o prognóstico dos pacientes afectados por PED vascularizado.