Ao lidar com os isótopos de um elemento, é importante lembrar que eles se distinguem dos outros pela adição do número de massa ao nome do referido elemento.
No seu caso, o nome boro-11 é utilizado para designar um isótopo de boro que tem um número de massa igual a #11#.
Desde que o número de massa é definido como a soma do número de prótons e o número de neutrões que o átomo tem no seu núcleo, segue-se que pode escrever
#color(azul)(A = Z + “não. de neutrões”)” “#, onde
#A# – o número de massa
##Z# – o número atómico
Como sabe, a identidade de um elemento é dada exclusivamente pelo número de protões que tem no seu núcleo. Este número representa o número atómico do elemento.
Assim, para identificar o número atómico do boro, consulte rapidamente uma tabela periódica. Note que o boro, #”B “#, que está localizado no período 2, grupo 13 da tabela periódica, tem um número atómico igual a #5#.
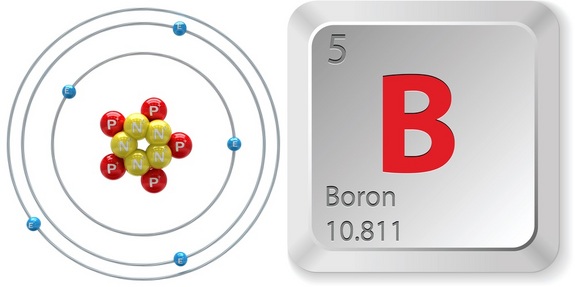
Isto significa que qualquer átomo que tenha #5# prótons no seu núcleo será um átomo de boro.
Assim, o número de massa deste isótopo de boro é igual a #11#, e o número atómico a #5#.